梁晶晶 牛悦 崔亚男 秦炯 杨志仙
[摘要] 目的
探讨进食诱发反射性癫痫患儿的临床及脑电图(EEG)特征。
方法 回顾性分析2014—2024年于我院儿科就诊的3例进食诱发反射性癫痫患儿的临床特征、EEG结果、治疗方法以及预后情况。
结果 3例患儿中2例为男性。2例起病前发育正常,1例起病前诊断为智力障碍。患儿颅脑MRI检查结果均正常,其中2例完善了家系全外显子基因检测及拷贝数变异检测,结果均为阴性。病例1起病为局灶性发作,后期出现局灶继发双侧强直-阵挛发作;EEG监测到发作间期为双侧Rolandic区放电,但未监测到进食诱发发作。病例2为清醒期局灶性癫痫性痉挛,睡眠期全面性肌阵挛发作;EEG监测到发作间期为多灶性放电及广泛性放电共存,饮水诱发3次成串右侧为主广泛性多位相慢波伴癫痫性痉挛,以及睡眠期数次自发的全面性肌阵挛发作。病例3为局灶性癫痫性痉挛和全面性强直发作共存;EEG监测到发作间期为多灶性放电及广泛性放电共存,进食诱发1次成串左侧后颅部为主的多位相慢波伴癫痫性痉挛。3例患儿均应用了2种以上抗癫痫发作药物(ASMs)未控制癫痫发作,且起病后均有不同程度智力障碍。
结论 进食诱发反射性癫痫男性患儿略多见,发病后伴随智力障碍;该病自发性发作与诱发性发作常共存,癫痫性痉挛为较常见的诱发发作类型,发作间期EEG可表现为局灶性放电、广泛性放电或两者共存;ASMs对该病疗效较差。
[关键词] 癫痫,反射性;癫痫,肌阵挛性;疾病特征;脑电描记术
[中图分类号] R742.1;R741.04 [文献标志码] A
进食诱发反射性癫痫是一种罕见疾病,以进食引起的反射性癫痫为特征,该病在发达国家患病率约为0.05%~0.10%,具有高度异质性,不同患者的临床症状和脑电图(EEG)结果不同[1-2]。在国际抗癫痫联盟提出的分类中,确定癫痫诊断时反射性癫痫发作与非诱发性癫痫发作受到同样的重视[2-3]。既往文献共报道了上百例进食诱发反射性癫痫病例,但目前国内尚缺乏相关的报道。本文分析了我院3例进食诱发反射性癫痫患儿的临床及EEG特征,旨在提高临床医师对该病的认识。现将研究结果报告如下。
1 资料和方法
收集2014年1月—2024年3月于我院儿科神经专业门诊就诊的3例进食诱发反射性癫痫患儿的临床资料,包括性别、年龄、个人史、家族史、起病年龄、自发发作类型、诱发发作类型、诱发因素、发作症状、发作持续时间、发作频率、发育情况,以及体格检查结果、辅助检查结果(视频EEG、颅脑MRI等)、治疗药物、疗效等。3例患儿均由儿科神经专科医师通过电话或门诊定期随访,智力发育等神经发育行为评估通过神经科医生和(或)相关的量表测试等进行综合评估。患儿纳入标准:①临床病史或EEG检查支持进食诱发反射性癫痫的诊断;②就诊期间于我院采用国际标准10~20系统(Neurofax,Nihon-Kohden,Tokyo,日本)进行4 h视频EEG监测,监测至少涵盖一个清醒-睡眠-觉醒周期;③均进行间断闪光刺激诱发试验、睁闭眼试验和进食诱发试验。排除标准:病史资料不全者。
2 结 果
2.1 患儿的临床及EEG特征
3例患儿病程中均有自发性及进食诱发性癫痫发作,颅脑MRI检查结果均正常。
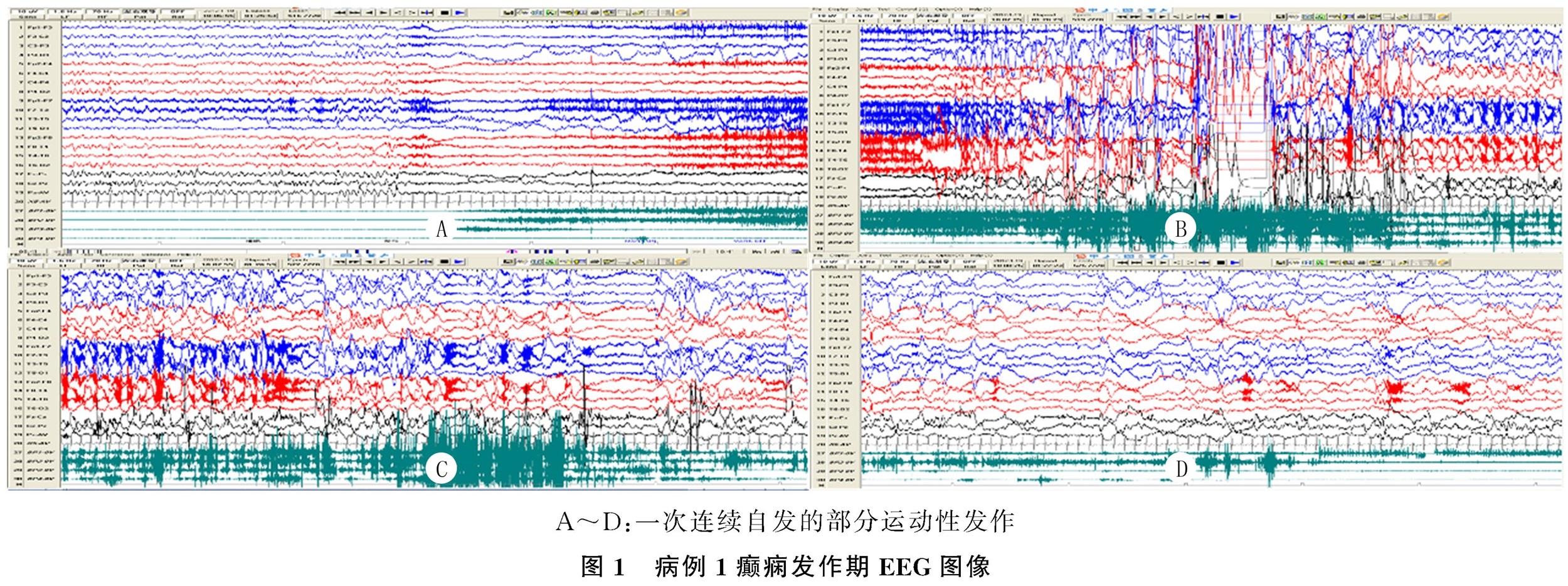
病例1为男性,3岁4个月,起病前智力发育正常。患儿癫痫发作类型起初为局灶性发作,表现为睡眠期发作,左侧面部及左侧肢体抽搐,持续10 s左右,发作频率为6~7次/d。病程中出现局灶继发双侧强直-阵挛发作,发作持续时间10~20 s,发作频率可至70~80次/d,进食即可诱发发作。发作间期EEG为双侧Rolandic区放电,非快速眼动睡眠放电指数70%,发作期监测到7次局灶运动性发作,均为自发发作。见图1。
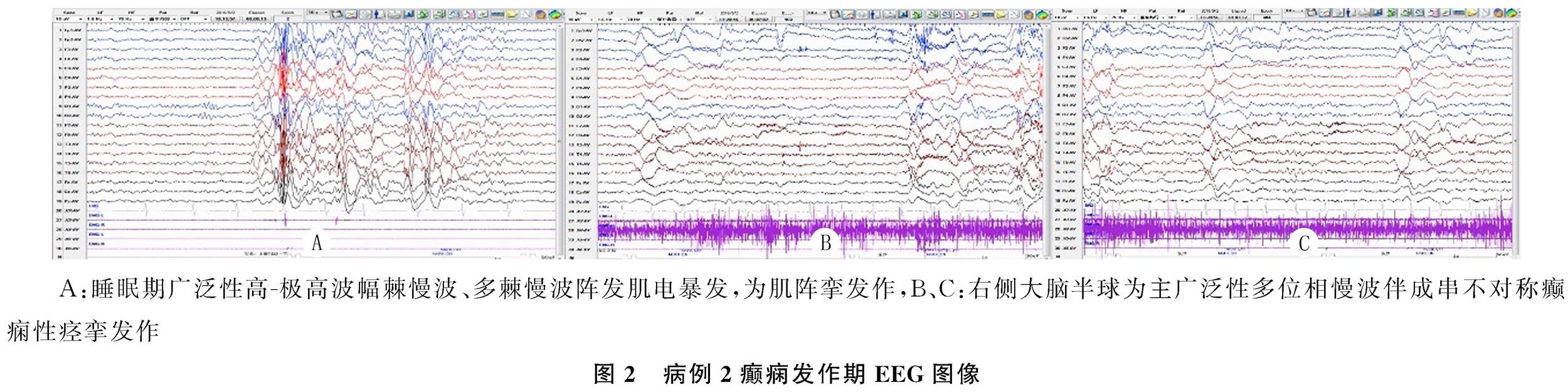
病例2为男性,6岁,起病前智力发育正常。患儿癫痫发作表现为进食或饮水时头向左偏转一下,动作成串出现,每串1~10余次不等,每天均有发作;另有自发的入睡时肢体抖动。发作间期EEG为多灶性放电及广泛性放电共存,监测到睡眠期广泛性放电伴数次自发的肌阵挛发作(图2A),以及饮水诱发3次成串右侧大脑半球为主的广泛性多位相慢波伴不对称癫痫性痉挛(图2B、C)。
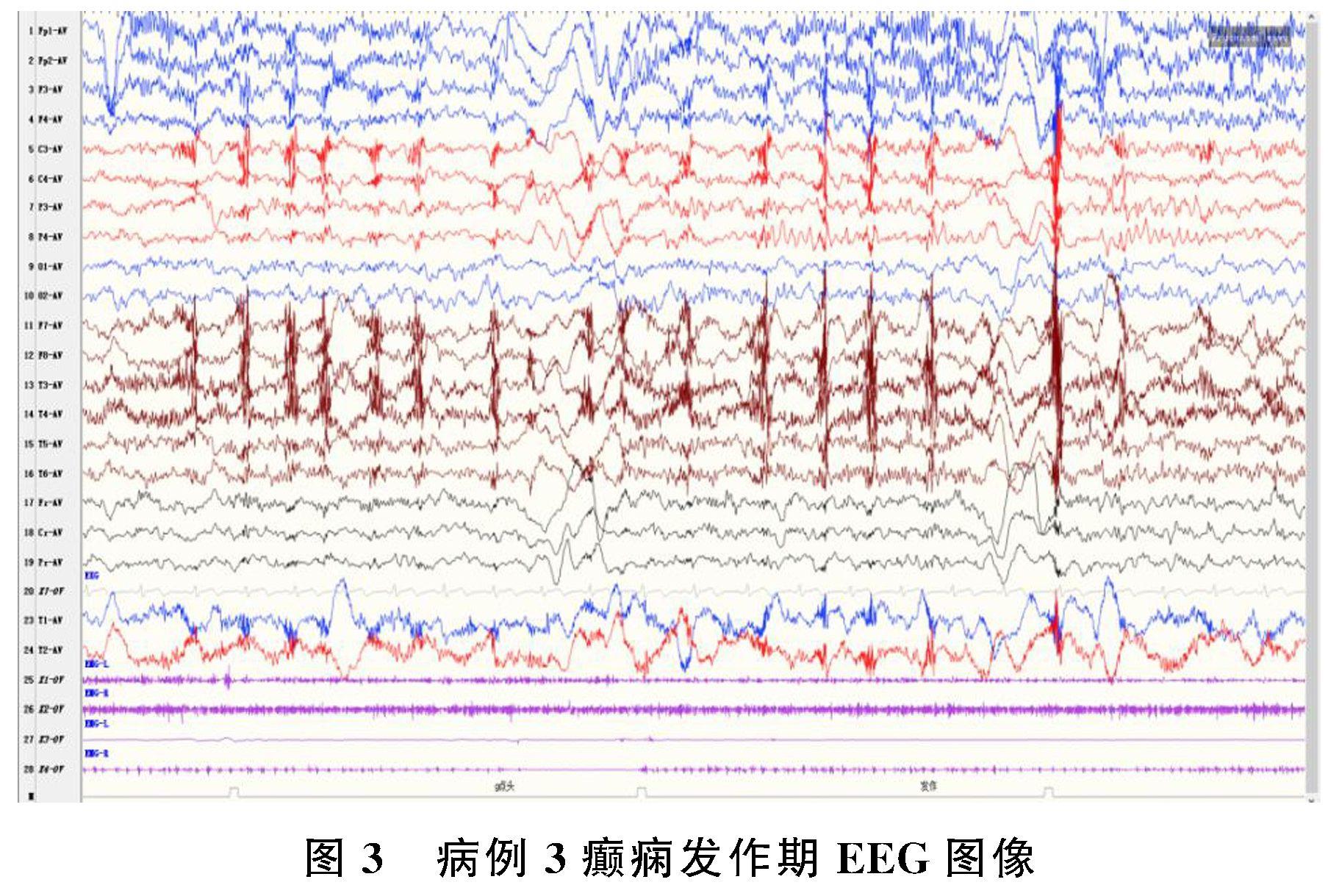
病例3为女性,8岁,起病前有轻度智力障碍。患儿癫痫发作表现多样,包括:①玩耍时动作突然停止,双手握拳,屈曲僵硬,双眼凝视,缓慢倒地,呼之不应,持续10~20 s;②反应减缓、动作减少,随后出现头及躯干向右偏斜,双眼右上斜视,呼之不应,约20 s缓解;③进食时(使用勺子时易发作,使用筷子时不易诱发)动作停止,坐立不稳,手中掉物,持续10 s缓解;④睡眠期耸肩、双眼上翻持续数秒。EEG监测到进食诱发1次成串左侧顶区为主的多位相慢波伴癫痫性痉挛(图3),既往EEG在发作间期为多灶性放电及广泛性放电共存,曾监测到睡眠期全面性强直发作及清醒期局灶性癫痫性痉挛。
2.2 患儿治疗及随访
3例患儿均采用了抗癫痫发作药物(ASMs)治疗,病例1于3岁4个月开始服用药物,病程中服用卡马西平和氯硝西泮期间最长控制2年无发作,共服用过奥卡西平、丙戊酸镁、托吡酯、硝西泮、左乙拉西坦、拉莫三嗪等六种ASMs,末次随访年龄16岁,癫痫发作未控制,智力障碍,基本生活可自理。病例2于6岁开始服用ASMs,病程中服用过丙戊酸镁、丙戊酸钠、托吡酯三种药物,末次随访年龄10岁,癫痫发作未控制,智力障碍,学习成绩不及格。病例3于8岁开始服用左乙拉西坦治疗,控制3个月无发作,病程中先后服用左乙拉西坦、丙戊酸钠、拉莫三嗪、氯硝西泮、托吡酯及吡仑帕奈共六种ASMs,癫痫发作未控制,末次随访年龄9岁,智力障碍(8岁时完善简版韦氏智力量表测试,结果提示六个分测验量表分数总和15,总智商估计值48),生活可自理,学习成绩差。3例中病例1、3完善了家系全外显子基因检测和全基因组拷贝数变异检测,结果均为阴性。
3 讨 论
反射性癫痫发作是由简单的感觉(视觉、触觉、本体感觉)或复杂的认知(阅读、说话、听音乐等)刺激引发的癫痫事件[4-5],通常伴有相同或不同类型的自发性癫痫发作。文献中报道的大多数病例均来源于南亚,国内尚缺乏进食诱发反射性癫痫的病例报道[2]。目前关于该病的发病机制尚不清楚,胃膨胀、咀嚼、吞咽及食物的化学成分均被认为是可能的刺激因素[6-7,8-11]。本文总结了3例进食诱发反射性癫痫患儿的临床及EEG特征,旨在提高临床医师对该病的认识。
既往报道中,进食诱发反射性癫痫以男性多见,进食可以是唯一的诱发因素,也可以与其他因素混杂,并且进食诱发的癫痫发作通常与症状性癫痫相关[12]。本研究3例患儿中男2例,女1例。进食诱发反射性癫痫发作大多发生在进食早期(一般在进食开始5 min内),部分可发生在进食中期或进食结束时[13]。其发作类型多样,伴知觉受损的局灶性发作是最常见的发作类型,其次是不伴知觉受损的局灶性发作及继发性全面性发作[10,13]。本研究中病例1表现为局灶性发作,病程中出现局灶继发双侧强直-阵挛发作。病例2、3表现为饮水或进食诱发成串癫痫性痉挛,并以局灶性发作为主,诱发时间在饮水或进食开始5 min内。有文献报道症状性进食诱发反射性癫痫的患者通常在发作前更容易产生先兆,且其进食诱发的发作呈丛集性特点[12]。本研究中3例患儿癫痫发作前未出现先兆症状,可能是由于患者的年龄较小,不能描述先兆症状。丛集性癫痫发作暂无明确的定义,一般认为是24 h内发作次数≥3次,或6 h内发作次数≥2次,本研究中3例患儿均表现为丛集性发作的特点。
既往文献报道的大部分进食诱发反射性癫痫均为特发性,也有部分病例伴有影像学上的结构性异常,其涉及的结构性病变部位包括颞叶或颞叶外侧脑室周围[14-17]。颞叶与杏仁核的功能相互关联,杏仁核具有较低的癫痫发作阈值并且参与重复性咀嚼运动,在进食过程中,杏仁核提供额外的刺激,降低癫痫阈值,可导致脑神经网络更快速的泛化[18-20]。本研究中3例患儿均无颅脑影像学检查异常,提示患儿可能均为特发性进食诱发反射性癫痫。此外,有文献报道婴儿或儿童起病的病例可能更常与单基因(如SYNGAP1或MECP2)变异相关,而成人发病可能部分归因于脑皮质发生病变[6,21-22]。本研究中2例患儿家系全外显子基因及拷贝数变异检测结果均为阴性,考虑特发性进食诱发反射性癫痫的遗传学病因不仅包括单基因变异,可能也存在复杂遗传因素。
本研究中3例患儿均采用了2种以上的ASMs治疗,且病程中多次调整ASMs种类,仅病例1最长控制2年无发作,病例2、3癫痫发作无长期控制,提示该病为药物难治性癫痫。末次随访时3例患儿均出现了不同程度的智力障碍,结合各患儿癫痫发作难以控制的特点,提示特发性进食诱发反射性癫痫具有癫痫性脑病和(或)伴进行性神经功能退化的特点。
总之,进食诱发反射性癫痫在发作类型、EEG特征上具有异质性,部分患儿影像学上也有异质性。本研究中3例患儿癫痫发作表现及类型多样、EEG特征也各不相同,且均为药物难治性癫痫。未来尚需积累更多的病例,以提高对进食诱发反射性癫痫的疾病特点及发病机制的认识,从而寻找更有效的治疗方法。
伦理批准和知情同意:本研究涉及的所有试验均已通过北京大学人民医院伦理委员会的审核批准(文件号2023PHB245-001)。所有试验过程均遵照《北京大学人民医院伦理委员会守则》的条例进行。受试对象或其亲属已经签署知情同意书。
[参考文献]
[1]SHORVON S D. The epidemiology and treatment of chronic and refractory epilepsy[J]. Epilepsia, 1996,37(Suppl 2):S1-S3.
[2]BOERO G, NEVE A L, PONTRELLI G. Epilepsy with seizures induced by movement: A rare reflex epilepsy[J]. Seizure, 2022,99:68-70.
[3]FISHER R S, ACEVEDO C, ARZIMANOGLOU A, et al. ILAE official report: A practical clinical definition of epilepsy[J]. Epilepsia, 2014,55(4):475-482.
[4]ITALIANO D, STRIANO P, RUSSO E, et al. Genetics of reflex seizures and epilepsies in humans and animals[J]. Epilepsy Res, 2016,121:47-54.
[5]WOLF P. Reflex epileptic mechanisms in humans: Lessons about natural ictogenesis[J]. Epilepsy Behav, 2017,71(Pt B):118-123.
[6]VON STLPNAGEL C, HARTLIEB T, BORGGRFE I, et al. Chewing induced reflex seizures (“eating epilepsy”) and eye closure sensitivity as a common feature in pediatric patients with SYNGAP1 mutations: Review of literature and report of 8 cases[J]. Seizure, 2019,65:131-137.
[7]AGUGLIA U, TINUPER P. Eating seizures[J]. Eur Neurol, 1983,22(3):227-231.
[8]ITALIANO D, FERLAZZO E, GASPARINI S, et al. Generalized versus partial reflex seizures: A review[J]. Seizure, 2014,23(7):512-520.
[9]STRIANO P, MINETTI C, ZARA F, et al. Lesional reflex epilepsy associated with the thought of food[J]. Neurology, 2010,75(3):288-289;authorreply289.
[10]KOBAYASHI Y, ISHIKAWA N, TANI H, et al. Recurrence of epileptic spasms as reflex seizures induced by eating: A case report and literature review[J]. Neuropediatrics, 2017,48(2):119-122.
[11]CIRIGNOTTA F, MARCACCI G, LUGARESI E. Epileptic seizures precipitated by eating[J]. Epilepsia, 1977,18(4):445-449.
[12]JAGTAP S, MENON R, CHERIAN A, et al. “Eating” epilepsy revisited- an electro-clinico-radiological study[J]. J Clin Neurosci, 2016,30:44-48.
[13]GIRGES C, VIJIARATNAM N, WIRTH T, et al. Seizures triggered by eating-A rare form of reflex epilepsy: A systematic review[J]. Seizure, 2020,83:21-31.
[14]VERCELLINO F, SIRI L, BRISCA G, et al. Symptomatic eating epilepsy: Two novel pediatric patients and review of literature[J]. Ital J Pediatr, 2021,47(1):137.
[15]STRIANO S, COPPOLA A, DEL GAUDIO L, et al. Reflex seizures and reflex epilepsies: Old models for understanding mechanisms of epileptogenesis[J]. Epilepsy Res, 2012,100(1-2):1-11.
[16]WOLF P, ZIFKINB, INOUEY. Reflex epilepsies: Progress in understanding[J]. Epileptic Disorders, 2005,7(1):61.
[17]PATEL M, SATISHCHANDRA P, SAINI J, et al. Eating epilepsy: Phenotype, MRI, SPECT and video-EEG observations[J]. Epilepsy Res, 2013,107(1-2):115-120.
[18]AHUJA G K, MOHANDAS S, NARAYANASWAMY A S. Eating epilepsy[J]. Epilepsia, 1980,21(1):85-89.
[19]SENANAYAKE N. Familial eating epilepsy[J]. J Neurol, 1990,237(6):388-391.
[20]FIOL M E, LEPPIK I E, PRETZEL K. Eating epilepsy: EEG and clinical study[J]. Epilepsia, 1986,27(4):441-445.
[21]CHEN W J, LIN Y, XIONG Z Q, et al. Exome sequencing identifies truncating mutations in PRRT2 that cause paroxysmal kinesigenic dyskinesia[J]. Nat Genet, 2011,43(12):1252-1255.
[22]DOUMMAR D, DENTEL C, LYAUTEY R, et al. Biallelic PDE2A variants: A new cause of syndromic paroxysmal dyskinesia[J]. Eur J Hum Genet, 2020,28(10):1403-1413.



