陈 阳, 宋良萍,察鹏飞,彭 铮,何 宇
(1.福州市皮肤病防治院整形美容外科 福建 福州 350025;2.福建国际旅行卫生保健中心 福建 福州 350001)
间充质干细胞(mesenchymal stem cells,MSCs)是机体中一小部分具有扩增和多向分化能力的非造血基质细胞,属于成体干细胞的一种,可以通过诱导向特定的细胞系进行分化,并最终达到构建特定组织的目的,由于其体外高增殖率及多向分化潜能,已成为组织工程研究中种子细胞的重要来源[1-2]。虽然骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)早已成功获取,并曾成为干细胞的主要来源,但是抽取骨髓不仅会给供体造成痛苦,而且来源有限,且存在伦理问题,所以其广泛应用受到限制[3-4]。近年来学者们研究发现,脂肪组织中也含有大量具有自我更新能力和多向分化潜能的间充质干细胞,类似于骨髓间充质干细胞的特性,也称为脂肪来源干细胞(adipose tissue-derived stem cells,ADSCs),其来源充足,且体外培养扩增速度快,不必进行永生化就能获得足够的细胞,可充分满足临床治疗需要,被认为是一种理想的组织工程种子细胞来源,并已越来越多被应用于构建组织工程研究[5-7]。而水动力辅助吸脂具有取材简便、损伤小,抽吸后残留于供区的脂肪组织仍可扩增等优点,已广泛应用于美容外科吸脂手术[8]。然而,如何分离成人ADSCs并进行体外传代培养以及多系定向诱导分化已成为目前迫切需要解决的问题。为此,参考相关学者的研究方法,并进行综合和改进,以探索ADSCs的体外分离、培养与鉴定的便捷方法,以期为其能够作为组织工程理想的种子细胞及广泛应用于临床提供实验依据,现报道如下。
1 材料和方法
1.1 脂肪组织取材:选择成人脂肪丰厚的部位,如腹、腰、臀、股等部位(图1)。皮下浸润注射局部肿胀麻醉液麻醉(肿胀液:林格氏液1 000ml+2%盐酸利多卡因15ml+肾上腺素1mg+5%碳酸氢钠溶液12.5ml),于吸脂部位隐蔽处,采用11号刀片作3~5mm皮肤切口,选用直径3.8mm抽吸灌注探针,负压设置-0.5~-0.6bar,水流喷射强度2~3级,由深层向浅层呈扇形反复抽吸获取脂肪颗粒组织(图2)。
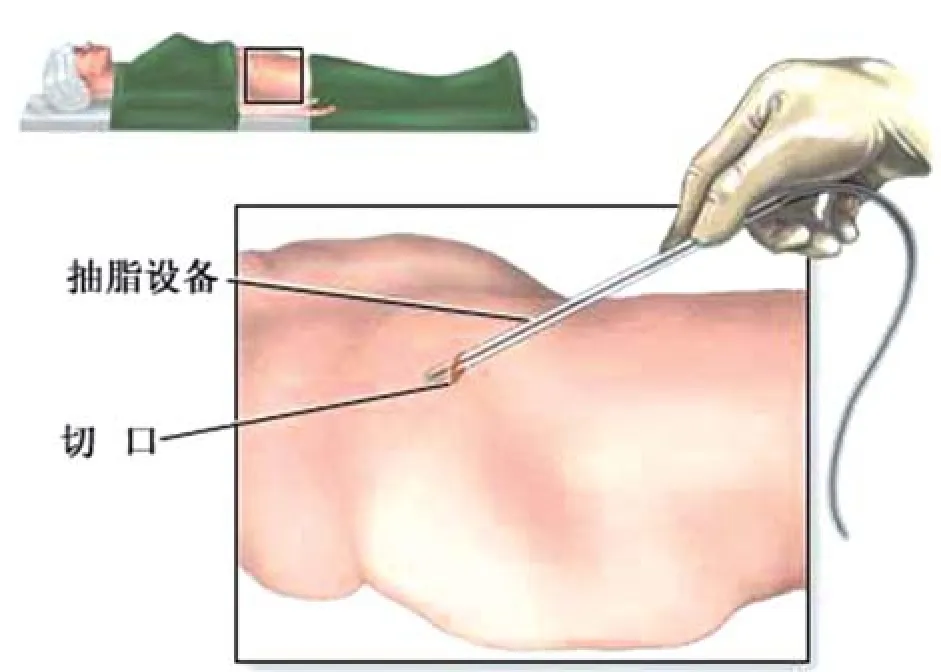
图1 腹部脂肪抽吸示意图
1.2 脂肪颗粒组织的纯化:在4℃~10℃条件下,于注射器内用林格氏液反复清洗吸取的脂肪颗粒组织,去除混杂的血液、肿胀液、破碎脂肪细胞和纤维组织,获得纯化脂肪颗粒组织。
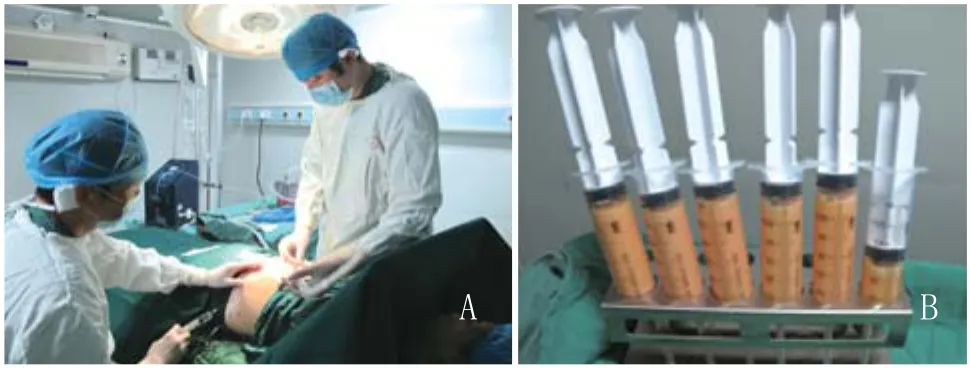
图2 水动力吸脂获取脂肪组织
1.3 试剂及耗材:高糖DMEM培养基、青链霉素原液、I型胶原酶、PBS、胰蛋白酶、地塞米松、IBMX(Gibco BRL公司),胎牛血清购自PAA公司,胰岛素购自Cenview公司,油红“O”购自Amresco公司,抗CD44单克隆抗体及细胞免疫组织化学SP Kit检测试剂盒购自zymed公司,15ml、50ml尖底离心管、25cm2培养皿、一次性3ml吸管、55cm2培养瓶(美国Corning公司),超净工作台(苏州净化总厂) ,CO2培养箱(德国Heraeus公司),脂肪来源干细胞成骨、成软骨、成脂、成肌分化诱导液(赛业广州生物科技有限公司)。
1.4 方法
1.4.1 ADSCs的分离与原代培养:取抽吸的脂肪颗粒组织约20ml,浸于DMEM基础培养基中,于取材后2h内在超净工作台中用PBS洗涤,进一步去除脂肪组织中肉眼可见的纤维及血管成分,剪切约20min,加入1%胶原酶(体积约为脂肪组织的2倍),在37℃下消化40min,并不断震荡或搅拌,用含10%胎牛血清的高糖DMEM培养基终止消化。200目滤网过滤,1 300r/min离心5min,弃去上层漂浮的脂肪细胞和培养液,沉积的细胞用少量DMEM基础培养基制成细胞悬液,吹打均匀,接种于1~2瓶50ml培养瓶内。培养瓶内加入适量含10%胎牛血清和1%青、链霉素原液的高糖DMEM培养基,混合均匀,置于37℃、5%CO2培养箱内孵育。24h后首次换液,去除悬浮细胞。随后每2~3d换液,约1周后细胞达70%~80%融合时即可进行传代培养。
1.4.2 细胞传代培养:以0.25%胰蛋白酶和0.02% EDTA进行消化,于室温下消化lmin,在倒置显微镜下观察见胞质回缩、细胞间隙增大,立即吸出消化液,加入适量基础培养基终止消化,用吸管将细胞吹打下来,800r/min离心5min。用含10%胎牛血清,1%青、链霉素原液的高糖DMEM培养基重悬沉积细胞,按1传2的比例进行传代。当传代细胞生长接近单层汇合70%时,可继续传代。
1.4.3 绘制细胞生长曲线:将细胞悬液混匀,计数,调整细胞浓度为2×104个/ml,接种于96孔细胞培养板,每孔100µl。从第2天起每日随机取3孔,胰蛋白酶消化细胞,分别用血球计数板在倒置显微镜下计数,取其均数,以时间(d)为横坐标,吸光度值(A570nm)为纵坐标,绘制生长曲线。并根据Patterson公式Td=T×lg2/lg(Nt/N0)计算出细胞群体倍增时间。
1.4.4 免疫细胞化学检测:取第2代细胞爬片用于免疫细胞化学检测。室温下,0.01mol/L PBS液洗去培养基,丙酮固定10min,PBS液漂洗3次,每次5min。加入3%H2O2,于37℃作用10min,PBS冲洗。加入3%TritonX-100,37℃下作用30min,PBS冲洗。血清封闭液37℃封闭15min,按1:200用PBS稀释的CD44-抗湿盒中4℃过夜。次晨0.01mol/L PBS液冲洗,滴加生物素标记二抗,37℃作用60min,PBS冲洗。加入HRP标记生物素抗体,37℃作用60min,PBS冲洗,DAB显色,冲洗,脱水,明胶甘油封片,荧光显微镜下观察。
1.4.5 多系定向诱导分化:取传代培养的3代细胞,胰酶消化细胞,分别用成脂细胞培养基(高糖DMEM培养基中含体积分数为10%胎牛血清,1%青、链霉素原液,10µmol/L地塞米松,10µmol/L胰岛素,20µmol/L消炎痛)、成骨细胞培养基(高糖DMEM培养基中含体积分数为10%胎牛血清,1%青、链霉素原液,0.1μmol/L地塞米松,50μmol/L抗坏血酸磷酸钠,10μmol/L β2磷酸甘油)、成软骨培养基(高糖DMEM培养基中含体积分数为10%胎牛血清,1%青、链霉素原液,6.25mg/L胰岛素, 10μg/L TGF-β,50μmol/L抗坏血酸磷酸钠)、成肌肉培养基(高糖DMEM培养基中含体积分数为10%胎牛血清,1%青、链霉素原液,50μmol/L氢化可的松)重悬细胞,接种于55cm2培养皿中,于37℃,5%CO2孵箱中培养,诱导分化2周后在相差显微镜下观察,对成脂诱导组进行油红“O”脂肪颗粒染色,对成骨诱导组进行碱性磷酸酶组化染色,对成软骨诱导组进行Ⅱ型胶原染色,对成肌诱导组进行肌浆球蛋白组化染色。
2 结果
2.1 细胞形态学观察结果:接种后细胞在24h内贴壁,初为小圆形,细胞大小不等,核/浆比例较大,细胞核几乎充满胞浆。2~4d后可见细胞伸展,大多数细胞为长梭形,核椭圆形,较大,期间也可见形态、体积不一的多种细胞成分(图3)。此后细胞增殖旺盛,原代培养的细胞7~10d后即达70%~80%融合并可进行常规传代培养,传代后细胞形态无大变化,2~4d左右可达到单层汇合约80%,可再次进行传代。体外培养10代以后,细胞的增殖速度无明显减慢。2.2 细胞生长曲线:细胞数量逐渐增多,第2天左右进入指数增长期,第6天左右到达高峰,细胞群体倍增时间约为60h(图4)。
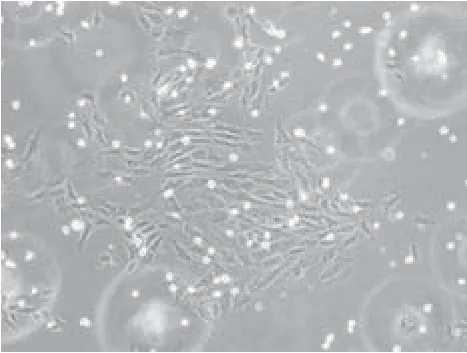
图3 传代培养后细胞生长状况
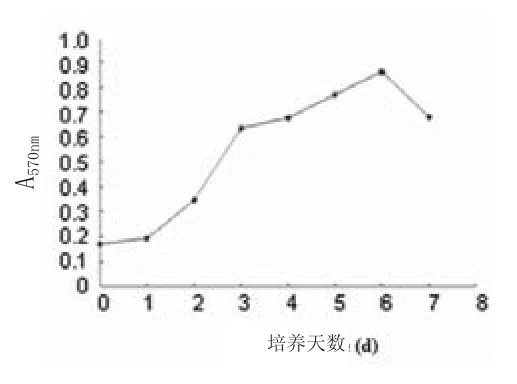
图4 传代培养第3代ADSCs生长曲线
2.3 细胞免疫化学鉴定结果:约70%的培养细胞胞浆内有大量黄褐色颗粒,显示对CD44抗原呈阳性反应(图5)。
2.4 多系定向诱导分化结果:加入成脂诱导培养基诱导培养2~4d后,培养皿中出现含有脂滴的脂肪细胞,1周后达到高峰,同时细胞中小脂滴逐渐融合,形成大的脂滴,并开始向外界分泌,此时油红“O”染色后细胞内出现大量红染颗粒,证明镜下所见细胞内颗粒确为脂滴(图6)。相同方法证实成骨诱导碱性磷酸酶组化染色呈阳性(图7),成软骨诱导Ⅱ型胶原染色呈阳性(图8),成肌诱导肌浆球蛋白组化染色呈阳性(图9)。
3 讨论
2001年,Zuk等以外科切除或吸脂方式获取的人或大鼠脂肪组织为研究对象,按照Katz等[9]的干细胞分离方法,将脂肪组织切碎,经I型胶原酶消化、离心等简单处理获得在显微镜下呈成纤维细胞形态的细胞群,称其为加工过的脂肪抽吸物细胞,体外培养过程中发现该细胞群具有稳定的倍增效应和低衰老性,且能够向多种细胞类型分化,与干细胞所特有的多向分化潜能及自我复制能力等基本特征一致。由于该细胞群可从脂肪组织抽吸物中大量分离获取,平均每300ml抽吸脂肪组织中可得到2×108~6×108个细胞,进行原代培养,传代后的细胞称为脂肪组织源性间充质干细胞, 由于该细胞具有骨髓间质干细胞的多数特性,习惯上也把这种细胞称为脂肪干细胞[10]。
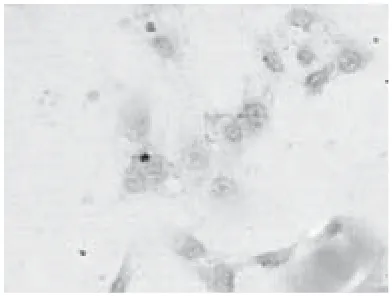
图5 传代细胞CD44呈阳性表达(免疫组织化学染色,400×)
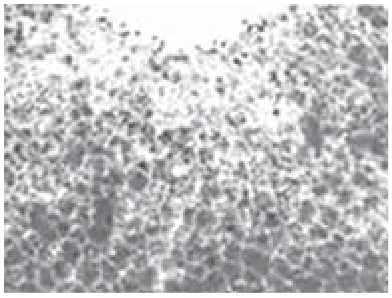
图6 成脂诱导后细胞油红“O”染色

图7 成骨诱导碱性磷酸酶组化染色阳性
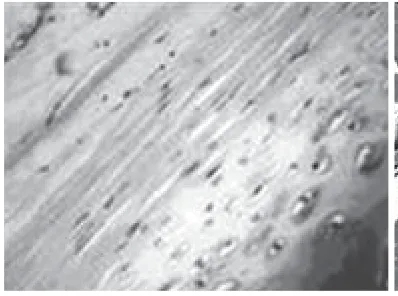
图8 成软骨诱导Ⅱ型胶原染色阳性
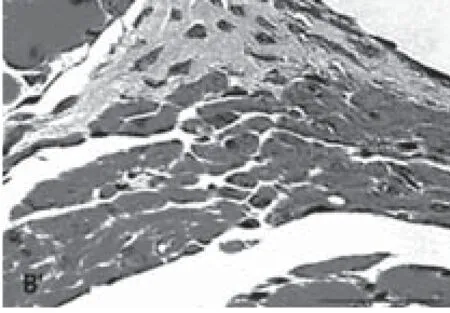
图9 成肌诱导肌浆球蛋白组化染色阳性
ADSCs是脂肪组织中的一种潜在细胞资源,具有一般ASCs的特点,在分离、培养、扩增、鉴定和分化的方法上也与大多数干细胞相同,它们可以自我更新,繁殖产生更多的干细胞,同时也可以分化成各种各样的祖细胞,后者又可进一步成熟发展成许多有特定功能的细胞系[11-12]。目前已发现ADSCs的生长特点有:①细胞呈成纤维细胞样生长,胞浆和核仁丰富,呈平行或漩涡样排列;②细胞周期分析显示G0/G1期的细胞占69%,S期占24%,G2/M期占8%;③在胎牛血清存在的条件下,传代培养的ADSCs每2~3d增殖1倍;④多次传代(10~20代)后细胞增殖速度无明显减慢,在传代6次后细胞群体中出现衰老细胞,第15代细胞群体中衰老细胞约占15%[13]。ADSCs免疫表型:经流式细胞仪分析CD9、CD10、CD13、CD29、CD44、CD49d、CD49e、CD54、CD55、 CD59、CD90、 CD105、CD117、CD146、CD166、STRO-1均为阳性,其中CD105、CD166和STRO-1被鉴定为多向分化潜能细胞的标志分子,而CD31、CD34和CD45均为阴性,而且细胞表型与BMSCs的表型基本相同[14]。脂肪组织与骨髓在胚胎发育过程中均源自中胚层,因而有学者对ADSCs与BMSCs在细胞形态、生长动力学、多向分化能力、细胞衰老性等各方面进行了比较,结果发现二者差异仅表现在以下几个方面:①来源及获取方式:BMSCs需要骨穿,经密度梯度离心方法获得,量少,而ADSCs来自脂肪组织抽吸物,简单消化离心等步骤即可获取,量大[15];②细胞表面抗原:BMSCs与ADSCs在细胞表面表达的CD抗原大多一致,但表达的细胞粘附分子略有不同[16];③体外培养方式:BMSCs体外培养时,血清质量与来源对其生长和增殖有较大影响,而ADSCs体外增殖和分化时并不需要添加特殊血清,且增殖速度快,不必进行永生化处理就能获得足够的细胞用于移植[17];④免疫标记:ADSCs缺乏表达造血细胞及内皮细胞的标记分子,如:CD3、CD4、CD11c、CD15、CD16、CD19、CD31、CD33、CD38、CD56、CD62p、CD104、CD144。ADSCs表达CD49d,不表达CD106,而BMSCs正好相反,表达CD106,不表达CD49d。另,由于ADSCs来自自体,具备免疫相容性,不会产生排斥反应和伦理学问题,也无继发传染病风险。因此,AMSCs目前已被越来越多的学者认为是理想的干细胞来源[2]。
随着对于ASCs研究的不断深入,皮下脂肪组织来源间充质干细胞分离和培养技术也逐渐得以完善,国外报道的培养方法一般为经酶消化脂肪组织后,加入NH4CL以裂解组织中的红细胞,但裂解液不仅可以裂解红细胞,同时会对干细胞造成一定的损伤。本实验在酶消化脂肪组织后,未加红细胞裂解液,而是通过频繁换液的方法去除细胞悬液中悬浮的红细胞成分,同样获得了较高浓度的干细胞成分。而且,本实验分离出的成人脂肪来源间充质干细胞多系定向诱导分化方法简单易行,又经济实惠。由此可见,本实验方法不失为一种成人脂肪来源间充质干细胞的体外分离、培养与鉴定研究的可取方法。
[1]郭淑军,刘伟,金媛,等.一种体外快速分离脂肪来源干细胞的方法[J].激光生物学报,2017,26(1):91-96.
[2]Patrick J,Schuler,Sven Brandau.Adenosine producing mesenchymal stem cells[J].Stem Cells,2017,35(6):1647-1648.
[3]Taghiyar L,Hosseini S,Hesaraki M,et al.Isolation, Characterization and osteogenic potential of mouse digit tip blastema cells in comparison with bone marrow-derived mesenchymal stem cells in vtro[J].Cell J,2017,19(4):585-598.
[4]Xiao E,He L,Wu Q,et al.Microbiota regulates bone marrow mesenchy mal stem cell lineage differentiation and immunomodulation[J].Stem Cell Res Ther,2017,8(1):213.
[5]Fresea L,Dijkman PE,Hoerstrup SP.Adipose Tissue-Derived Stem Cells in Regenerative Medicine[J].Transfus Med Hemother,2016,43(4):268-274.
[6]Przekora A,Vandrovcova M,Travnickova M,et a1.Evaluation of the potential of chitosan/β-1,3-glucan/HA material as scaffold for living bone graft production in vitro by comparison of ADSC and BMDSC behaviour on its surface[J].Biomed Mater,2017,10:1088-1093.
[7]Yang JP,Anderson AE,McCartney A,et al.Metabolically active 3-dimensional brown adipose tissue engineered from white adiposederived stem cells[J].Tissue Eng Part A,2017,23(7-8):253-262.
[8]张倩,时杰,李晓殿,等.Body-jet水动力辅助吸脂系统行自体脂肪隆乳术的临床应用[J].中国美容整形外科杂志,2015,26(9):547-549.
[9]Katz AJ,Llull R,Hedrick MH,et al.Emerging approaches to the tissue engineering of fat[J].Clin Plast Surg,1999,26(4):587-596.
[10]叶媛,鲁峰,李青峰,等.脂肪来源干细胞和血管基质片段的研究进展[J].中华整形外科杂志,2017,33(2):153-157.
[11]Wang BS,Yang HY,Han Y.Study on the survival rate of random flap using pre-injection of ADSCs[J].Zhonghua Yi Xue Za Zhi,2016,96(36):2912-2916.
[12]Meza-Ríos A,García-Benavides L,García-Bañuelos,et al.Administration of ADSCs-Based Therapy and Gene Therapy Using Ad-huPA Reduces Experimental Liver Fibrosis[J].PLoS One,2016,11(12):1371-1375.
[13]Chen J,Gu Z,Wu M,et al.C-reactive protein can upregulate VEGF expression to promote ADSC-induced angiogenesis by activating HIF-1α via CD64/PI3k/Akt and MAPK/ERK signaling pathways[J].Stem Cell Res Ther,2016,7(1):114-117.
[14]Mashhadikhan M,Soleimani M,Parivar K,et al.ADSCs on PLLA/PCL Hybrid Nanoscaffold and Gelatin Modifi cation: Cytocompatibility and Mechanical Properties[J].Avicenna J Med Biotechnol,2015,7(1):32-38.
[15]Martínez MA,Trillo MÁ,Cid MA,et al.Power-Frequency Magnetic Field Inhibits Adipogenic Differentiation in Human ADSC[J].Cell Physiol Biochem,2015, 37(6):2297-2310.
[16]Song K,Yang Y,Xu L,et al.Fabrication and detection of tissue engineered bone aggregates based on encapsulated human ADSCs within hybrid calcium alginate/bone powder gel-beads in a spinner fl ask[J].Mater Sci Eng C Mater Biol Appl,2016,62(6):787-794.
[17]Lough DM,Chambers C,Germann G,et al.Regulation of ADSC Osteoinductive Potential Using Notch Pathway Inhibition and Gene Rescue: A Potential On/Off Switch for Clinical Applications in Bone Formation and Reconstructive Efforts[J].Plast Reconstr Surg,2016,138(4):642-652.



