侯 波,有 慧,王 含,赵彦萍,姜 波,孙宏毅,崔丽英,冯 逢
中国医学科学院 北京协和医学院 北京协和医院 1放射科 2神经科,北京 1007303中国中医科学院 广安门医院放射科,北京 100053
·论着·
基于体素的多系统萎缩梯度回波横向弛豫率R2*分析
侯 波1,有 慧1,王 含2,赵彦萍3,姜 波1,孙宏毅1,崔丽英2,冯 逢1
中国医学科学院 北京协和医学院 北京协和医院1放射科2神经科,北京 100730
3中国中医科学院 广安门医院放射科,北京 100053
目的对震颤麻痹型多系统萎缩(MSA-P)患者与正常人的梯度回波横向弛豫率R2*进行基于体素的分析,探索其全脑R2*情况的差异。方法入组27例MSA-P患者及24例健康志愿者,分别行全脑结构成像及多回波梯度回波成像,然后对其R2*图进行基于体素的分析。结果与对照组相比,MSA-P组R2*值减低累及双侧脑干、小脑半球、岛叶、颞叶、尾状核及胼胝体,差异具有统计学意义(Plt;0.005)。结论R2*可以反映MSA-P患者脑内变化,梯度回波序列在提高灵敏度的同时,也带来了较强的伪影,干扰了其检出效能。
多系统萎缩;磁共振成像;弛豫率测量
ActaAcadMedSin,2012,34(5):450-454
横向弛豫是磁共振成像的物理基础之一。多种生理或病理过程可造成局部水分或铁成分增加或减少,从而影响局部的组织横向弛豫率。因此,横向弛豫率可敏感地反映局部组织微结构的变化,有望先于宏观改变表现出异常[1]。多系统萎缩(multiple system atrophy, MSA)是一种较常见的神经系统退行性疾病,其常表现为运动缓慢、姿势不稳、强直等帕金森综合征,该病变累及脑内多个区域,具有多种神经病理学征象[2]。本研究计算MSA患者与正常人的梯度回波横向弛豫率R2*,并使用基于体素的方法进行比较,展示两者全脑R2*值的差异,从而进一步了解MSA的病变机制。
对象和方法
对象选取2009年3月至2011年11月就诊于我院神经内科的震颤麻痹型多系统萎缩(parkinsonian variant of multiple system atrophy, MSA-P)患者27例,并由社区招募健康志愿者24例。MSA-P患者中男性13例、女性14例;年龄43~62岁,平均年龄(53.3±5.5)岁;病程5~61个月。健康志愿者中男性7例、女性17例;年龄46~62岁,平均年龄(53.4±4.7)岁。所有受试者均由同一名运动障碍病专家进行神经科查体并依据通用的诊断标准确定入组,其中MSA-P为依据新版Gilman共识[2]诊断为很可能。病例组及对照组所有个体均为右利手,均否认神经及精神系统病史以及高血压、高血脂、糖尿病等心、脑血管病危险因素。受试者于检查前被详细告知研究目的及方法,并签署知情同意书。
影像采集使用GE Signa VH/i ExciteⅡ3.0T磁共振成像系统和头部8通道相控阵线圈,全部扫描由同一名熟练的操作者完成。在常规头部成像序列之后,采集全脑轴位T1加权三维结构像,所用序列为三维快速扰相梯度回波序列,成像参数为回波时间3.3 ms,重复时间6.9 ms,反转时间400 ms,翻转角15°,激励次数1.00,视野24 cm×18 cm,成像矩阵256×256,层厚0.8 mm,共216层。使用多回波梯度回波序列采集全脑轴位多回波T2*加权像,成像参数为回波时间3.5~59.6 ms,回波间隔3.8 ms,共16回波,重复时间170 ms,翻转角20°,激励次数1.00,视野24 cm×19 cm,成像矩阵160×160,层厚2 mm,层间距0.5 mm,共55层,扫描时长11 min。 所有图像均通过逐一察看确保无显着运动伪影。
图像后处理及分析
R2*的计算:所有受试者T2*加权像原始图像传至GE AW4.2工作站,使用Functool下的R2*功能块进行处理,生成对应每名受试者的R2*图。
R2*图的空间预处理:在Matlab7.8.0(R2009a)下使用最新版SPM8进行空间预处理,步骤如下:(1)将所有受试者的结构像使用DICOM Import转换为SPM8可处理的格式;(2)通过刚体变换将每位受试者第二回波(回波时间7.3 ms)的全脑T2*加权像与各自的结构像进行配准,并将变换参数应用于对应的R2*图;(3)对所有受试者的结构像进行统一分割和标准化,并进行调制,以尽量减轻标准化时的空间变形造成的失真[3],同时取得其空间变形参数;(4)将上一步获取的空间变形参数应用至步骤(2)配准后对应受试者的R2*图,从而完成后者的空间标准化,使之变换至标准的蒙特利尔神经病学研究所(Montreal Neurologieal Institute, MNI)空间;(5)使用全宽半高为8 mm的高斯核对所有标化后的R2*图进行平滑;(6)将所有个体平滑后的R2*图取平均即得到R2*模板;(7)以生成的模板对所有的原始R2*图再次进行标准化和平滑。
统计学处理受试者一般资料的分析使用IBM SPSS 19.0软件。MSA-P及正常人的年龄及性别数据分别进行两独立样本t检验和卡方检验,Plt;0.05为差异具有统计学意义。使用统计参数图软件的一般线性模型将MSA-P的R2*图与对照组进行两独立样本t检验,Plt;0.005为差异具有统计学意义,簇阈值设为10个相邻体素。统计学分析同时采用阈值蒙片和影像蒙片,阈值蒙片将阈值设为影像信号强度大于30,影像蒙片使用SPM8自带的全脑蒙片。
结果的输出及解剖定位导出依据设定的标准生成的有统计学意义的各簇的P值及极值点的MNI坐标,使用xjview(http://www.alivelearn.net/xjview/)将统计参数图生成的统计结果叠加至标准解剖成像模板,设定适当的阈值和P值得到t值分布图并以簇为单位,得到各簇的解剖定位。
结 果
受试者一般资料MSA-P组中2例患者分别因脑实质内海绵状血管瘤及小脑发育性静脉畸形被排除出组,另有2例因运动伪影及空间变形错误被排除出组,剩余受试者未见任何显着的颅内微出血或钙化等异常。余MSA-P与对照组在年龄(t=-0.072,P=0.943)及性别(χ2=0.782,P=0.377)分布上差异无统计学意义。
R2*的组间比较MSA-P与对照组相比,出现显着的R2*减低区域,主要分布在双侧下橄榄核、小脑半球灰白质、脑桥、中脑、胼胝体、尾状核、岛叶、颞叶及额叶,受累区域较为对称(图1、表1)。反向比较未见显着的R2*升高区域。
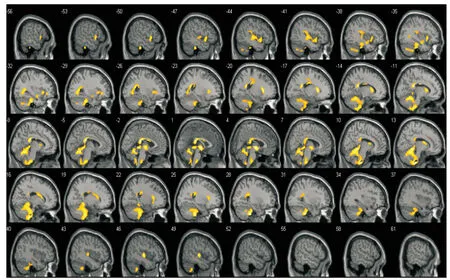
图1 震颤麻痹型多系统萎缩组较对照组横向弛豫率减低的簇分布图,Plt;0.005(非校正),簇阈值设为10个相邻体素Fig 1 Clusters of significant decrease of R2* in patients with the Parkinsonian variant of multiple system atrophy compared with controls, Plt;0.005(uncorrected); the cluster threshold was set as 10 voxels

表 1 震颤麻痹型多系统萎缩组较对照组R2*减低的簇及极值点坐标Table 1 Clusters and peak values of significant decrease of R2* in patients with theParkinsonian variant of multiple system atrophy compared to controls
讨 论
本研究以R2*作为定量参数,结合基于体素的分析方法,将年龄及性别分布无统计学意义的MSA-P组与对照组进行组间差异的比较,结果显示MSA-P组较对照组具有分布广泛的R2*减低区域,涉及幕下的下橄榄核、小脑、脑桥和中脑,以及幕上区域如尾状核、岛叶、额叶、颞叶及胼胝体。这与以往使用R2作为定量指标的类似研究所取得的结果具有一定的一致性[4-6]。其中Specht等[4]最早以4回波的自旋回波序列对共济失调型多系统萎缩(cerebellar variant of multiple system atrophy, MSA-C)患者进行横向弛豫率R2的计算,并使用基于体素的方法进行全脑分析,结果表明MSA-C患者双侧小脑半球弥漫地R2减低并延伸至双侧小脑中脚及脑桥,其与形态测量学分析显示的幕下改变较吻合;反向对比显示,双侧壳核区域R2值升高。Minnerop等[5]使用相同的方法比较了MSA-P与MSA-C横向弛豫率及灰、白质密度的差异,并与病程进行了回归分析,表明MSA-P患者幕下结构的R2值减低。Tzarouchi等[6]报道MSA-P患者与对照组相比,额叶及顶叶部分皮层区域的T2值升高。
本研究显示MSA-P患者R2*减低的区域与之前进行的弥散张量成像研究结果具有较好的相符[7],主要在幕下区域如小脑半球、脑干等,以及幕上的岛叶、额叶等,这从另一方面证实了MSA-P在这些区域具有显着的异常。组织学研究报道了这些区域的病理改变,如下橄榄核、黑质等处的神经元丧失及反应性胶质增生,脑桥、中脑、小脑等可见大量包涵体存在,小脑颗粒细胞层变薄和蒲肯野细胞的散在丧失,且小脑白质受损较灰质更加明显[8-15]。另外,Brenneis等[16]进行的形态测量学研究显示,MSA-P患者存在胼胝体干的白质减少;Minnerop等[17]则通过纵向的形态测量学研究证实了MSA患者胼胝体干及压部的进行性萎缩。而对于MSA患者突出病变区域的脑桥,基于体素的弛豫率分析并未显示其基底部弥漫性的R2*减低,通过回顾原始图像可以得出,脑桥处于双侧岩骨及斜坡之间,此处产生了较强的磁敏感伪影干扰脑组织的信号,从而使计算出的弛豫率受到影响。同样的情况在前颅底及前额均可见,不除外局部弛豫率受到磁敏感伪影的影响而无法显示局部R2*的变化情况。
R2*减低对应局部横向弛豫时间延长,表明这些区域可能由于神经退行性改变如神经元丧失、胶质增生或脱髓鞘等造成局部水分增加。当局部组织含有顺磁性物质如含铁血黄素等时,局部质子弛豫速度加快,R2*升高。对于MSA-P而言,常规磁共振成像的T2加权像及T2*加权像均显示壳核背外侧边缘信号减低,磁敏感加权成像的相关研究也显示局部相位位移值的变化,这些都提示壳核背外侧的铁沉积[18-20];与磁共振成像对照的组织学研究表明壳核神经元丧失及局部铁蛋白沉积的增加[8-9];有研究也证实了双侧壳核区域R2值升高[4]。本研究MSA-P患者在上述区域的R2*值较对照组无统计学意义,可能与本组患者的病程较短有关。常规磁共振成像上MSA-P基底节区显着的改变为壳核萎缩,裂隙征(即壳核背外侧裂隙样T2信号升高),以及壳核外侧边缘T2信号减低[21]。结合病理学表现,其可能的机制为:壳核神经元丧失导致壳核体积减小,进而与外囊间距增加,局部水分及反应性胶质增生随之增加,造成裂隙征的表现;壳核发生继发的铁蛋白等含铁物质沉积,造成局部T2信号减低。局部水分的增加使局部横向弛豫率减低,而局部含铁物质的增加却可提高局部横向弛豫率。另外,对于梯度回波序列而言,由于只进行小角度脉冲的激发,缺少相位重聚脉冲,其容易受到局部磁场不均匀性的干扰,也能够最真实地反映局部的横向弛豫情况,而缺点是会产生明显的磁敏感伪影且伪影面积随回波时间的延长而扩大,影响周围组织的横向弛豫,使整个局部的R2*值显着升高。
综上,本研究显示R2*作为定量指标,能够在全脑多个区域反映MSA-P与对照组的差异,这些区域与既往的自旋回波横向弛豫率及弥散张量成像研究具有良好的一致性,且与MSA病理学研究具有较好的相符,这对认识MSA-P的病变机制及早期诊断均具有重要意义。梯度回波序列能够缩短横向弛豫率测量所需的时间,且能敏感地反映局部微结构改变造成的磁场不均匀性,但实际结果表明,其在带来时间效益和灵敏度的同时,容易产生明显的伪影对某些区域产生影响,从而减弱其检出效能。
[1] Deoni SC. Quantitative relaxometry of the brain[J]. Top Magn Reson Imaging, 2010,21(2):101-113.
[2] Gilman S, Wenning GK, Low PA, et al. Second consensus statement on the diagnosis of multiple system atrophy[J]. Neurology, 2008,71(9):670-676.
[3] Good CD, Johnsrude IS, Ashburner J, et al. A voxel-based morphometric study of ageing in 465 normal adult human brains[J]. Neuroimage, 2001,14(1 Pt 1):21-36.
[4] Specht K, Minnerop M, Muller-Hubenthal J, et al. Voxel-based analysis of multiple-system atrophy of cerebellar type: complementary results by combining voxel-based morphometry and voxel-based relaxometry[J]. Neuroimage, 2005,25(1):287-293.
[5] Minnerop M, Specht K, Ruhlmann J, et al. Voxel-based morphometry and voxel-based relaxometry in multiple system atrophy a comparison between clinical subtypes and correlations with clinical parameters[J]. Neuroimage, 2007,36(4):1086-1095.
[6] Tzarouchi LC, Astrakas LG, Konitsiotis S, et al. Voxel-based morphometry and voxel-based relaxometry in parkinsonian variant of multiple system atrophy[J]. J Neuroimaging, 2010,20(3):260-266.
[7] 侯波, 有慧, 王含, 等. 多系统萎缩弥散张量成像的基于体素分析[J]. 中国医学影像学杂志, 2012,20(5):363-367,371.
[8] Schwarz J, Weis S, Kraft E, et al. Signal changes on MRI and increases in reactive microgliosis, astrogliosis, and iron in the putamen of two patients with multiple system atrophy[J]. J Neurol Neurosurg Psychiatry, 1996,60(1):98-101.
[9] Konagaya M, Sakai M, Matsuoka Y, et al. Pathological correlate of the slitlike changes on MRI at the putaminal margin in multiple system atrophy[J]. J Neurol, 1999,246(2):142-143.
[10] Konagaya M, Sakai M, Matsuoka Y, et al. Multiple system atrophy with remarkable frontal lobe atrophy[J]. Acta Neuropathol, 1999,97(4):423-428.
[11] Wakabayashi K, Ikeuchi T, Ishikawa A, et al. Multiple system atrophy with severe involvement of the motor cortical areas and cerebral white matter[J]. J Neurol Sci, 1998,156(1):114-117.
[12] Wenning GK, Ben-Shlomo Y, Magalhaes M, et al. Clinicopathological study of 35 cases of multiple system atrophy[J]. J Neurol Neurosurg Psychiatry, 1995,58(2):160-166.
[13] Wenning GK, Tison F, Ben SY, et al. Multiple system atrophy: a review of 203 pathologically proven cases[J]. Mov Disord, 1997,12(2):133-147.
[14] Burn DJ, Jaros E. Multiple system atrophy: cellular and molecular pathology[J]. Mol Pathol, 2001,54(6):419-426.
[15] Ubhi K, Low P, Masliah E. Multiple system atrophy: a clinical and neuropathological perspective[J]. Trends Neurosci, 2011,34(11):581-590.
[16] Brenneis C, Seppi K, Schocke MF, et al. Voxel-based morphometry detects cortical atrophy in the Parkinson variant of multiple system atrophy[J]. Mov Disord, 2003,18(10):1132-1138.
[17] Minnerop M, Luders E, Specht K, et al. Callosal tissue loss in multiple system atrophy-a one-year follow-up study[J]. Mov Disord, 2010,25(15):2613-2620.
[18] Wang Y, Butros SR, Shuai X, et al. Different iron-deposition patterns of multiple system atrophy with predominant parkinsonism and idiopathetic Parkinson diseases demonstrated by phase-corrected susceptibility-weighted imaging[J]. AJNR Am J Neuroradiol, 2012,33(2):266-273.
[19] 冯逢, 有慧, 胡凌, 等. 磁敏感加权成像鉴别多系统萎缩与特发性帕金森病的初步研究[J]. 中国医学影像技术, 2007,23(6):781-784.
[20] 冯逢, 有慧, 王含, 等. 相位加权成像在多系统萎缩与帕金森病的鉴别诊断中的作用[J]. 中国医学科学院学报, 2009,31(2):129-133.
[21] Brooks DJ, Seppi K. Proposed neuroimaging criteria for the diagnosis of multiple system atrophy[J]. Mov Disord, 2009,24(7):949-964.
Voxel-basedRelaxometryofTransverseRelaxationRatewithGradientEchoR2*inPatientswithMultipleSystemAtrophy
HOU Bo1, YOU Hui1, WANG Han2, ZHAO Yan-ping3, JIANG Bo1,SUN Hong-yi1, CUI Li-ying2, FENG Feng1
1Department of Radiology,2Department of Neurology, PUMC Hospital, CAMS and PUMC, Beijing 100730, China
3Department of Radiology, Guang’anmen Hospital, China Academy of Chinese Medical Sciences, Beijing 100053, China
FENG Feng Tel: 010-69155480,E-mail:cjr.fengfeng@vip.163.com
ObjectiveTo explore the transverse relaxation rate with gradient echo R2*changes in patients with Parkinsonian variant of multiple system atrophy (MSA-P) with a voxel-based analysis of R2*map.MethodsWhole brain structural images and multi-echo T2*weighted image were acquired in 27 patients with probable MSA-P and 24 healthy individuals. R2*maps of the MSA-P were compared with the controls by voxel-based methods.ResultCompared with the controls, MSA-P patients showed significant R2*decrease bilaterally in brain stem, cerebellar hemispheres, insular lobe, temporal lobes, caudate nucleus, and corpus callosum (Plt;0.005).ConclusionsR2*can reveal the significant brain involvements of MSA-P. The introduction of gradient echo may increase the sensitivity, although the susceptible artifact may interfere the detection efficiency of R2*.
multiple system atrophy; magnetic resonance imaging; relaxometry
冯 逢 电话:010-69155480,电子邮件:cjr.fengfeng@vip.163.com
R445.2
A
1000-503X(2012)05-0450-05
10.3881/j.issn.1000-503X.2012.05.003
国家自然科学基金(30670608)Supported by the National Natural Sciences Foundation of China(30670608)
2012-07-16)



