叶文玲,方理刚,马 杰,李雪梅
中国医学科学院 北京协和医学院 北京协和医院 1肾内科 2心内科,北京 100730
自体动静脉内瘘 (arteriovenous fistula,AVF)是终末期肾病血液透析患者血管通路的最佳选择,合适的AVF流量 (Qa)是保证患者透析充分的先决条件,流量过高或过低都可能影响患者的长期预后。低Qa是通路功能不良的指标,影响血液透析的充分性,而高Qa则可能增加心输出量 (cardiac output,CO),有引发高输出量心力衰竭的风险。目前,有关AVF对血液动力学影响的研究多局限于AVF建立后数周至数月内[1-4],长期AVF存在对血液透析患者心血管系统的作用尚不清楚,尤其对心脏结构和功能的影响研究甚少。本研究旨在探讨建立1年以上的AVF对患者血液动力学以及心脏结构和功能的可能影响。
对象和方法
对象 2010年6月至2010年12月在北京协和医院肾内科使用AVF作为血管通路的非糖尿病肾病慢性肾衰竭规律血液透析患者50例,其中,男24例,女26例,平均年龄 (49.8±9.0)岁 (21~59岁),平均血液透析维持时间 (83.2±56.1)个月(12~216个月)。肾脏基础疾病为慢性肾小球肾炎(42%)、良性肾硬化 (14%)、多囊肾 (8%)、以及间质性肾炎、紫癜性肾炎等或病因不清者。入选标准:(1)年龄18~60岁;(2)接受每周3次规律血液透析;(3)使用AVF作为血管通路透析1年以上。排除标准:(1)糖尿病肾病或合并糖尿病者;(2)先天性或风湿性心脏病、急性心肌梗死或陈旧性心肌梗死、肺原性心脏病等可能影响心脏结构和功能的疾病;(3)免疫系统疾病可能累及心脏者;(4)拒绝参加本研究者。本研究经北京协和医院伦理委员会批准,所有受试者者均签署知情同意书。
Qa及血液动力学检测 采用HD02型血液透析监护仪 (美国Transonic公司),参照仪器操作指南,检测步骤参见文献 [5],具体如下:将预先冲洗生理盐水的Flow-QC Asia专用管路与动静脉穿刺针分别连接,在动静脉管路正常连接状态下,向静脉小壶内注入10 ml生理盐水,检测通路再循环率,所有入选的患者通路再循环率均为0;将动静脉管路反向连接,注入10 ml生理盐水,检测AVF Qa;再将动静脉管路正向连接,即时记录血压及心率,将血泵速度设置为200 ml/min,5~7 s内在Flow-QC Asia管路接口注入30 ml预热至37℃的生理盐水,检测心搏出量 (stoke volume,SV)、CO、心脏指数 (cardiac index,CI)、中心血容量 (central blood volume,CBV)、外周血管阻力 (peripheral vascular resistance,PR)等血液动力学参数。检测于血液透析1 h完成,检测重复两次,取平均值。
心功能分级 心脏功能根据美国纽约心脏病学会 (New York Heart Association,NYHA)心功能分级标准:Ⅰ级,活动量不受限制,平时一般活动不引起疲乏、心悸、呼吸困难或心绞痛;Ⅱ级,体力活动受到轻度的限制,休息时无自觉症状,但平时一般活动下可出现疲乏、心悸、呼吸困难或心绞痛;Ⅲ级,患者体力活动明显限制,小于平时一般活动即引起上述症状;Ⅳ级,不能从事任何体力活动,休息状态下也出现心力衰竭症状,体力活动后加重[6]。
超声心动图检查 采用GE Vivid E9彩色多普勒超声诊断仪,探头频率1.7/3.4 MHz,数字化方式记录胸骨旁左室长轴、胸骨旁左室短轴二尖瓣和乳头肌水平、心尖四腔心、心尖二腔心和心尖左室长轴完整的超声心动图二维切面、M型超声、频谱多谱勒以及组织多谱勒图像,并同步记录心电图。超声心动图检查选择在透析后次日进行,使患者水负荷更接近于机体平均负荷状态。所有心脏超声检测由对患者临床资料不了解的资深心脏超声医生专人完成。参照美国超声心动图协会指南[7],采用 GE EchoPAC软件进行图像分析。在二维超声和M型超声中进行以下指标测量:主动脉直径、左房直径、室间隔和左室后壁厚度、左室舒张末直径 (left ventricular end-diastolic dimension,LVEDD)、左室收缩末直径 (left ventricular end-systolic dimension,LVESD)、左室短轴缩短分数 (left ventricular fractional shortening,LVFS)以及左室射血分数 (ejection fraction of left ventricular,LVEF)。在心尖四腔心切面测量左心房及右心房面积。用脉冲多谱勒测量二尖瓣瓣口水平血流频谱,记录E、A峰速度比值 (E/A)。根据三尖瓣反流峰值速度估测肺动脉收缩压 (pulmonary artery systolic pressure,PASP),PASP=4×三尖瓣反流峰值速度2+右房压。
统计学处理 采用SPSS 13.0统计软件包,数据以均数±标准差表示,资料分布使用K-S检验,AVF Qa与血液动力学参数关系采用曲线拟合法,选择最优拟合回归型;3个不同Qa组间资料先行K-S检验证实符合正态分布后,选择One-way ANOVA单因素方差分析;组间连续性变量两两比较采用非配对t检验,计数资料采用卡方检验;P<0.05为差异有统计学意义。
结 果
AVF对血液动力学的影响 本组患者均长期使用AVF作为血管通路,其中10例患者透析维持过程中因AVF功能不良,在新AVF成熟前曾有短时使用深静脉置管史,但所有患者使用目前AVF均至少1年,平均Qa为 (1.06±0.65)L/min。AVF均位于前臂,其中左前臂39例 (78%),右前臂11例 (22%)。采用最优拟合法,根据R2和F值选取最佳回归曲线,各回归方程的方差分析表明F值均达显着水平。Qa与SV、CO、CI关系最佳拟合为三次多项回归模型,Qa大约在0.6 L/min和2 L/min为3条曲线斜率分界点,当Qa>2 L/min和Qa<0.6 L/min时曲线斜率明显增加 (图1)。
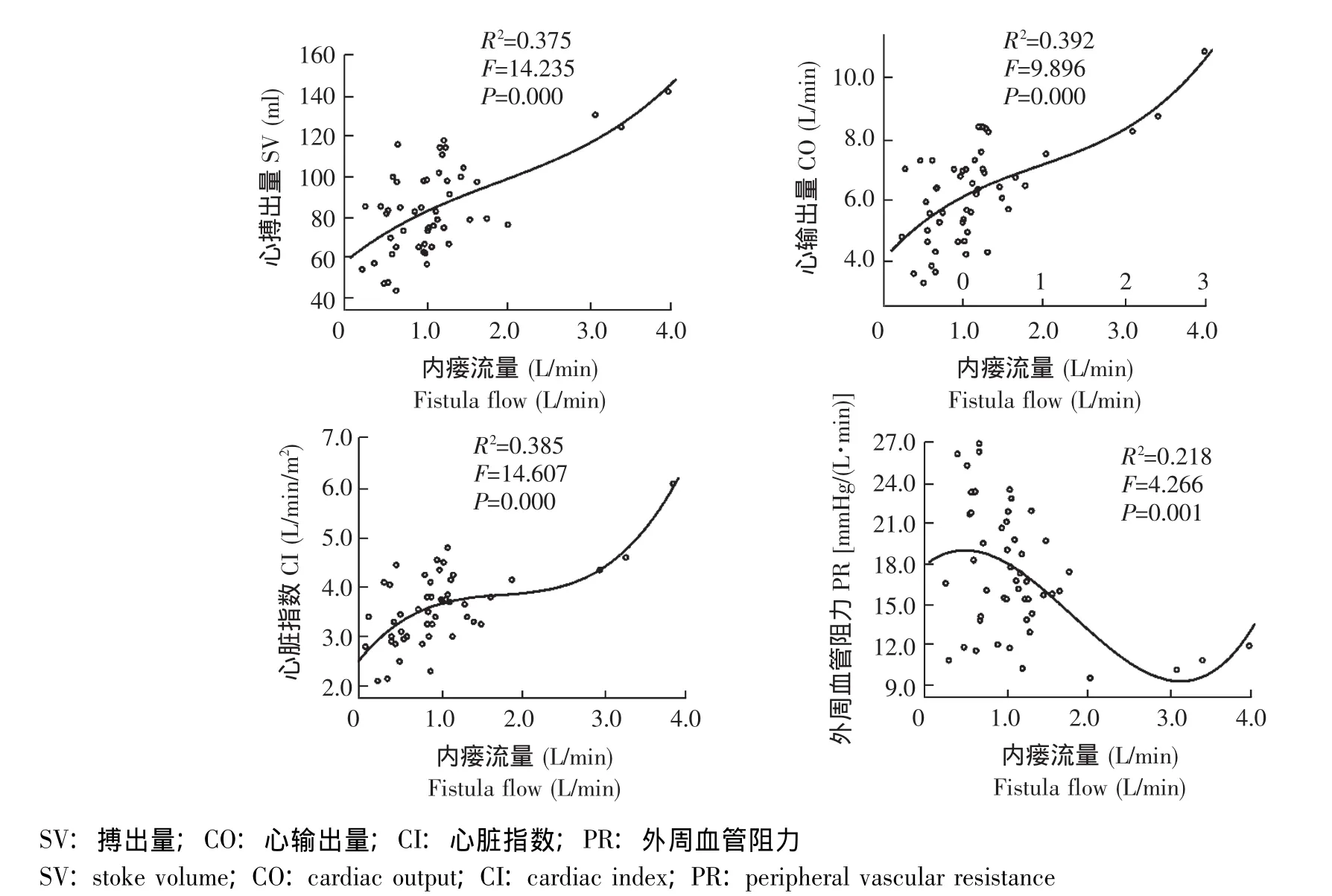
图1 动静脉内瘘流量与血液动力学参数间的三次回归曲线Fig 1 Cubic regression curve between arteriovenous fistula and heamodynamic parameters
Qa对血液动力学的影响 根据SV、CO和CI回归曲线的斜率变化,将患者分为Qa<0.6 L/min组、0.6~2.0 L/min组及>2.0 L/min组,3组患者在性别、年龄、透析时间、透析充分性及营养状况方面差异均无统计学意义 (P均>0.05)(表1)。Qa<0.6 L/min、0.6~2.0 L/min和>2.0 L/min组患者随着Qa的增加,SV(P=0.000)、CO(P=0.000)、CI(P=0.000)及CBV(P=0.019)明显增高,PR明显减低 (P=0.007)。Qa>2 L/min组与其余两组在内瘘流量、Qa/CO、搏出量、CO、CI、CBV和外周血管阻力方面差异均有统计学意义 (P<0.05或P<0.01)。Qa 0.6~2.0 L/min组的内瘘流量、Qa/CO、血压和搏出量明显高于Qa<0.6 L/min组 (P<0.05或P<0.01),两组间的CO、CI及PR差异均无统计学意义 (P均>0.05)(表2)。
长期AVF对NYHA心功能分级的影响 Qa<0.6 L/min,Qa 0.6~2.0 L/min和Qa>2 L/min组NYHA心功能分级Ⅰ、Ⅱ、Ⅲ、Ⅳ的人数分别为4、2、0、0,29、8、3、0和1、1、2、0;Qa>2.0 L/min组与Qa<0.6 L/min组 (χ2=3.889,P=0.143)及Qa>2.0 L/min组与 Qa 0.6~2.0 L/min组间 (χ2=7.028,P=0.03)差异均有统计学意义。
长期AVF对心脏结构和功能的影响 Qa<0.6 L/min,Qa 0.6~2.0 L/min和Qa>2 L/min组间主肺动脉、左房直径、室间隔及左室后壁厚度、LVESD、LVEDD、下腔静脉、PASP随着AVF Qa的升高而增加,LVEF、LVFS随着Qa的升高而降低,LVESD、LVEDD以及下腔静脉直径比较差异有统计学意义 (P<0.05)。Qa>2.0 L/min组 LVESD和LVEDD明显较另两组增大,LVEDD增加更为明显。下腔静脉直径亦明显较其余两组增宽,差异有统计学意义 (P<0.05)。Qa<0.6 L/min和Qa 0.6~2 L/min两组间虽有数值上的变化趋势,但各参数差异无统计学意义 (P>0.05)(表3)。
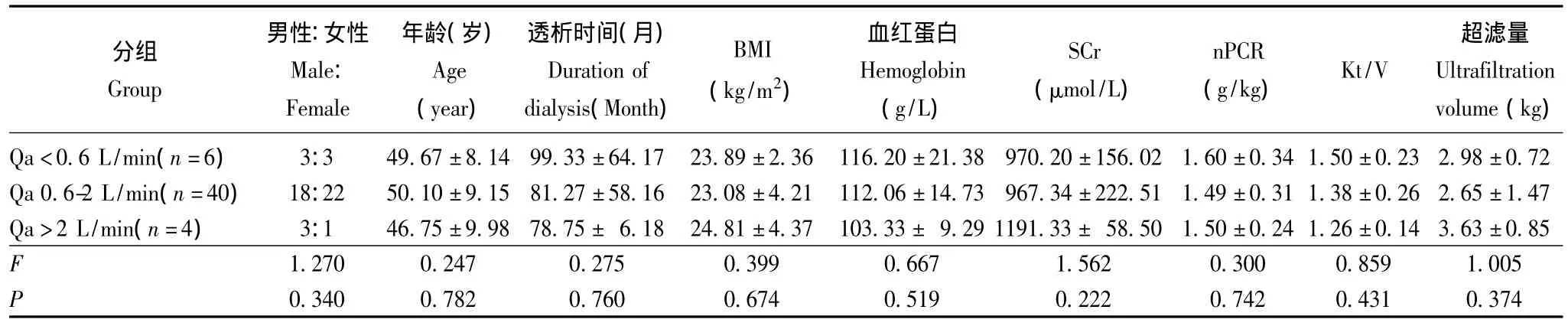
表1 不同Qa组患者的一般情况比较Table 1 Comparison of clinical features among groups with different AVF flow
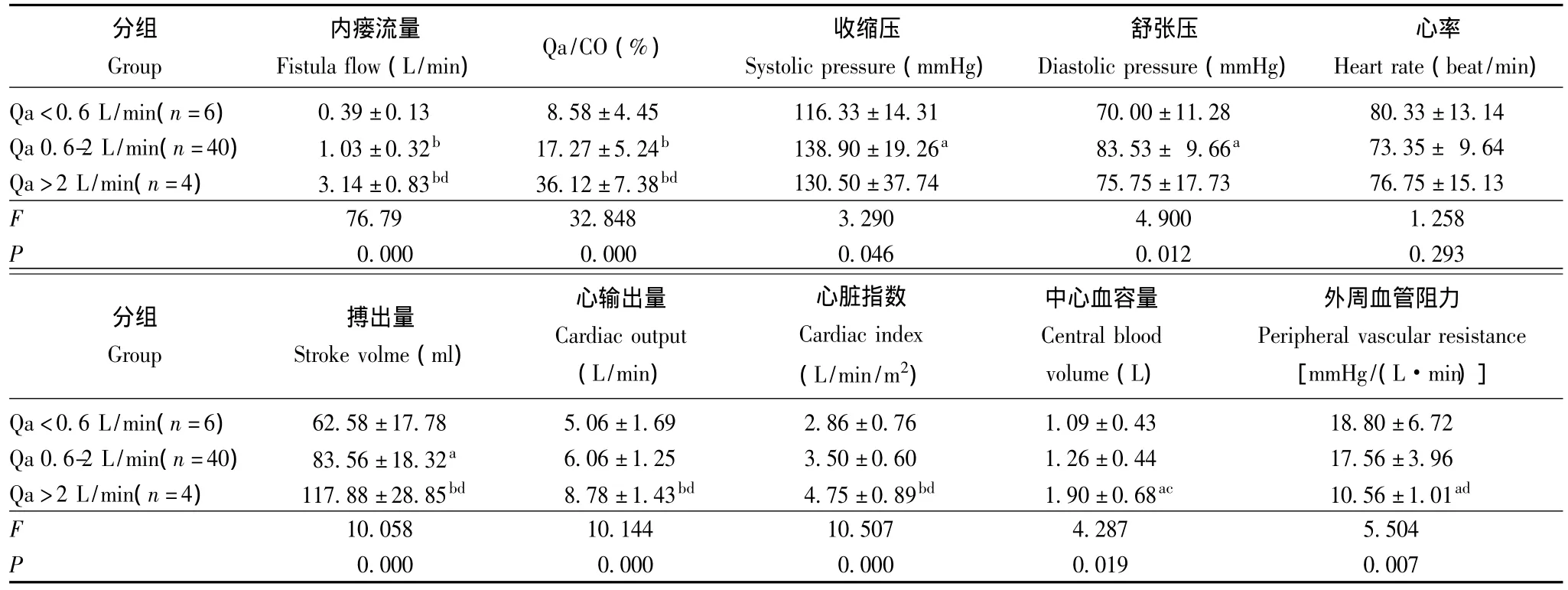
表2 不同Qa对心血管系统血液动力学的影响Table 2 Effects of different arteriovenous fistula flow on haemodynamic parameters
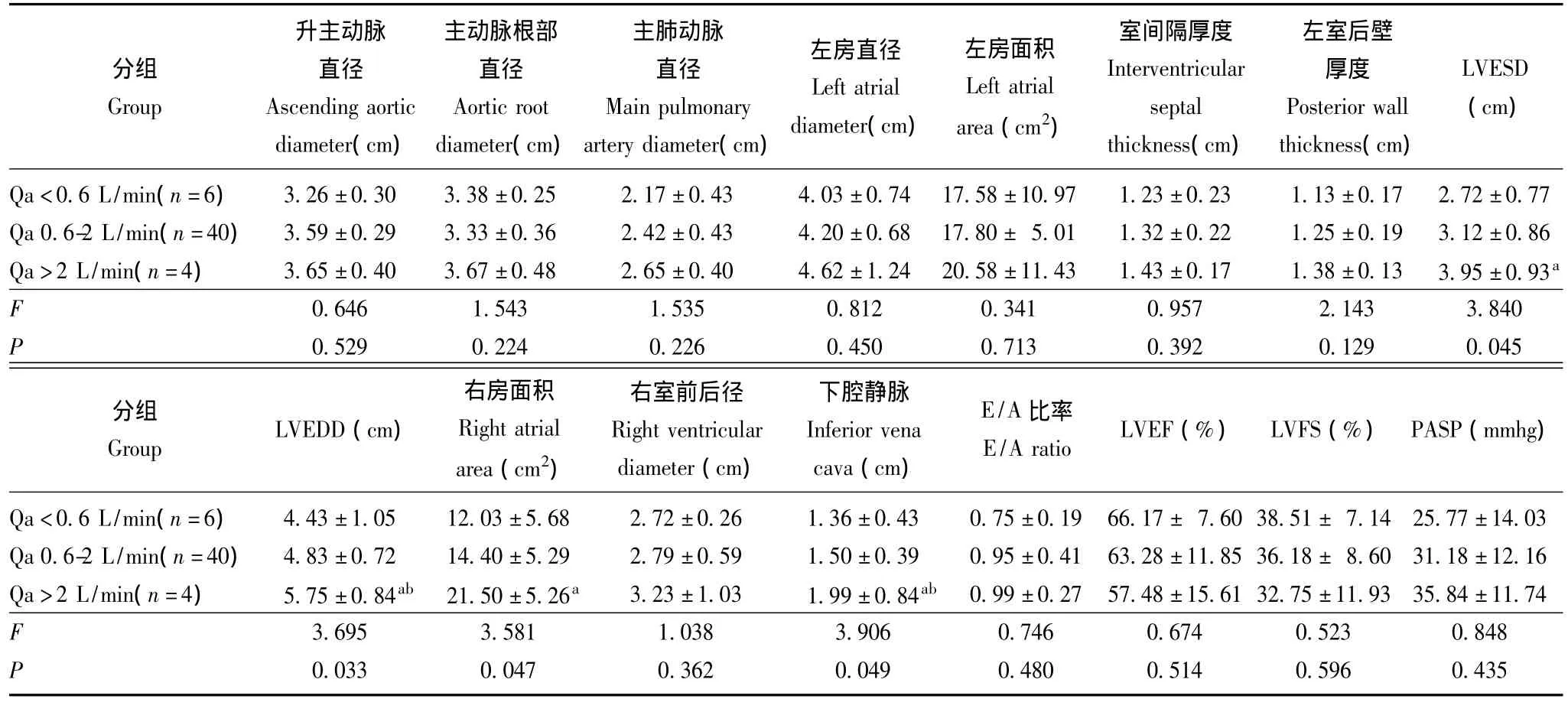
表3 动静脉内瘘对超声心动图检测的心脏结构和功能的影响Table 3 Effects of arteriovenous fistula on the cardiac structure and function tested by echocardiograph
讨 论
AVF因较低的感染率、血栓栓塞发生率以及较长的通路开放时间为目前公认的终末期肾病血液透析患者的首选血管通路。AVF建立后,部分血液经内瘘口直接从静脉回流至心脏,一定程度上增加了心脏的负担,是终末期肾病患者心血管病变的重要加重因素之一。
有关AVF对心脏结构和功能的影响因受研究条件的限制,多集中于建立内瘘后的3个月内。AVF建立短期内对CO和PR存在明显的影响,表现为CO的增加和PR的下降。在动物研究中,慢性肾脏病大鼠AVF成形术后,观察至84 d,SV和心率增加,CO增加244%[3]。使用超声心动图检测AVF对终末期肾病患者心功能的影响,内瘘建立后14 d与建立前比较,CO增加15%,LVEDD增加4%,LVFS增加8%[1]。Korsheed等[2]研究表明,在建立 AVF后,SV增加 (12±30)ml,CO增加 (1.1±1.5)L/min,而PR下降17%,血压及动脉僵硬度减低,心脏超声显示LVEF增加 (6±8)%,这些血液动力学改变仅观察至术后3个月。
长期存在的AVF对维持性血液透析患者心血管系统的作用至今仍不清楚,国内外研究甚少。笔者前期研究显示,老年及糖尿病为终末期肾病透析患者心功能下降的相关危险因素 (数据待发表),AVF建立前后心功能改变的研究亦显示,糖尿病患者在建立AVF后,LVEF下降15.5%,而非糖尿病患者仅下降1%[4]。为尽量减少年龄以及影响心脏病变的其他因素干扰,本研究选择了60岁以下的非糖尿病患者。本研究中所有患者均长期使用AVF作为血管通路,使用目前AVF至少1年以上,最长者使用200余月。结果显示,随着Qa的升高,SV、CO、CI均呈上升趋势,PR降低。AVF建立后机体通过降低系统性血管阻力,增加SV和CO以维持血压的稳定[8]。Ori等[9]的研究发现慢性肾脏病患者 AVF 创建2周时肾素活性下降,心房钠尿肽 (atrial natriuretic peptide,ANP)水平增加。肾素是强缩血管物质,而ANP的作用是舒张血管平滑肌,血管活性物质的改变可能参与AVF建立后的血液动力学变化。
最优拟合曲线显示,Qa与SV、CO、CI关系拟合最佳的为三次曲线回归模型,非简单的线性关系,当Qa>2 L/min和Qa<0.6 L/min时曲线斜率明显增加。但Qa<0.6 L/min与Qa 0.6~2.0 L/min组患者相比,CO、CI以及PR无明显差异。而Qa>2 L/min组,SV、CO、CI以及CBV均明显高于其余两组,PR却明显减低,差异有统计学意义。AVF和CO的这种复杂关系,亦在另一研究中得到证实[10],当Qa为0.95~2.0 L/min时,平均CO与Qa<0.95 L/min时相比,无明显差异,但当Qa>2.0 L/min时,易引起高输出量性心力衰竭。对左室负荷的研究亦显示,Qa在0.4~0.8 L/min范围内并不明显增加心脏负荷,但随着Qa的升高,AVF产生的左室负荷随之增加,当Qa>2.0 L/min时,左室负荷较一般Qa者增加 1.5 倍[11]。
AVF流量与患者性别、内瘘位置以及外科手术等因素有关,其中,与内瘘的位置关系较大,一般上臂Qa高于前臂Qa。有研究显示上臂Qa平均为前臂Qa的两倍,建立于上臂的AVF至少15%Qa高于2~2.5 L/min[12]。在北京协和医院透析中心,绝大多数AVF选择在前臂建立,本组50例患者全部使用前臂 AVF,因此高流量 AVF者例数不多。在 Qa>2 L/min的4例中,2例 (50%)NYHA心功能分级为Ⅲ级,1例 (25%)为Ⅱ级,而Qa 0.6~2.0 L/min组心功能以Ⅰ级为主,Ⅲ级者仅占7.5%,经卡方检验差异有统计学意义。而Qa<2.0 L/min的两组间相比,心功能差异无统计学意义。目前,在K-DOQI指南 (肾脏病预后质量指南)或文献中均无Qa过高的定义,但在病例报告中,高输出量心力衰竭几乎都发生于Qa 2 L/min以上、Qa/CO高于30%~35%的患者[13-14]。本研究中Qa>2 L/min组的1例高输出量心力衰竭患者经内瘘缩窄术后心力衰竭症状改善,进一步证实高AVF流量在透析患者心力衰竭发生中的作用。慢性肾脏病人群存在多种心脏病变危险因素,高通路流量对心力衰竭症状的影响易于与其他危险因子重叠。AVF建立所致的CO和血容量增加,可能引起心肌耗氧增加,导致心肌需氧和耗氧的失衡,发生心肌缺血加重心脏病变。Savage等[15]用脉搏波分析AVF建立后的心内膜下灌注,在慢性肾脏病患者建立AVF即刻心内膜灌注下降,且持续至术后6个月,AVF后心肌缺血可能是导致高输出量心力衰竭的原因之一。
对于长期AVF存在,心脏如何发生适应性的结构改变目前并不清楚。有研究比较了AVF建立前后的心脏超声参数变化,在建立AVF后,LVESD、LVEDD、室间隔厚度、左室后壁厚度、左房直径、左室质量等均明显增加[16],但LVEF值的改变报导不一[2,16]。文献中尚无长期 AVF不同流量对心脏影响的相关报导,本研究显示左房直径、室间隔及左室后壁厚度、LVESD、LVEDD、下腔静脉、PASP等随着Qa的升高而增加,LVEF、LVFS随着Qa的升高而降低。Qa>2.0 L/min组LVESD和LVEDD明显较其余两组扩大,差异有统计学意义。Qa<0.6 L/min和Qa 0.6~2 L/min两组间虽有数值上的变化趋势,但经分析各参数差异无统计学意义。Qa>2.0 L/min组下腔静脉增宽与血液动力学参数的CBV增加一致,一定程度地反映了高流量AVF的心脏容量负荷较低流量AVF增加的状态。不同AVF流量组心脏超声结构和功能的改变提示透析患者心脏对容量负荷增加具有较强的适应能力,Qa>2.0 L/min将超出心脏的代偿能力,表现为心腔的明显扩大和EF的下降。
综上,长期AVF对血液透析患者血液动力学以及心脏结构和功能的影响与Qa相关,但非简单线性关系。AVF在一定流量范围内,心脏发生以左室肥大为主的适应性改变,随着Qa的增高,尤其当Qa>2.0 L/min时,心肌收缩可能发生失代偿,表现为心腔明显扩大,易于发生高输出量心力衰竭。
[1]Iwashima Y,Horio T,Takami Y,et al.Effects of the creation of arteriovenous fistula for hemodialysis on cardiac function and natriuretic peptide levels in CRF[J].Am J Kidney Dis,2002,40(5):974-982.
[2]Korsheed S,Eldehni MT,John SG,et al.Effects of arteriovenous fistula formation on arterial stiffness and cardiovascular performance and function [J].Nephrol Dial Transplant,2011,26(10):3296-3302.
[3]Langer S,Paulus N,Koeppel TA,et al.Cardiovascular remodeling during arteriovenous fistula maturation in a rodent uremia model[J].J Vasc Access,2011,12(3):215-223.
[4]Beigi AA,Sadeghi AM,Khosravi AR,et al.Effects of the arteriovenous fistula on pulmonary artery pressure and cardiac output in patients with chronic renal failure[J].J Vasc Access,2009,10(3):160-166.
[5]罗琳,石涛,刘倍,等.在线监测血液透析过程中血流速对心功能的影响 [J].中国血液净化,2011,10(12):656-659.
[6]Malyszko J,Levin-Iaina N,Malyszko JS,et al.Copeptin and its relation to arteriovenous fistula type and NYHA class in hemodialysis patients[J].Ren Fail,2011,33(10):929-934.
[7]Nagueh SF,Appleton CP,Gillebert TC,et al.Recommendations for the evaluation of left ventricular diastolic function by echocardiography [J].J Am Soc Echocardiogr,2009,22(2):107-133.
[8]Meeus F,Kourilsky O,Guerin AP,et al.Pathophysiology of cardiovascular disease in hemodialysis patients[J].Kidney Int Suppl,2000,76:S140-147.
[9]Ori Y,Korzets A,Katz M,et al.Haemodialysis arteriovenous access—a prospective haemodynamic evaluation [J].Nephrol Dial Transplant,1996,11(1):94-97.
[10]Basile C,Lomonte C,Vernaglione L,et al.The relationship between the flow of arteriovenous fistula and cardiac output in haemodialysis patients[J].Nephrol Dial Transplant,2008,23(1):282-287.
[11]Válek M,Lopot F,Polakovic V.Arteriovenous fistula,blood flow,cardiac output,and left ventricle load in hemodialysis patients[J].ASAIO J,2010,56(3):200-203.
[12]Dixon BS,Novak L,Fangman J.Hemodialysis vascular access survival:upper arm native arteriovenous fistula [J].Am J Kidney Dis,2002,39(1):92-101.
[13]Navuluri R,Regalado S.The KDOQI 2006 vascular access update and fistula first program synopsis[J].Semin Intervent Radiol,2009,26(2):122-124.
[14]Kurita N,Mise N,Tanaka S,et al.Arteriovenous access closure in hemodialysis patients with refractory heart failure:a single center experience[J].Ther Apher Dial,2011,15(2):195-202.
[15]Savage MT,Ferro CJ,Sassano A,et al.The impact of arteriovenous fistula formation on central hemodynamic pressures in chronic renal failure patients:a prospective study [J].Am J Kidney Dis,2002,40(4):753-759.
[16]Rehman SU,Pupim LB,Shyr Y,et al.Intradialytic serial vascular access flow measurements[J].Am J Kidney Dis,1999,34(3):471-477.



