郑 静,王 旭,夏 阳,江海涛
1绍兴市中心医院医共体总院放射科 绍兴市肿瘤功能分子成像与介入诊疗重点实验室,浙江绍兴 3120302中国科学院大学附属肿瘤医院 浙江省肿瘤医院放射科,杭州 3100223绍兴市妇幼保健院放射科,浙江绍兴 312000
胃肠间质瘤(gastrointestinal stromal tumors,GISTs)是消化道常见的间叶源性肿瘤,可以发生在胃肠道任何部位,极少数原发于肠系膜、前列腺、肝脏等部位[1- 2]。高危GISTs具有复发和转移的特点,更需临床关注。肝脏是高危GISTs最常见的转移部位[3- 4]。一项基于美国国立癌症研究所的监测、流行病学和最终结果(surveillance,epidemiology and end results,SEER)数据库的回顾性研究发现肝转移为影响GISTs患者预后的独立危险因素,发生肝转移的高危GISTs恶性程度更高,更容易复发,患者的无复发生存期明显缩短[5]。但是高危GISTs的肝脏转移灶术前易漏诊、误诊率极高。本研究拟通过临床病理联合CT平扫纹理特征模型预测高危GISTs肝转移的风险,为临床医师术前评估和制定治疗方案提供依据。
对象和方法
对象回顾性收集2015年1月至2020年12月经病理证实的高危GISTs 204例,包括中国科学院大学附属肿瘤医院153例,绍兴市中心医院医共体总院51例。其中男性108例、女性96例,平均年龄(58.55±12.12)岁(30~90岁)。纳入标准:(1)GISTs首发伴肝转移患者或美国国家卫生研究院(National Institutes of Health,NIH)2008年改良版危险度分级为高危的无肝转移GISTs患者[6];(2)具有完整的临床资料,包括一般情况、实验室检查、手术病理及免疫组织化学结果等;(3)术前两周内行腹部CT增强扫描检查。排除标准:(1)CT图像伪影重或病变显示欠清晰;(2)CT检查前或术前行抗肿瘤治疗。本研究通过绍兴市中心医院医共体总院伦理委员会批准(伦理审查编号:2021003)。
仪器和方法所有患者行腹部CT增强扫描,于检查当日行胃肠道准备,并饮水1000 ml。中国科学院大学附属肿瘤医院采用GE Brightspeed Elite 16排CT扫描仪,管电压120 kV,管电流250 mAs,层厚和层间距均为5 mm,扫描视野36 cm×36 cm。绍兴市中心医院医共体总院采用GE Optima CT540 16排CT扫描仪,管电压120 kV,管电流250 mAs,层厚和层间距均为5 mm,扫描视野36 cm×36 cm。
图像标注将所有CT图像导入ITK-SNAP 3.6.0软件(宾州图像计算与科学实验室,美国),由2名分别具有8年和12年腹部影像诊断经验的放射科医师独立对间质瘤病灶勾画感兴趣体积(volume of interest,VOI)。勾画要求:沿肿瘤边缘轮廓逐层勾画;VOI包含肿瘤溃疡、坏死、出血区域,避开胃肠道内容物。
特征提取和筛选将204例患者的原始DICOM文件及勾画的VOI数据导入美国GE公司A-K软件提取纹理特征。先进行中位数缺失值插补、Z-score标准化等数据清洗,再通过Kruskal-Wallis秩和检验、相关性分析等方法剔除冗余特征,最后应用最小绝对收缩与选择算子(least absolute shrinkage and selection operator,LASSO)回归和十折交叉验证,筛选出最稳健的纹理特征。
模型构建和效能评估在训练集通过单因素Logistic回归筛选出差异有统计学意义(P<0.05)的临床病理特征,然后通过多因素Logistic回归构建临床病理特征模型、CT纹理特征模型及临床病理联合CT纹理特征模型,并通过测试集进行验证,同时构建列线图。用校正曲线评价模型的校准度。受试者工作特征(receiver operating characteristic,ROC)曲线评判预测模型的诊断效能,并通过DeLong检验比较3种模型之间的差异是否具有统计学意义。
统计学处理采用R语言软件进行统计分析。连续型变量采用Shapiro Wilk正态性检验,符合正态分布的计量资料以均数±标准差表示,组间比较采用独立样本t检验。计数资料以构成比表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
结 果
一般资料高危GISTs肝转移组与无转移组患者年龄、性别、腹痛差异无统计学意义(P均>0.05);而体重指数(body mass index,BMI)、肿瘤大小、Ki- 67、CA125、腹部包块、消化道出血及肿瘤发生部位差异具有统计学意义(P均<0.05)(表1)。
CT纹理特征筛选基于CT图像共提取107个纹理特征,使用LASSO算法进行特征降维后,CT平扫筛选出13个纹理特征,包括2个一阶特征、1个灰度共生矩阵、1个灰度相依矩阵、3个灰度游程矩阵、2个灰度区域矩阵、2个领域灰度差分矩阵及2个形态特征。CT增强筛选出7个纹理特征,包括2个灰度共生矩阵、2个灰度游程矩阵和3个形态特征(表2)。
模型构建与评估采用Logistic回归方法,构建基于BMI、肿瘤大小、Ki- 67、发生部位、腹部包块、消化道出血和血清CA125水平的7个特征的临床病理模型,AUC在训练集和测试集中分别为0.870、0.855;基于筛选出的13个纹理特征建立的CT平扫纹理特征模型的AUC在训练集和测试集中分别为0.918、0.836;基于筛选出的7个纹理特征建立的CT增强纹理特征模型的AUC在训练集和测试集中分别为0.920、0.846。经Delong检验,CT平扫和CT增强纹理特征模型的AUC差异无统计学意义(P=0.762)。临床病理联合CT平扫纹理特征模型的AUC在训练集和测试集中分别为0.930、0.889(图1)。由CT平扫影像组学标签、BMI、肿瘤大小、Ki- 67、发生部位、腹部包块、消化道出血、血清CA125水平8个参数制作列线图(图2)。联合模型校准曲线在训练集和测试集中显示出良好的校准性能(图3)。
讨 论
GTSTs的危险度与肿瘤直径、核分裂象、肿瘤发生部位相关。肿瘤直径和核分裂象与肿瘤复发转移存在正相关性,肿瘤增大1 cm和/或核分裂象增多1/50 HPF,转移风险呈对数增长[7]。本研究肝转移组Ki- 67表达水平明显高于无转移组,提示Ki- 67增殖指数作为一种细胞核增殖抗原,可用于评估GTSTs的恶性潜能[8]。同时本研究结果显示转移组高危GTSTs发生于胃外(小肠、结直肠及系膜)的比例明显高于无转移组,且容易出现腹部肿块、BMI降低等。有文献报道发生于胃外的间质瘤一般体积较大,可能与其外生性或混合性生长模式有关,且危险度分级更高[8]。内生性的间质瘤一般生长在黏膜下,容易出现消化道出血的症状。GTSTs外周血检查癌胚抗原和甲胎蛋白多无异常改变[9- 10],但本研究结果显示高危GTSTs肝转移组CA125呈现轻、中度升高,且比例明显高于无转移组,可能与肝脏的转移灶有关。
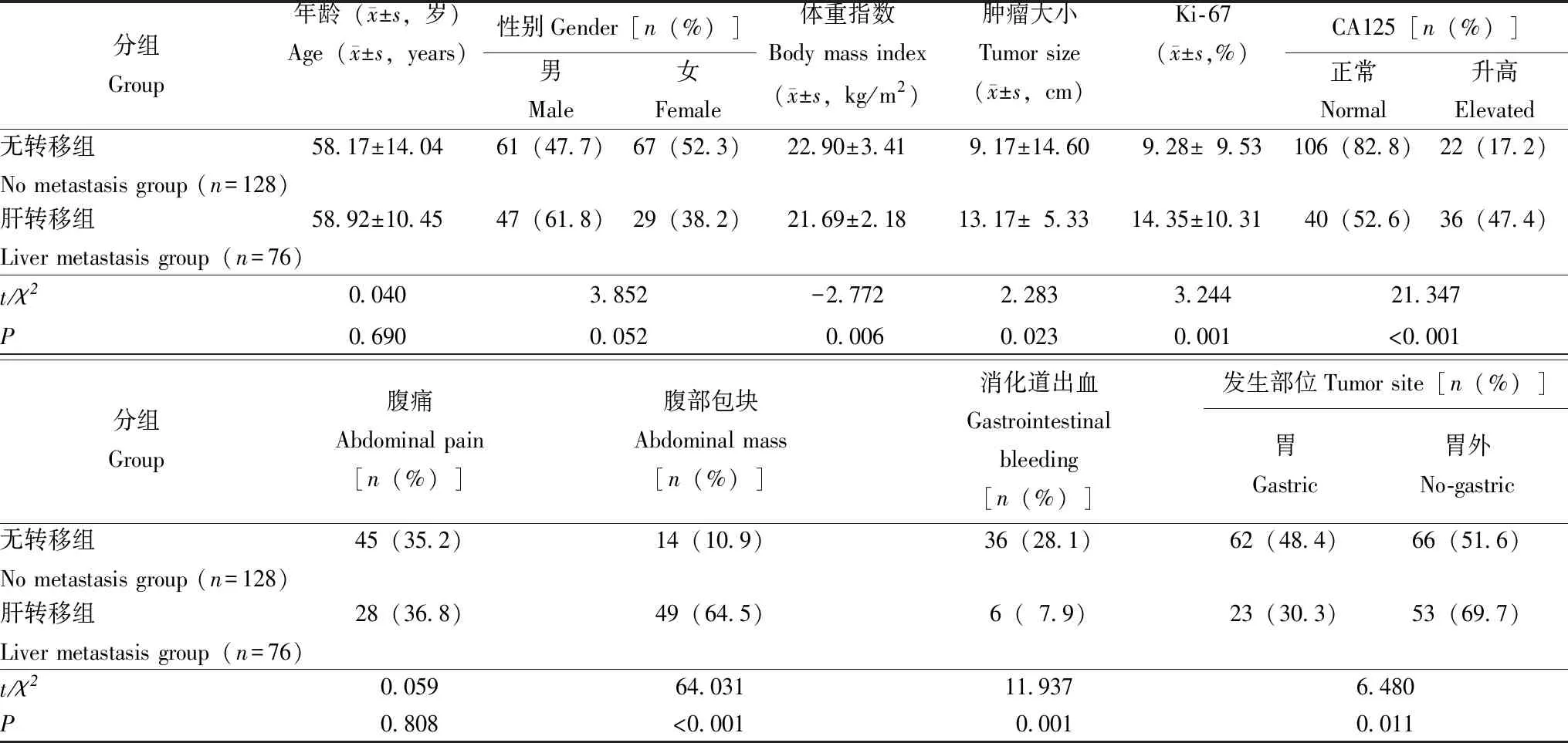
表1 高危胃肠间质瘤肝转移组和无转移组的临床病理资料比较

表2 高危胃肠间质瘤肝转移组和无转移组的CT纹理特征比较

图1 训练集(A)和测试集(B)的临床病理模型、CT平扫纹理特征模型、临床病理联合CT纹理特征模型预测高危胃肠间质瘤肝转移的受试者工作特征曲线图

图2 预测高危胃肠间质瘤肝转移风险的列线图
CT平扫和CT增强纹理特征模型的AUC在训练集和测试集中分别为0.918、0.836和0.920和0.846。经Delong检验,两组纹理特征模型效能相仿,与Zhang等[12]的研究结果一致。同时CT增强筛选出的7个特征中,有3个与CT平扫特征重叠,2个为形态特征(最小轴长度和最大2D直径)。考虑CT平扫较CT增强图像更易获得[13],因此本研究采用CT平扫纹理特征建模进行后续研究。
目前CT纹理特征在GTSTs的研究中多集中在危险分层预测方面[14- 15],在GTSTs复发和转移方面的文献报道较少。本研究通过分析CT平扫纹理特征预测高危GTSTs肝转移的风险,结果发现,肝转移组高危GTSTs球度更低,说明其形态比无转移组更不规则。同时,肝转移组GTSTs更容易发生变性、坏死,纹理特征对比度、强度和灰度最大值、大面积低灰度强调均低于无转移组,提示与肿瘤不均质坏死相关。高危GTSTs肝转移组平面度不均匀,可能与肿瘤发生坏死、钙化、溃疡有关,导致肿瘤纹理粗糙。归一化逆差矩、归一化灰度非均匀性提示肝转移组的高危GTSTs强度相似性较小,肿瘤本身密度不均,异质性较高。长行程高灰度强调代表图像中较亮区域的较长游程长度的分布,第90百分位代表感兴趣区中体素大小的第90百分点,这2个纹理特征在肝转移组中数值较大,与肿瘤本身体积偏大有关。肝转移组大面积强调较大表示更粗糙的纹理及粗糙纹理的结构区域越大。

图3 训练集(A)和测试集(B)临床病理联合CT纹理特征模型预测高危胃肠间质瘤肝转移的概率与实际发生率之间的关系校准曲线
本研究存在一定局限性。首先,部分CT平扫图像VOI勾画是参照增强图像,如何提高单独CT平扫图像勾画的准确性及自动标注是人工智能正在研究的方向。其次,高危GTSTs肝转移组的病例数相对较少,未来需更补充更多样本量,来验证模型的准确性。
综上,CT平扫纹理特征可以无创、有效预测高危GTSTs肝转移的风险,当与有意义的临床病理变量联合诊断时,其预测效能更优。



