李晨晨 周霞 朱文昊 万珂 尹文文 唐雅婷 李明旭 朱小群 孙中武
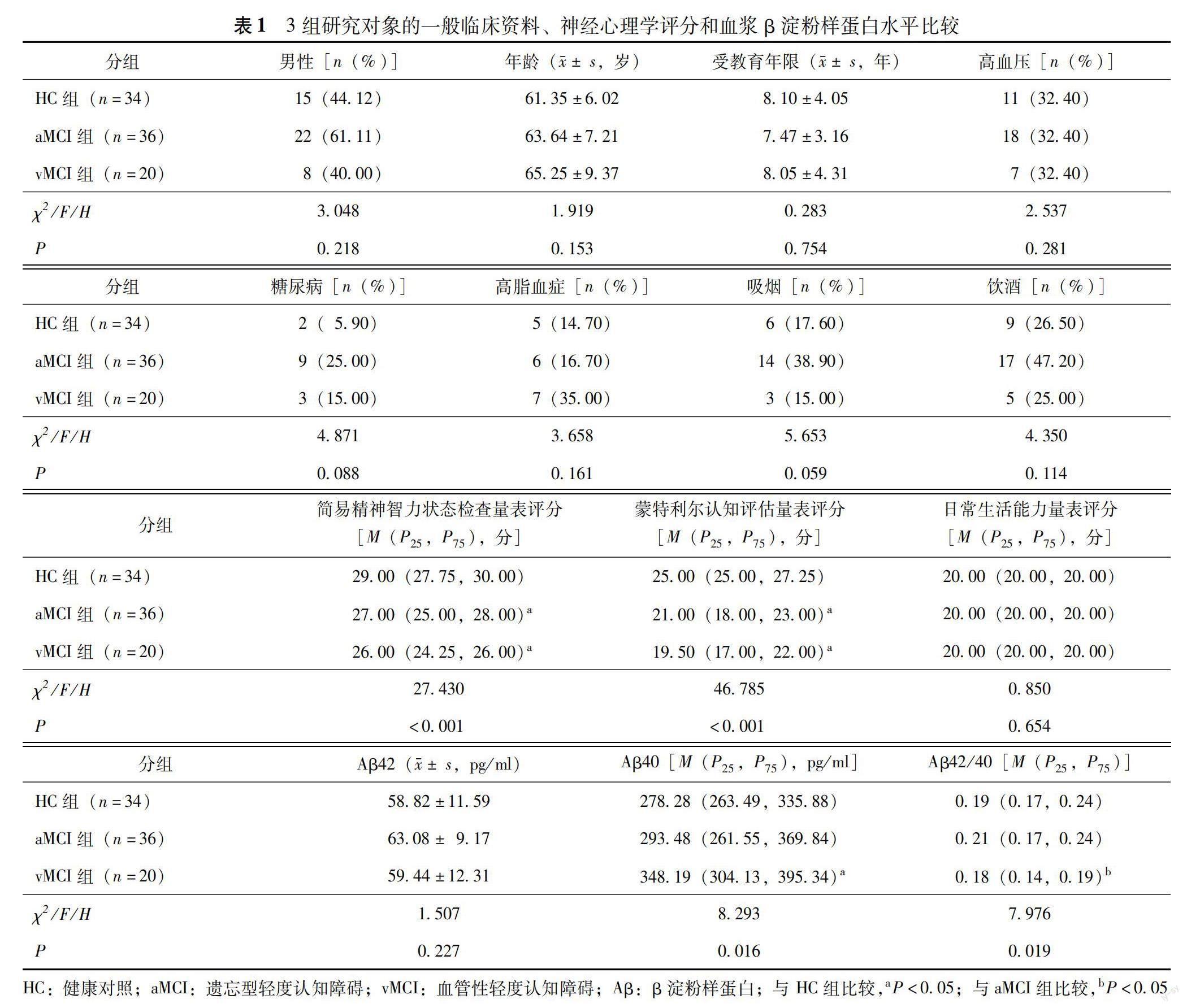
摘要:目的 探讨遗忘型轻度认知障碍(aMCI)与血管性轻度认知障碍(vMCI)患者血浆β淀粉样蛋白(Aβ)水平变化及其与脑白质微观结构的关系。方法 纳入安徽医科大学第一附属医院门诊及住院收治的aMCI患者36例,vMCI患者20例及性别、年龄匹配的健康对照(HC)34例。对所有研究对象进行神经心理学量表评估,包括简易精神智力状态检查量表、蒙特利尔认知评估量表和日常生活能力量表;采集所有研究对象的血液标本并检测血浆Aβ42、Aβ40;所有研究对象均进行磁共振扫描以获取弥散张量成像(DTI)数据;采用基于感兴趣区的DTI分析方法获取个体48个白质区域的DTI参数(基于约翰霍普金斯大学制订的ICBM-DTI-81脑白质图谱),包括分数各向异性(FA)和平均扩散系数(MD)。比较3组的认知功能,血浆Aβ42、Aβ40、Aβ42/40水平和DTI参数,并对aMCI和vMCI的血浆Aβ42/40水平和DTI参数进行相关分析。结果 aMCI和vMCI组的简易精神智力状态检查量表、蒙特利尔认知评估量表评分均显着低于HC组(P均<0.001);日常生活能力量表评分3组差异无统计学意义(P=0.654)。3组血浆Aβ42水平差异无统计学意义(P=0.227);vMCI组血浆Aβ40水平较HC组显着升高(P=0.014),aMCI与HC组比较差异无统计学意义(P=1.000);aMCI和vMCI组血浆Aβ42/40水平与HC组比较差异均无统计学意义(P=1.000,P=0.105),而vMCI组血浆Aβ42/40水平较aMCI组显着下降(P=0.016)。vMCI组左侧内囊前肢的FA较HC及aMCI组显着降低(P均=0.001);vMCI组左侧上放射冠、左侧外囊、左侧扣带束扣带回部、左侧上额枕束的MD较HC组(P=0.024,P=0.001,P=0.003,P<0.001)及aMCI组(P=0.015,P=0.004,P=0.019,P=0.001)显着升高;aMCI、vMCI组右侧内囊后肢(P=0.005,P=0.001)、左侧扣带束海马部(P=0.017,P=0.031)的MD较HC组显着升高。aMCI组血浆Aβ42/40水平与左侧内囊后肢FA呈正相关(r=0.403,P=0.015),与右侧穹隆的MD呈负相关(r=-0.395,P=0.017);vMCI组血浆Aβ42/40水平与右侧小脑上脚、右侧内囊前肢的FA呈正相关(r=0.575,P=0.008;r=0.639,P=0.002);与右侧小脑上脚、右侧内囊前肢的MD呈负相关(r=-0.558,P=0.011;r=-0.626,P=0.003)。结论 aMCI和vMCI患者血浆Aβ水平变化不同,不同痴呆类型早期白质微观结构完整性损害的区域存在差异,aMCI和vMCI患者血浆Aβ水平均与脑白质结构完整性有关,且二者存在区域特异性。
关键词:轻度认知障碍;弥散张量成像;白质微观结构;血浆β淀粉样蛋白
中图分类号: R741文献标志码: A文章编号:1000-503X(2023)04-0571-10
DOI:10.3881/j.issn.1000-503X.15418
Changes in Plasma Amyloid-β Level and Their Relationship With White
Matter Microstructure in Patients With Mild Cognitive Impairment
LI Chenchen,ZHOU Xia,ZHU Wenhao,WAN Ke,YIN Wenwen,
TANG Yating,LI Mingxu,ZHU Xiaoqun,SUN Zhongwu
Department of Neurology,The First Affiliated Hospital of Anhui Medical University,Hefei 230022,China
Corresponding author:SUN Zhongwu Tel:0551-62922328,E-mail:sunzhwu@126.com
ABSTRACT:Objective To investigate the changes in plasma amyloid-β (Aβ) level and their relationship with white matter microstructure in the patients with amnesic mild cognitive impairment(aMCI) and vascular mild cognitive impairment (vMCI).Methods A total of 36 aMCI patients,20 vMCI patients,and 34 sex and age matched healthy controls (HC) in the outpatient and inpatient departments of the First Affiliated Hospital of Anhui Medical University were enrolled in this study.Neuropsychological scales,including the Mini-Mental State Examination,the Montreal Cognitive Assessment,and the Activity of Daily Living Scale,were employed to assess the participants.Plasma samples of all the participants were collected for the measurement of Aβ42 and Aβ40 levels.All the participants underwent magnetic resonance scanning to obtain diffusion tensor imaging (DTI) data.The DTI indexes of 48 white matter regions of each individual were measured (based on the ICBM-DTI-81 white-matter labels atlas developed by Johns Hopkins University),including fractional anisotropy (FA) and mean diffusivity (MD).The cognitive function,plasma Aβ42,Aβ40,and Aβ42/40 levels,and DTI index were compared among the three groups.The correlations between the plasma Aβ42/40 levels and DTI index of aMCI and vMCI patients were analyzed.Results The Mini-Mental State Examination and the Montreal Cognitive Assessment scores of aMCI and vMCI groups were lower than those of the HC group (all P<0.001).There was no significant difference in the Activity of Daily Living Scale score among the three groups (P=0.654).The plasma Aβ42 level showed no significant difference among the three groups (P=0.227).The plasma Aβ40 level in the vMCI group was higher than that in the HC group (P=0.014),while it showed no significant difference between aMCI and HC groups (P=1.000).The plasma Aβ42/40 levels in aMCI and vMCI groups showed no significant differences from that in the HC group (P=1.000,P=0.105),while the plasma Aβ42/40 level was lower in the vMCI group than in the aMCI group (P=0.016).The FA value of the left anterior limb of internal capsule in the vMCI group was lower than those in HC and aMCI groups (all P=0.001).The MD values of the left superior corona radiata,left external capsule,left cingulum (cingulate gyrus),and left superior fronto-occipital fasciculus in the vMCI group were higher than those in HC (P=0.024,P=0.001,P=0.003,P<0.001) and aMCI (P=0.015,P=0.004,P=0.019,P=0.001) groups,while the MD values of the right posterior limb of internal capsule (P=0.005,P=0.001) and left cingulum (hippocampus) (P=0.017,P=0.031) in the aMCI and vMCI groups were higher than those in the HC group.In the aMCI group,plasma Aβ42/40 level was positively correlated with FA of left posterior limb of internal capsule (r=0.403,P=0.015) and negatively correlated with MD of the right fonix (r=-0.395,P=0.017).In the vMCI group,plasma Aβ42/40 level was positively correlated with FA of the right superior cerebellar peduncle and the right anterior limb of internal capsule (r=0.575,P=0.008;r=0.639,P=0.002),while it was negatively correlated with MD of the right superior cerebellar peduncle and the right anterior limb of internal capsule (r=-0.558,P=0.011;r=-0.626,P=0.003).Conclusions Plasma Aβ levels vary differently in the patients with aMCI and vMCI.The white matter regions of impaired microstructural integrity differ in the patients with different dementia types in the early stage.The plasma Aβ levels in the patients with aMCI and vMCI are associated with the structural integrity of white matter,and there is regional specificity between them.
Key words:mild cognitive impairment;diffusion tensor imaging;white matter microstructure;plasma amyloid-β
Acta Acad Med Sin,2023,45(4):571-580
轻度认知障碍(mild cognitive impairment,MCI)是介于正常老年人和痴呆之间的过渡阶段,最主要的亚型为遗忘型MCI(amnestic MCI,aMCI)和血管性MCI(vascular MCI,vMCI),被认为是阿尔茨海默病(Alzheimers disease,AD)和血管性痴呆(vascular dementia,VaD)的前驱阶段[1-2]。AD最主要的病理特征是细胞外β淀粉样蛋白(amyloid-β,Aβ)聚集[3]。研究显示脑白质损伤在AD的发病机制中至关重要,Aβ病理学改变与脑白质宏观和微观结构损伤之间存在直接联系[4]。vMCI多由脑小血管病(cerebral small vessel disease,CSVD)导致的MCI,研究显示CSVD中脑白质高信号(white matter hyperintensity,WMH)进展者血浆Aβ水平升高更为明显[5],提示Aβ病理可能有助于CSVD的发生和进展。以往对Aβ的研究主要基于脑脊液和Aβ-PET,具有侵入性且价格昂贵,临床使用有限,因此,需要更经济和便捷的生物标志物辅助诊断。扩散张量成像(diffusion tensor imaging,DTI)是一种可以测量活体内白质完整性的磁共振方法。有研究显示在AD早期阶段,Aβ负荷增加时存在DTI参数的变化[6]。然而,目前关于MCI人群中血浆Aβ水平与脑白质完整性之间相关性的研究较少,且结果缺乏一致性,需要进一步探索。本研究主要探讨aMCI与vMCI患者血浆Aβ水平变化及其与脑白质微观结构的关系。
对象和方法
对象 选取2020年8月至2022年4月安徽医科大学第一附属医院门诊及住院收治的aMCI患者36例、vMCI患者20例及健康对照(healthy control,HC)34例。HC是公开招募的患者家属及社会人员,其年龄、性别、受教育程度等与患者组相匹配。aMCI纳入标准(同时满足):(1)满足2003版Petersen诊断标准[7];(2)简易精神智力状态检查量表(Mini-Mental State Examination,MMSE)评分:文盲组>17分、小学组>20分、中学及以上组>24分;(3)蒙特利尔认知评估量表(Montreal Cognitive Assessment,MoCA)评分:文盲组≤13分、小学组≤19分、中学及以上组≤24分。vMCI纳入标准:(1)符合《中国血管性轻度认知损害诊断指南》标准[8];(2)认知评分与aMCI组一致;(3)常规头颅磁共振影像学表现为两个或多个腔隙性脑梗死或在T2液体衰减反转恢复序列(T2 fluid attenuated inversion recovery,T2 FLAIR)上可见根据修改版Fazekas量表[9]标准判定的中至重度WMH。排除标准:(1)严重脑血管疾病;(2)其他可能引起脑功能衰退的疾病或因素(如躯体疾病、免疫异常、甲状腺功能异常、抑郁症、脑外伤、精神病史、药物依赖、酒精中毒等);(3)左利手;(4)不能配合磁共振扫描、血液采集及认知测试。HC入组标准:(1)无认知损伤的证据;(2)头颅影像学无萎缩,无或仅存在1个腔隙性脑梗死,无WMH。本研究所有被试者均签署知情同意且经安徽医科大学第一附属医院伦理委员会批准(伦理审查编号:PJ2022-14-44)。
临床资料采集及神经心理学量表评估 采集所有被试者的详细资料,包括年龄、性别、受教育年限、身高、体重以及高血压、糖尿病、高脂血症、吸烟、饮酒史等一般临床资料。由2名经过专业培训的神经内科医生对被试者进行神经心理学量表评估,包括MMSE、MoCA、日常生活能力量表(Activity of Daily Living Scale,ADL),评估所有被试者的总体认知功能和日常生活能力。
血浆Aβ42、Aβ40检测 所有被试者在MRI扫描1周内进行空腹血样采集,收集在以乙二胺四乙酸二钠或柠檬酸钠作为抗凝剂的紫色试管中。使用湖南可成仪器设备有限公司的L2-4K台式低速离心机以3 000 r/min(r=12.5 cm)离心20 min。仔细收集上层血浆至EP管内并保存在-80 ℃冰箱内,避免反复冻融,集中检测。使用中国武汉华大生物技术有限公司的Aβ42和Aβ40酶联免疫分析试剂盒测定血浆Aβ42和Aβ40浓度(本试剂盒应用双抗体夹心法测定标本中人Aβ42或Aβ40水平)。
载脂蛋白E基因分型 将被试的混合血样提取500 μl到EP管中,在-80 ℃下保存,用于载脂蛋白E(apolipoprotein E,APOE)基因分型。由北京六合华大基因科技有限公司进行基因检测。具体方法如下:用天根生化科技公司的血液DNA迷你试剂盒(DP348)从血液样本中提取基因组DNA。采用五引物扩增难治性突变系统方法进行rs429358和rs7412(APOE)基因分型。聚合酶链式反应后,用TECAN M1000无限阅读器读取平板,并使用在线软件SNP decder1进行DNA序列分析。
MRI扫描与处理 图像采集:采用美国GE公司Discovery MR 750w 3.0T扫描仪和头部24通道线圈进行MRI扫描获取矢状位三维高分辨脑容积序列T1加权成像、T2 FLAIR和DTI数据。具体参数如下:(1)三维高分辨脑容积序列T1加权成像:重复时间8.5 ms,回波时间3.2 ms,反演时间450 ms,翻转角度12°,视场256 mm×256 mm,矩阵256×256,层厚1 mm,层数188,采集时间296 s;(2)T2 FLAIR:重复时间9 000 ms,回波时间119.84 ms,翻转角度160°,视场225 mm×225 mm,矩阵512×512,层厚7 mm,层数19,采集时间117 s;(3)DTI:数据采用自旋回波单次回波平面成像序列获取,重复时间10 000 ms,回波时间74 ms,翻转角度90°,视场256 mm×256 mm,矩阵128×128,层厚3 mm,50轴向片,64个扩散梯度方向(b=1 000 s/mm2)加上5个b=0参考图像,采集时间700 s。
DTI数据处理 采用基于感兴趣区(regions of interest,ROI)的DTI分析方法获取个体在约翰霍普金斯大学的ICBM-DTI-81白质图谱(https://fsl.fmrib.ox.ac.uk/fsl/fslwiki/Atlases)上的48个白质区域的DTI参数。具体如下:在Linux操作系统中利用FSL软件(http://fsl.fmrib.ox.ac.uk/fsl)中的FMRIBs Diffusion Toolbox对DTI数据进行预处理和分析。首先,使用涡流校正命令对原始数据进行头部运动和涡流的影响进行校正,对每个扩散加权图像第1个b=0图像进行仿射对齐。使用BET命令去除非脑组织。估计扩散张量元素,计算每个体素对应的分数各向异性(fractional anisotropy,FA)和平均扩散系数(mean diffusivity,MD)值。在约翰霍普金斯大学 ICBM-DTI-81白质图谱上提取ROI后,利用被试个体到图谱所在蒙特利尔神经研究所标准空间之间的配准参数,将图谱ROI反变换回个体空间,即可获取个体ROI,最后将ROI内参数值平均,进行后续的统计分析。
统计学处理 采用SPSS 25.0进行统计分析。对所有指标进行Shapiro Wilk检验评估数据的正态性,计量资料符合正态分布以±s表示,非正态分布以[M(P25,P75)]表示;计数资料以n(%)表示。多组计量资料符合正态分布且方差齐性时采用ANOVA单因素方差分析,事后两两比较采用LSD法;非正态分布或方差不齐时比较采用秩和检验(Kruska1-Wallis法),事后多重比较采用Kruskal-Wallis单因素ANOVA检验(针对k个样本);计数资料采用Pearson卡方检验,采用Bonferroni法进行多个样本率的两两比较。对于正态分布的定量数据和非正态分布的定量数据分别采用Pearson和Spearman相关分析探讨数据间的相关性。基因型频率用Hardy-Weinberg平衡检验。采用χ2检验分析基因型、等位基因在各组的分布情况。P<0.05为差异有统计学意义。
结果
人口统计学和临床特征 共纳入aMCI患者36例,vMCI患者20例,HC 34例,3组性别、年龄、受教育年限、糖尿病、高血压、高脂血症、吸烟史、饮酒史、日常生活能力方面差异均无统计学意义(P均>0.05)。aMCI、vMCI组患者的MMSE、MoCA评分均显着低于HC组(P均<0.001)(表1)。
血浆Aβ水平 3组血浆Aβ42水平差异无统计学意义(P=0.227)。3组血浆Aβ40(P=0.016)、Aβ42/40(P=0.019)差异有统计学意义。vMCI组血浆Aβ40水平较HC组显着升高(P=0.014)。aMCI和vMCI组血浆Aβ42/40水平较HC组差异均无统计学意义(P=1.000,P=0.105),而vMCI组血浆Aβ42/40水平较aMCI组显着下降(P=0.016)(表1)。
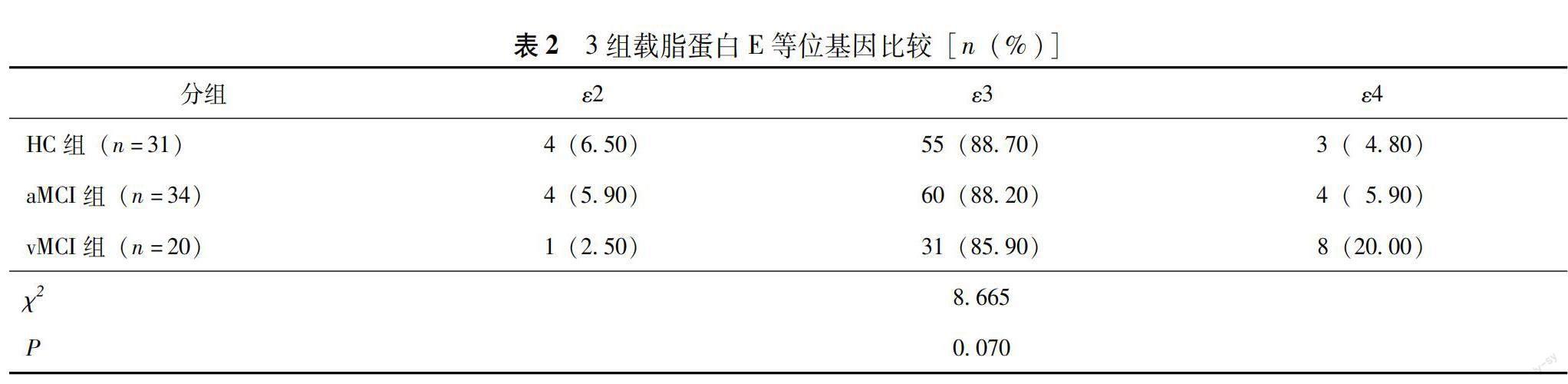
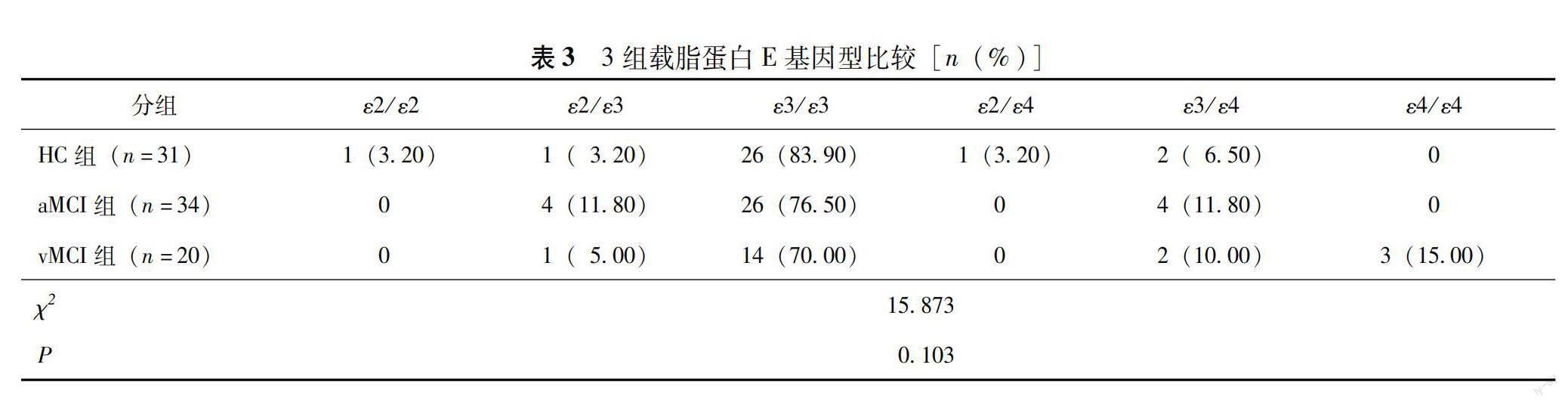
APOE等位基因及基因型 HC组有3例缺失基因结果,aMCI组有2例缺失基因结果。经χ2检验,3组APOE等位基因和基因型分布差异均无统计学意义(P均>0.05)(表2、3)。
DTI参数FA和MD比较 3组在多个脑白质区域的DTI参数FA和MD值差异有统计学意义。经错误发现率方法校正后,FA值在左侧内囊前肢差异有统计学意义(校正后P=0.047),而MD值在右侧内囊后肢(校正后P=0.018)、左侧上放射冠(校正后P=0.049)、左侧外囊(校正后P=0.018)、左侧扣带束扣带回部(cingulum cingulate gyrus,CGC)(校正后P=0.033)、左侧扣带束海马部(cingulum hippocampus,CGH)(校正后P=0.044)、左侧上额枕束(校正后P=0.005)的差异均有统计学意义。vMCI组在胼胝体体部、左侧内囊前肢、右侧CGC的FA值均较HC组(P=0.008,P=0.001,P=0.003)及aMCI组(P=0.007,P=0.001,P=0.013)显着降低,而HC组和aMCI组差异无统计学意义(P=1.000,P=0.837,P=0.528)。vMCI组左侧上放射冠、左侧外囊、左侧CGC、左侧上额枕束的MD值较HC组(P=0.024,P=0.001,P=0.003,P<0.001)及aMCI组(P=0.015,P=0.004,P=0.019,P=0.001)显着升高,而HC组和aMCI组差异无统计学意义(P=1.000);aMCI、vMCI组右侧内囊后肢(P=0.005,P=0.001)、左侧CGH(P=0.017,P=0.031)的MD值较HC组显着升高,但aMCI组和vMCI组差异无统计学意义(P=0.299,P=1.000)(表4)。
血浆Aβ42/40水平和DTI参数FA和MD的相关性 在aMCI组中,血浆Aβ42/40水平与左侧内囊后肢的FA呈正相关(r=0.403,P=0.015);与右侧穹隆的MD呈负相关(r=-0.395,P=0.017)。在vMCI组中,血浆Aβ42/40水平和右侧小脑上脚(r=0.575,P=0.008)、右侧内囊前肢(r=0.639,P=0.002)、右侧前放射冠(r=0.451,P=0.046)、右侧上放射冠(r=0.588,P=0.006)以及左侧穹隆(r=0.486,P=0.030)的FA呈正相关;与右侧小脑上脚(r=-0.558,P=0.011)、右侧内囊前肢(r=-0.626,P=0.003)、右侧内囊后肢(r=-0.460,P=0.041)的MD呈负相关(表5)。
讨论
本研究显示不同痴呆类型的早期阶段其血浆Aβ水平变化、脑白质微观结构损伤的区域存在差异,两种不同MCI亚型血浆Aβ42/40与DTI参数FA、MD具有相关性并且存在区域特异性。
通常认为Aβ在脑内的沉积是AD最主要的发病机制,有研究显示血管危险因素在AD发生发展中具有重要作用,根据AD的血管假说[10],血管危险因素可导致神经血管单位(neurovascular unit,NVU)失调和组织缺氧。组织缺氧可能使大脑中Aβ清除减少而产生增多,导致Aβ在脑实质和血管中的积聚。Aβ的增加会放大神经元功能障碍、神经元纤维缠结形成并加速神经变性,从而导致痴呆。在VaD中,NVU同样发挥着重要作用,越来越多的证据表明,脑血流量(cerebral blood flow,CBF)降低会导致NVU发生一系列变化,如神经元功能受损、神经胶质细胞异常活化、血管通透性变化等[11],这些共同作用于血管性痴呆的发病机制。有研究显示在皮质下缺血性血管病患者的血清Aβ水平可以通过调解CBF影响认知功能,且血清Aβ42/40和WMH的体积具有相关性[12]。因此,猜测aMCI和vMCI患者中可能都存在Aβ病理的改变。在AD中,Aβ在大脑中积累形成淀粉样斑块主要由Aβ42肽组成;纵向研究的结果表明,在患有CSVD的非痴呆老年人中,血浆Aβ42水平的升高和微出血有关,血浆Aβ40水平的升高则与WMH进展和腔隙性脑梗死有关[5]。本研究主要观察Aβ42、Aβ40以及Aβ42/40水平在不同亚型MCI中的变化特点,结果显示vMCI组具有较高的血浆Aβ40和较低的Aβ42/40,aMCI组血浆Aβ40较HC组差异无统计学意义,这与以往的研究[5,13-14]一致。在AD和VaD中,Aβ40多沉积在血管壁上从而造成微血管损伤[15],血浆Aβ40水平的增加可能与AD和VaD的进展有关[16]。脑白质损伤在AD和CSVD的发病机制中同样发挥着重要作用,血浆Aβ40水平和脑白质完整性的关系可能与Aβ40在脑血管异常中的作用有关。在过表达淀粉样前体蛋白的转基因小鼠,循环Aβ40可增强脑Aβ40引起的脑血管功能障碍,进而导致脑白质损伤[17]。也有学者认为,血浆Aβ可能增强内皮依赖性血管收缩,导致脑灌流不足,从而导致WMH[18-19];脑灌注不足或CBF减少,反之又促进了Aβ的过度产生和分泌进入循环[20]。本研究并未显示aMCI血浆Aβ42/40的降低,可能是因为Aβ42存在双相动力学[21],在Aβ病理前阶段,基于血液的Aβ42浓度增加,当累积的Aβ42浓度达到聚集和斑块形成的阈值后才开始减少,且在临床前或AD前驱阶段,Aβ40水平多保持不变[14]。未来可使用多中心、大样本、精度更高的血浆Aβ检测方法验证本研究结果。
本研究表明,aMCI患者和vMCI患者均表现出脑白质微结构损伤,但两种MCI患者早期脑白质损伤的区域存在差异。aMCI和vMCI组的左侧CGH的MD均较HC组显着升高,但aMCI组左侧CGH的MD值升高更为显着,表明aMCI患者早期CGH的损伤更加严重;vMCI组左侧内囊前肢的FA较aMCI和HC组显着降低,左侧上放射冠、左侧外囊、左侧CGC、左侧上额枕束的MD较aMCI和HC组显着增加,而aMCI和HC组差异无统计学意义,提示在这些区域内,vMCI比aMCI患者更早出现脑白质完整性的破坏。这些可能与两种MCI早期认知功能损害不同有关[22],aMCI患者早期主要表现为记忆力减退,vMCI患者认知功能损害主要表现为注意、执行等领域。左侧CGH主要参与陈述性和自传性记忆,这与aMCI患者早期以记忆衰退为特征相吻合;CGH是起源于海马伞前区、与扣带相汇合的一条皮质-边缘束,是皮质-边缘的关键中继区,在情绪调解方面发挥关键作用[23],这在一定程度上解释了AD患者更易出现抑郁或易怒的情绪变化。Liu等[22]关于aMCI和vMCI患者中枢胆碱能通路损害的临床研究显示,aMCI患者存在内侧中枢胆碱能投射通路的损害,而vMCI患者同时存在内外中枢胆碱能投射通路的损伤,具体表现为vMCI患者内侧通路的扣带FA降低,外侧通路外囊的MD升高,而且这种变化与vMCI患者整体认知及执行功能相关,推测外侧通路由于穿过易患脑血管疾病的位置,因此更容易受到血管疾病的破坏,从而导致早期认知功能损害。关于CSVD患者WMH和认知功能的相关性研究显示脑白质分区中的放射冠、内囊前肢、扣带回与执行功能相关;放射冠、内囊前肢与注意力相关[24]。这些均支持aMCI和vMCI患者存在不同区域的脑白质完整性破坏,进而导致不同认知功能损害的出现,未来笔者将结合横断面研究及纵向研究深入探讨这两种亚型的MCI患者脑白质结构完整性和认知功能之间动态变化的关系。
本研究血浆Aβ42/40水平与DTI参数FA和MD值之间的相关性显示,vMCI组表现出更多白质区域的相关性,提示相比于aMCI患者,vMCI患者血浆Aβ水平和脑白质微观结构的相互作用可能更大。Aβ对少突胶质细胞有毒性作用,虽然Aβ在AD的脑白质中沉积非常罕见,但可溶性Aβ水平在脑白质中升高,脑白质少突胶质细胞直接暴露于Aβ的数量相应增加,从而出现脑白质微观结构完整性的破坏[25]。本研究显示aMCI组血浆Aβ42/40水平和穹隆的MD呈负相关,推测在aMCI组中这种毒性作用首先作用于穹隆。穹隆是海马的主要传出白质束,与后扣带回皮质有着直接联系,而后扣带回皮质是Aβ沉积最常见的部位之一[26]。研究表明穹隆在AD患者中较其他白质纤维束更易受损,并与Aβ沉积相关[26-27],Aβ神经毒性效应导致神经胶质细胞代偿性激活,限制了分子扩散,最终表现为穹隆MD的改变,穹隆的白质变化可能成为一种有价值的AD早期影像学标志物。有研究表明穹隆FA和Aβ负荷在情景记忆的纵向下降方面存在协同作用,但穹隆的FA和Aβ负荷在横断面上无相关性[28],且本研究未显示aMCI组血浆Aβ42/40水平与穹隆的FA有相关性,与既往研究结果[26,29]不一致。推测与Aβ病理和临床前AD的髓鞘含量下降有关[30],而MD常用来评估髓鞘形成的程度,因此,血浆Aβ水平可能和MD值相关性更强。vMCI组血浆Aβ42/40水平和脑白质完整性相关性更大,可能是因为WMH存在脑缺血、淋巴系统衰竭、神经炎症等多种潜在机制的异质性[31],脑缺血灶引起Aβ清除途径受损,淋巴系统的损伤导致脑Aβ清除减少,神经炎症缓解时Aβ沉积减少[32]。本研究显示vMCI组血浆Aβ42/40水平与DTI的相关白质区域主要集中在小脑上脚、内囊前肢。Amtul等[33]研究显示,存在缺血损伤并受到Aβ毒性作用的小鼠中,脑白质损伤主要集中在内囊等部位,这可能是由于这些区域存在大量的轴突损伤且在缺血诱导下更易受损。小脑上脚是连接小脑齿状核和丘脑腹外侧部的齿状丘脑束的一部分,内囊前肢主要由丘脑皮质纤维、额桥束以及尾状核和豆状核之间的联系组成,研究表明CSVD患者小脑上脚的DTI指标与双重任务步态测验中步速显着相关[34],WMH患者内囊前肢损伤与步速有关[35],提示小脑上脚和内囊前肢可能参与CSVD患者的步态调控。以后可以针对性地探讨CSVD中血浆Aβ水平和小脑上脚和内囊前肢的白质完整性损害对认知障碍和步态障碍的影响,以及血浆Aβ水平和小脑上脚和内囊前肢的白质完整性损害之间是否存在交互作用。
综上,本研究表明在不同痴呆类型的早期,血浆Aβ水平变化不同,早期脑白质微观结构完整性损害的区域也有所差异,这可能影响了其早期的临床表现。aMCI和vMCI组血浆Aβ水平和脑白质微观结构之间具有相关性,aMCI组主要在穹隆,而vMCI组更为广泛,主要在小脑上脚和内囊前肢等,提示Aβ病理在这两种不同亚型MCI患者中以不同机制影响脑白质微结构,从而导致两种痴呆晚期的表现存在差异,而vMCI患者中Aβ病理和脑白质之间相互影响的机制可能存在更多的异质性,未来将进一步扩大样本量,进行纵向随访研究加以证实本研究结论。
参 考 文 献
[1]Albert MS,DeKosky ST,Dickson D,et al.The diagnosis of mild cognitive impairment due to Alzheimers disease:recommendations from the National Institute on Aging-Alzheimers Association workgroups on diagnostic guidelines for Alzheimers disease[J].Alzheimers Dement,2011,7(3):270-279.DOI:10.1016/j.jalz.2011.03.008.
[2]Sachdev P,Kalaria R,OBrien J,et al.Diagnostic criteria for vascular cognitive disorders:a VASCOG statement[J].Alzheimer Dis Assoc Disord,2014,28(3):206-218.DOI:10.1097/WAD.0000000000000034.
[3]Plowey ED,Bussiere T,Rajagovindan R,et al.Alzheimer disease neuropathology in a patient previously treated with aducanumab[J].Acta Neuropathol,2022,144(1):143-153.DOI:10.1007/s00401-022-02433-4.
[4]Pietroboni AM,Scarioni M,Carandini T,et al.CSF beta-amyloid and white matter damage:a new perspective on Alzheimers disease[J].J Neurol Neurosurg Psychiatry,2018,89(4):352-357.DOI:10.1136/jnnp-2017-316603.
[5]van Leijsen EMC,Kuiperij HB,Kersten I,et al.Plasma abeta (amyloid-beta) levels and severity and progression of small vessel disease[J].Stroke,2018,49(4):884-890.DOI:10.1161/STROKEAHA.117.019810.
[6]Collij LE,Ingala S,Top H,et al.White matter microstructure disruption in early stage amyloid pathology[J].Alzheimers Dement (Amst),2021,13(1):e12124.DOI:10.1002/dad2.12124.
[7]Petersen RC.Mild cognitive impairment as a diagnostic entity[J].J Intern Med,2004,256(3):183-194.DOI:10.1111/j.1365-2796.2004.01388.x.
[8]田金洲,解恒革,秦斌,等.中国血管性轻度认知损害诊断指南[J].中华内科杂志,2016,55(3):249-256.DOI:10.3760/cma.j.issn.0578-1426.2016.03.022.
[9]Pantoni L,Basile AM,Pracucci G,et al.Impact of age-related cerebral white matter changes on the transition to disability-the LADIS study:rationale,design and methodology[J].Neuroepidemiology,2005,24(1-2):51-62.DOI:10.1159/000081050.
[10]Soto-Rojas LO,Pacheco-Herrero M,Martinez-Gomez PA,et al.The neurovascular unit dysfunction in Alzheimers disease[J].Int J Mol Sci,2021,22(4):2022.DOI:10.3390/ijms22042022.
[11]Li C,Wang Y,Yan XL,et al.Pathological changes in neurovascular units:lessons from cases of vascular dementia[J].CNS Neurosci Ther,2021,27(1):17-25.DOI:10.1111/cns.13572.
[12]Zhang W,Li M,Zhou X,et al.Altered serum amyloid beta and cerebral perfusion and their associations with cognitive function in patients with subcortical ischemic vascular disease[J].Front Neurosci,2022,16:993767.DOI:10.3389/fnins.2022.993767.
[13]Hilal S,Akoudad S,van Duijn CM,et al.Plasma amyloid-beta levels,cerebral small vessel disease,and cognition:the Rotterdam study[J].J Alzheimers Dis,2017,60(3):977-987.DOI:10.3233/JAD-170458.
[14]Janelidze S,Stomrud E,Palmqvist S,et al.Plasma beta-amyloid in Alzheimers disease and vascular disease[J].Sci Rep,2016,6:26801.DOI:10.1038/srep26801.
[15]Attems J.Sporadic cerebral amyloid angiopathy:pathology,clinical implications,and possible pathomechanisms[J].Acta Neuropathol,2005,110(4):345-359.DOI:10.1007/s00401-005-1074-9.
[16]van Oijen M,Hofman A,Soares HD,et al.Plasma Abeta(1-40) and Abeta(1-42) and the risk of dementia:a prospective case-cohort study[J].Lancet Neurol,2006,5(8):655-660.DOI:10.1016/s1474-4422(06)70501-4.
[17]Niwa K,Carlson GA,Iadecola C.Exogenous A beta1-40 reproduces cerebrovascular alterations resulting from amyloid precursor protein overexpression in mice[J].J Cereb Blood Flow Metab,2000,20(12):1659-1668.DOI:10.1097/00004647-200012000-00005.
[18]Thomas T,Thomas G,McLendon C,et al.beta-Amyloid-mediated vasoactivity and vascular endothelial damage[J].Nature,1996,380(6570):168-171.DOI:10.1038/380168a0.
[19]Niwa K,Porter VA,Kazama K,et al.A beta-peptides enhance vasoconstriction in cerebral circulation[J].Am J Physiol Heart Circ Physiol,2001,281(6):H2417-H2424.DOI:10.1152/ajpheart.2001.281.6.H2417.
[20]Bennett SA,Pappas BA,Stevens WD,et al.Cleavage of amyloid precursor protein elicited by chronic cerebral hypoperfusion[J].Neurobiol Aging,2000,21(2):207-214.DOI:10.1016/s0197-4580(00)00131-7.
[21]Botella Lucena P,Vanherle S,Lodder C,et al.Blood-based Abeta42 increases in the earliest pre-pathological stage before decreasing with progressive amyloid pathology in preclinical models and human subjects:opening new avenues for prevention[J].Acta Neuropathol,2022,144(3):489-508.DOI:10.1007/s00401-022-02458-9.
[22]Liu Q,Zhong M,Yuan S,et al.Clinical study of central cholinergic pathway damage in two mild cognitive impairment patients[J].Neurol Sci,2021,42(11):4707-4717.DOI:10.1007/s10072-021-05573-9.
[23]Roberts G,Wen W,Ridgway K,et al.Hippocampal cingulum white matter increases over time in young people at high genetic risk for bipolar disorder[J].J Affect Disord,2022,314:325-332.DOI:10.1016/j.jad.2022.07.025.
[24]费贝妮,成宇,刘颖,等.基于智能分割分析脑小血管病患者白质高信号与认知功能的相关性研究[J].中国临床神经科学,2021,29(3):265-271.
[25]Pietroboni AM,Colombi A,Carandini T,et al.The role of amyloid-beta in white matter damage:possible common pathogenetic mechanisms in neurodegenerative and demyelinating diseases[J].J Alzheimers Dis,2020,78(1):13-22.DOI:10.3233/JAD-200868.
[26]Racine AM,Adluru N,Alexander AL,et al.Associations between white matter microstructure and amyloid burden in preclinical Alzheimers disease:a multimodal imaging investigation[J].Neuroimage Clin,2014,4:604-614.DOI:10.1016/j.nicl.2014.02.001.
[27]Huang H,Fan X,Weiner M,et al.Distinctive disruption patterns of white matter tracts in Alzheimers disease with full diffusion tensor characterization[J].Neurobiol Aging,2012,33(9):2029-2045.DOI:10.1016/j.neurobiolaging.2011.06.027.
[28]Rabin JS,Perea RD,Buckley RF,et al.Synergism between fornix microstructure and beta amyloid accelerates memory decline in clinically normal older adults[J].Neurobiol Aging,2019,81:38-46.DOI:10.1016/j.neurobiolaging.2019.05.005.
[29]Chao LL,Decarli C,Kriger S,et al.Associations between white matter hyperintensities and β amyloid on integrity of projection,association,and limbic fiber tracts measured with diffusion tensor MRI[J].PLoS One,2013,8(6):e65175.DOI:10.1371/journal.pone.0065175.
[30]Dean DC 3rd,Hurley SA,Kecskemeti SR,et al.Association of amyloid pathology with myelin alteration in preclinical Alzheimer disease[J].JAMA Neurol,2017,74(1):41-49.DOI:10.1001/jamaneurol.2016.3232.
[31]Saridin FN,Hilal S,Villaraza SG,et al.Brain amyloid beta,cerebral small vessel disease,and cognition:a memory clinic study[J].Neurology,2020,95(21):e2845-e2853.DOI:10.1212/WNL.0000000000011029.
[32]Liu XL,Ouyang FB,Hu LT,et al.Mesenchymal stem cells improve cognitive impairment and reduce Aβ deposition via promoting AQP4 polarity and relieving neuroinflammation in rats with chronic hypertension-induced cerebral small-vessel disease[J].Front Aging Neurosci,2022,14:883503.DOI:10.3389/fnagi.2022.883503.
[33]Amtul Z,Frias C,Randhawa J,et al.The spatial cerebral damage caused by larger infarct and beta-amyloid toxicity is driven by the anatomical/functional connectivity[J].J Comp Neurol,2020,528(1):48-60.DOI:10.1002/cne.24738.
[34]Ghanavati T,Smitt MS,Lord SR,et al.Deep white matter hyperintensities,microstructural integrity and dual task walking in older people[J].Brain Imaging Behav,2018,12(5):1488-1496.DOI:10.1007/s11682-017-9787-7.
[35]Rosario BL,Rosso AL,Aizenstein HJ,et al.Cerebral white matter and slow gait:contribution of hyperintensities and normal-appearing parenchyma[J].J Gerontol A Biol Sci Med Sci,2016,71(7):968-973.DOI:10.1093/gerona/glv224.
(收稿日期:2022-12-05)



