葛宁 姜媛媛 潘中平 万杰

基金项目:河南省医学科技攻关计划联合共建项目(LHGJ20200761)
摘要:目的 探讨叉头框M1(FOXM1)调控环状RNA circ_NOTCH1对胃癌细胞增殖、侵袭及耐药性的影响。方法 采用Western blot、实时荧光定量PCR分别检测胃癌及癌旁组织、人正常胃黏膜上皮细胞GES-1及胃癌细胞系MGC-803、HGC-27、BGC-823中FOXM1蛋白及circ_NOTCH1表达。将BGC-823细胞分为对照组、短发夹RNA FOXM1(sh-FOXM1)及阴性对照(sh-NC)组、小干扰RNA circ_NOTCH1(si-circ_NOTCH1)及阴性对照(si-NC)组、sh-FOXM1+circ_NOTCH1过表达质粒(sh-FOXM1+pcDNA-circ_NOTCH1)及sh-FOXM1+阴性对照(sh-FOXM1+pcDNA)组,采用CCK-8法和平板克隆形成实验检测细胞增殖,Transwell检测细胞侵袭。各组细胞分别加入1.0 mg/L阿霉素处理48 h后分析细胞耐药性,Western blot检测FOXM1、增殖细胞核抗原(PCNA)、Bax、多药耐药相关蛋白1(MRP1)、多药耐药基因1(MDR1)的表达,RNA下拉和RNA免疫沉淀检测FOXM1蛋白与circ_NOTCH1结合情况。结果 与癌旁组织比较,胃癌组织FOXM1蛋白、circ_NOTCH1表达水平显着升高(P均<0.001);与GES-1细胞比较,MGC-803、HGC-27、BGC-823细胞FOXM1蛋白、circ_NOTCH1表达水平显着升高(P均<0.001)。与对照组和sh-NC组比较,sh-FOXM1组BGC-823细胞FOXM1蛋白、circ_NOTCH1、吸光度值、克隆形成率、细胞侵袭数量、细胞活力及PCNA、MRP1、MDR1蛋白表达显着降低,Bax蛋白表达显着升高(P均<0.001);与对照组和si-NC组比较,si-circ_NOTCH1组BGC-823细胞circ_NOTCH1、吸光度值、克隆形成率、细胞侵袭数量、细胞活力及PCNA、MRP1、MDR1蛋白表达显着降低,Bax蛋白表达显着升高(P均<0.001)。与sh-FOXM1组和sh-FOXM1+pcDNA组比较,sh-FOXM1+pcDNA-circ_NOTCH1组BGC-823细胞circ_NOTCH1、吸光度值、克隆形成率、细胞侵袭数量、细胞活力及PCNA、MRP1、MDR1蛋白表达显着升高,Bax蛋白表达显着降低(P均<0.001)。FOXM1蛋白可与circ_NOTCH1相互作用。结论 干扰FOXM1可能通过下调circ_NOTCH1表达抑制胃癌细胞增殖、侵袭及耐药性。
关键词:叉头框M1;circ_NOTCH1;胃癌;增殖;耐药性
中图分类号: R735.2 文献标志码: A 文章编号:1000-503X(2023)05-0713-08
DOI:10.3881/j.issn.1000-503X.15584
Forkhead Box M1 Regulates the Proliferation,Invasion,and Drug Resistance of Gastric Cancer Cells via circ_NOTCH1
GE Ning1,JIANG Yuanyuan2,PAN Zhongping1,WAN Jie1
1Department of Anorectal Surgery,2Department of Gastroenterology,Zhengzhou Central Hospital Affiliated to Zhengzhou University,Zhengzhou 450001,China
Corresponding author:GE Ning Tel:0371-61310882,E-mail:drninger@163.com
ABSTRACT:Objective To investigate the impacts of forkhead box M1(FOXM1)on the proliferation,invasion,and drug resistance of gastric cancer cells by regulating the circular RNA circ_NOTCH1.Methods Western blotting and real-time quantitative PCR were performed to determine the expression of FOXM1 protein and circ_NOTCH1,respectively,in the gastric cancer tissue,para-carcinoma tissue,human normal gastric mucosa epithelial cell line GES-1 and gastric cancer cell lines MGC-803,HGC-27,and BGC-823.BGC-823 cells were classified into the following groups:control,short hairpin RNA FOXM1(sh-FOXM1)and negative control(sh-NC),small interfering RNA circ_NOTCH1(si-circ_NOTCH1)and negative control(si-NC),and sh-FOXM1+circ_NOTCH1 overexpression plasmid(sh-FOXM1+pcDNA-circ_NOTCH1)and sh-FOXM1+negative control(sh-FOXM1+pcDNA).CCK-8 assay and clone formation assay were employed to measure the cell proliferation,and Transwell assay to measure cell invasion.After treatment with 1.0 mg/L adriamycin for 48 h,the cell resistance in each group was analyzed.Western blotting was employed to determine the expression levels of FOXM1,proliferating cell nuclear antigen(PCNA),Bax,multi-drug resistance-associated protein 1(MRP1),and multi-drug resistance gene 1(MDR1).RNA pull-down and RNA immunoprecipitation were employed to examine the binding of circ_NOTCH1 to FOXM1 protein.Results Compared with those in the para-carcinoma tissue,the expression levels of FOXM1 protein and circ_NOTCH1 in the gastric cancer tissue were up-regulated(all P<0.001).Compared with GES-1 cells,MGC-803,HGC-27,and BGC-823 cells showed up-regulated expression levels of FOXM1 protein and circ_NOTCH1(all P<0.001).Compared with the control group and sh-NC group,the sh-FOXM1 group with down-regulated expression of FOXM1 protein and circ_NOTCH1 showed decreased optical density value,clone formation rate,cell invasion number,and cell viability,down-regulated expression of PCNA,MRP1,and MDR1,and up-regulated expression of Bax protein in BGC-823 cells(all P<0.001).Compared with the control group and the si-NC group,the si-circ_NOTCH1 group with down-regulated expression of circ_NOTCH1 showed decreased optical density value,clone formation rate,cell invasion number,and cell viability,down-regulated expression of PCNA,MRP1,and MDR1,and up-regulated expression of Bax protein in BGC-823 cells(all P<0.001).Compared with sh-FOXM1 group and sh-FOXM1+pcDNA group,the sh-FOXM1+pcDNA-circ_NOTCH1 group with up-regulated expression of circ_NOTCH1 showed increased optical density value,clone formation rate,cell invasion number,and cell viability,up-regulated expression of PCNA,MRP1,and MDR1,and down-regulated expression of Bax protein(all P<0.001).FOXM1 protein was able to interact with circ_NOTCH1.Conclusion Interference with FOXM1 may inhibit the proliferation,invasion,and drug resistance of gastric cancer cells by silencing circ_NOTCH1 expression.
Key words:forkhead box M1;circ_NOTCH1;gastric cancer;proliferation;drug resistance
Acta Acad Med Sin,2023,45(5):713-720
胃癌是消化系统最常见的恶性肿瘤之一,也是一个全球性的健康问题[1]。尽管随着医疗实践和技术的发展,胃癌的发病率有所下降,但由于我国胃癌患者就诊较晚,其死亡率仍然很高,五年生存率低于30%[2]。此外,耐药性的产生严重影响胃癌患者的预后生存率[3]。因此,需要进一步探索胃癌发生和耐药的潜在机制。叉头框M1(forkhead box M1,FOXM1)是叉头框家族的成员之一,具有促进肿瘤转移,细胞增殖、分化和侵袭等作用[4]。据报道,过表达FOXM1可促进胃癌细胞的生长和侵袭,且可参与肿瘤耐药过程[5-6]。此外,相关研究显示,环状RNA circ_NOTCH1在胃癌组织和细胞中呈高表达,沉默circ_NOTCH1可抑制胃癌细胞迁移和侵袭[7],但目前尚不清楚FOXM1和circ_NOTCH1通路对胃癌细胞的调控作用。因此,本研究探究FOXM1调控circ_NOTCH1对胃癌细胞增殖、侵袭及耐药性的影响,旨在为胃癌治疗提供新策略。
材料和方法
材料 收集2019年5月至2022年5月郑州大学附属郑州中心医院手术切除的40例胃癌患者的癌组织及距离癌灶4 cm处的癌旁组织。其中男23例,女17例,平均年龄(57.45±11.36)岁,平均体重指数(23.06±3.01)kg/m2。排除标准:手术前接受化疗或放疗;合并其他恶性肿瘤。本研究通过郑州大学附属郑州中心医院伦理委员会批准(伦理审批编号:201902),所有患者签署知情同意书。人正常胃黏膜上皮细胞GES-1及胃癌细胞系MGC-803、HGC-27、BGC-823均购自上海通蔚生物科技有限公司。阿霉素(货号:QN0097-BWD)购自北京百奥莱博科技有限公司,CCK-8试剂盒(货号:FN-EM1859)购自武汉菲恩生物科技有限公司,兔源一抗FOXM1(货号:ab207298)、增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)(货号:ab29)、Bax蛋白(货号:ab32503)、多药耐药相关蛋白1(multidrug resistance related protein 1,MRP1)(货号:ab260038)、多药耐药基因1(multidrug resistance gene 1,MDR1)(货号:ab170904)、GAPDH(货号:ab8245)及辣根过氧化物酶标记的羊抗兔二抗(货号:ab289875)均购自英国Abcam公司。pSilencer 2.1-U6-Neo质粒购自上海柯雷生物科技有限公司。短发夹RNA FOXM1(short hairpin RNA FOXM1,sh-FOXM1)及其阴性对照(negative control short hairpin RNA,sh-NC)、小干扰RNA circ_NOTCH1(small interfering RNA circ_NOTCH1,si-circ_NOTCH1)及其阴性对照(negative control small interfering RNA,si-NC)、circ_NOTCH1过表达质粒(circ_NOTCH1 overexpressed plasmid,pcDNA-circ_NOTCH1)及其阴性对照(pcDNA)均由广州锐博生物技术有限公司合成。
细胞培养及分组 GES-1、MGC-803、HGC-27、BGC-823细胞使用含10%胎牛血清的DMEM培养基,置于37 ℃、5% CO2细胞培养箱中培养。取对数生长期的BGC-823细胞,分为对照组(正常培养的BGC-823细胞)、sh-FOXM1组及sh-NC组、si-circ_NOTCH1组及si-NC组、sh-FOXM1+pcDNA-circ_NOTCH1组及sh-FOXM1+pcDNA组。按照Lipofectamine 2000试剂盒说明书进行相关转染,转染48 h后,将各组细胞以5×104个/孔的密度接种于24孔板中,并分别加入0、100、300、500、700、900 mg/L 新霉素G418,培养7 d后,选取能导致对照组BGC-823细胞完全死亡的G418浓度(500 mg/L)作为筛选稳定转染细胞株的最佳浓度,采用500 mg/L G418维持培养各组转染细胞直至获得稳定存活的细胞株,收集各组稳定转染的细胞株用于后续实验。
实时荧光定量PCR检测组织和细胞circ_NOTCH1表达 采用TRIzol试剂从组织匀浆和细胞中分离总RNA。将RNA逆转录为cDNA,以cDNA为模板进行荧光定量PCR检测circ_NOTCH1的相对表达量。以U6为内参基因,采用2-ΔΔCt法计算circ_NOTCH1的相对表达量。引物序列:circ_NOTCH1正向引物:5′-TATTTTACACAGAAACACTGCCT-3′,反向引物:5′-CGG- TGAACTGACCTGTACCC-3′;U6正向引物:5′-ATTGGAA- CGATACAGAGAAGATT-3′,反向引物:5′-GGAACGCTTCACGAATTTG-3′。
CCK-8法检测细胞活力 收集对照及转染后的各组BGC-823细胞以5×103个/孔的密度接种于96孔板中,培养48 h后,每孔加入10 μl CCK-8溶液,于37 ℃孵育2 h。采用酶标仪测定各孔细胞在450 nm处的吸光度(optical density,OD)值。此外,将各组细胞分别加入1 mg/L 阿霉素避光处理48 h[8],再加入10 μl CCK-8溶液孵育4 h,采用酶标仪测定450 nm处的OD值,并计算细胞活力。
平板克隆形成实验 将对照及转染后的各组BGC-823细胞以300个/孔的密度接种于6孔板中,培养14 d后,加入0.1%结晶紫染色20 min,观察细胞克隆形成数。克隆形成率(%)=(克隆数/接种细胞数)×100%。
Transwell实验检测细胞侵袭 将悬浮在无血清DMEM培养基中的各组BGC-823细胞以1×104个/ml的密度接种于涂有Matrigel基质胶的Transwell的上室内,另将含15%胎牛血清的DMEM培养基作为化学引诱剂加入下室,培养48 h后,4%多聚甲醛固定20 min,0.1%结晶紫染色10 min,光学显微镜观察细胞侵袭情况并统计侵袭细胞的数目。
Western blot检测FOXM1、PCNA、Bax、MRP1、MDR1蛋白表达 使用含有蛋白酶抑制剂的RIPA裂解液提取组织和细胞的总蛋白。采用BCA法对蛋白进行定量后,取50 μg的蛋白在12% SDS-PAGE凝胶上进行电泳分离,然后将分离的蛋白转移至PVDF膜上,加入5%脱脂奶粉封闭1 h,加入一抗FOXM1(1∶3000)、PCNA(1∶4000)、Bax(1∶3000)、MRP1(1∶3000)、MDR1(1∶3000)、GAPDH(1∶5000)4 ℃孵育过夜,然后与二抗(1∶4000)在常温下孵育1 h。采用化学发光法显色,使用Image J软件分析目的蛋白条带灰度值。
RNA下拉实验检测FOXM1蛋白与circ_NOTCH1的相互作用 将生物素化的阴性对照和circ_NOTCH1转染至BGC-823细胞中,孵育48 h后,将细胞裂解物与链酶亲和素标记的磁珠混合形成含磁珠的蛋白质-RNA-复合物,经高盐洗脱后除去磁珠得到蛋白质-RNA-复合物。以input为阳性对照,采用Western blot检测蛋白质-RNA-复合物中FOXM1蛋白的水平。
RNA结合蛋白免疫沉淀检测FOXM1蛋白与circ_NOTCH1的结合 采用RNA免疫沉淀裂解缓冲液裂解细胞,通过蛋白A/G磁珠对FOXM1蛋白进行免疫沉淀,用磁铁固定与复合物结合的磁珠并洗掉未结合的部分,采用实时荧光定量PCR分析复合物RNA中circ_NOTCH1的表达,以IgG蛋白作为对照。
统计学处理 采用SPSS 22.0统计软件,定量资料以均值±标准差表示,组间比较采用t检验,多组间比较采用单因素方差分析,进一步两组间比较采用SNK-q检验。采用Pearson检验分析胃癌组织FOXM1蛋白与circ_NOTCH1表达的相关性。P<0.05为差异有统计学意义。
结果
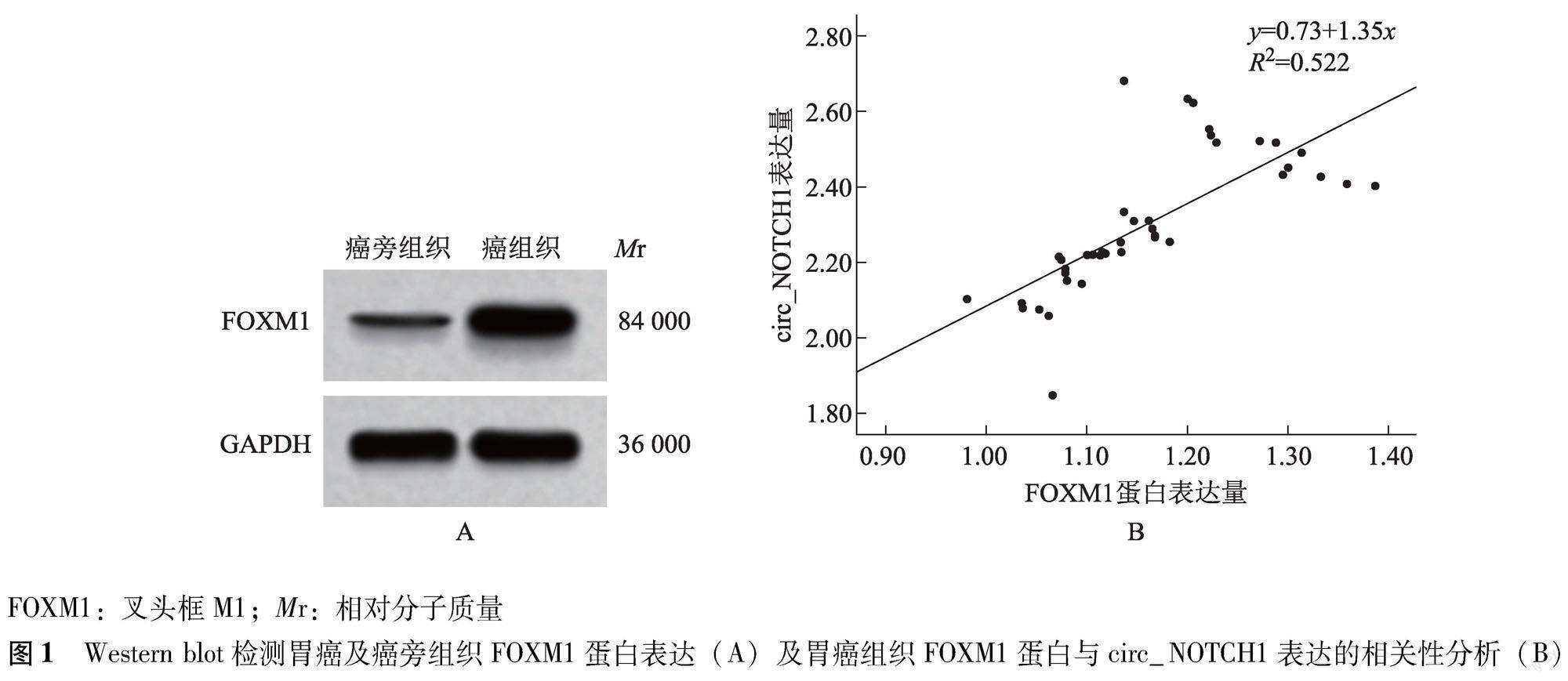
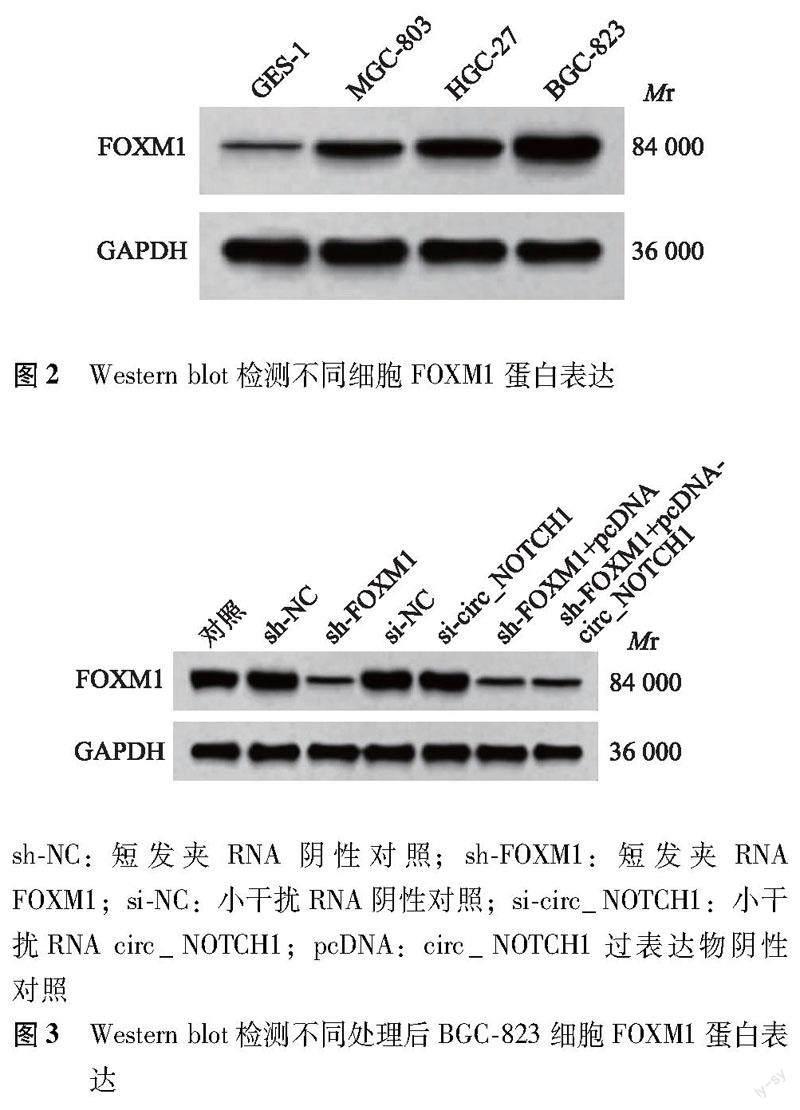
FOXM1蛋白、circ_NOTCH1在胃癌组织和细胞中的表达 与癌旁组织比较,胃癌组织FOXM1蛋白(1.18±0.12比0.23±0.01;t=49.896,P<0.001)、circ_NOTCH1(2.33±0.17比1.00±0.00;t=49.480,P<0.001)表达水平显着升高,且胃癌组织FOXM1蛋白与circ_NOTCH1表达呈正相关(r=0.723,P<0.001)(图1);与GES-1细胞比较,MGC-803(0.62±0.05比0.21±0.02;t=18.649,P<0.001和1.29±0.11比1.00±0.00;t=6.458,P<0.001)、HGC-27(0.83±0.07比0.21±0.02;t=20.861,P<0.001和1.83±0.12比1.00±0.00;t=16.942,P<0.001)、BGC-823细胞(1.36±0.12比0.21±0.02;t=23.155,P<0.001和2.17±0.14比1.00±0.00;t=20.471,P<0.001)FOXM1蛋白、circ_NOTCH1表达水平显着升高,且BGC-823细胞FOXM1蛋白和circ_NOTCH1表达量最高(图2)。
干扰FOXM1或circ_NOTCH1对BGC-823细胞FOXM1蛋白、circ_NOTCH1表达的影响 与对照组和sh-NC组比较,sh-FOXM1组BGC-823细胞FOXM1蛋白(0.39±0.03比1.35±0.12;q=25.149,P<0.001和0.39±0.03比1.34±0.13;q=24.887,P<0.001)、circ_NOTCH1(0.27±0.02比1.00±0.00;q=75.756,P<0.001和0.27±0.02比1.02±0.01;q=77.831,P<0.001)表达水平显着降低;与对照组和si-NC组比较,si-circ_NOTCH1组BGC-823细胞FOXM1蛋白表达水平差异无统计学意义(1.35±0.11比1.35±0.12;q=0.000,P>0.999和1.35±0.11比1.36±0.12;q=0.262,P>0.999),circ_NOTCH1表达水平显着降低(0.18±0.01比1.00±0.00;q=85.095,P<0.001和0.18±0.01比1.01±0.02;q=86.133,P<0.001);与sh-FOXM1组和sh-FOXM1+pcDNA组比较,sh-FOXM1+pcDNA-circ_NOTCH1组BGC-823细胞FOXM1蛋白表达水平差异无统计学意义(0.41±0.03比0.39±0.03;q=0.524,P>0.999和0.41±0.03比0.40±0.04;q=0.262,P>0.999)(图3),circ_NOTCH1表达水平显着升高(0.67±0.05比0.27±0.02;q=41.510,P<0.001和0.67±0.05比0.29±0.02;q=39.434,P<0.001)。
干扰FOXM1或circ_NOTCH1对BGC-823细胞增殖能力的影响 与对照组和sh-NC组比较,sh-FOXM1组BGC-823细胞OD值(0.33±0.02比0.96±0.08;q=25.224,P<0.001和0.33±0.02比0.97±0.09;q=25.624,P<0.001)、克隆形成率[(28.33±1.23)%比(76.68±3.17)%;q=49.256,P<0.001和(28.33±1.23)%比(75.59±3.20)%;q=48.145,P<0.001]显着降低;与对照组和si-NC组比较,si-circ_NOTCH1组BGC-823细胞OD值(0.28±0.02比0.96±0.08;sh-NC:短发夹RNA阴性对照;sh-FOXM1:短发夹RNA FOXM1;si-NC:小干扰RNA阴性对照;si-circ_NOTCH1:小干扰RNA circ_NOTCH1;pcDNA:circ_NOTCH1过表达物阴性对照q=27.226,P<0.001和0.28±0.02比0.95±0.08;q=26.826,P<0.001)、克隆形成率[(24.45±1.18)%比(76.68±3.17)%;q=53.208,P<0.001和(24.45±1.18)%比(74.67±3.09)%;q=51.161,P<0.001]显着降低;与sh-FOXM1组和sh-FOXM1+pcDNA组比较,sh-FOXM1+pcDNA-circ_NOTCH1组BGC-823细胞OD值(0.76±0.06比0.33±0.02;q=17.216,P<0.001和0.76±0.06比0.35±0.03;q=16.416,P<0.001)、克隆形成率[(58.82±2.43)%比(28.33±1.23)%;q=31.061,P<0.001和(58.82±2.43)%比(30.11±1.35)%;q=29.248,P<0.001]显着升高(图4)。
干扰FOXM1或circ_NOTCH1对BGC-823细胞侵袭能力的影响 与对照组和sh-NC组比较,sh-FOXM1组BGC-823细胞侵袭数量显着降低[(25.58±1.16)个比(73.34±3.08)个;q=49.611,P<0.001和(25.58±1.16)个比(73.29±3.21)个;q=49.559,P<0.001];与对照组和si-NC组比较,si-circ_NOTCH1组BGC-823细胞侵袭数量显着降低[(22.93±1.20)个比(73.34±3.08)个;q=52.363,P<0.001和(22.93±1.20)个比(72.93±3.04)个;q=51.937,P<0.001];与sh-FOXM1组和sh-FOXM1+pcDNA组比较,sh-FOXM1+pcDNA-circ_NOTCH1组BGC-823细胞侵袭数量显着升高[(49.35±2.36)个比(25.58±1.16)个;q=24.691,P<0.001和(49.35±2.36)个比(26.13±1.24)个;q=24.120,P<0.001](图5)。
干扰FOXM1或circ_NOTCH1对BGC-823细胞耐药性的影响 加入阿霉素处理后,与对照组和sh-NC组比较,sh-FOXM1组BGC-823细胞活力显着降低[(27.73±1.29)%比(68.83±3.45)%;q=40.870,P<0.001和(27.73±1.29)%比(67.75±3.24)%;q=39.796,P<0.001];与对照组和si-NC组比较,si-circ_NOTCH1组BGC-823细胞活力显着降低[(21.18±1.31)%比(68.83±3.45)%;q=47.383,P<0.001和(21.18±1.31)%比(68.27±3.06)%;q=46.827,P<0.001];与sh-FOXM1组和sh-FOXM1+pcDNA组比较,sh-FOXM1+pcDNA-circ_NOTCH1组BGC-823细胞活力显着升高[(43.46±2.28)%比(27.73±1.29)%;q=15.642,P<0.001和(43.46±2.28)%比(28.32±1.46)%;q=15.055,P<0.001]。
干扰FOXM1或circ_NOTCH1对BGC-823细胞PCNA、Bax、MRP1、MDR1蛋白表达的影响 与对照组和sh-NC组比较,sh-FOXM1组BGC-823细胞PCNA(0.68±0.06比1.52±0.11;q=22.355,P<0.001和0.68±0.06比1.53±0.12;q=22.261,P<0.001)、MRP1(0.23±0.02比0.89±0.08;q=25.983,P<0.001和0.23±0.02比0.88±0.07;q=25.589,P<0.001)、MDR1蛋白(0.45±0.05比1.07±0.12;q=17.404,P<0.001和0.45±0.05比1.08±0.11;q=17.685,P<0.001)表达显着降低,Bax蛋白表达显着升高(1.13±0.09比0.22±0.02;q=31.523,P<0.001和1.13±0.09比0.24±0.02;q=30.831,P<0.001);与对照组和si-NC组比较,si-circ_NOTCH1组BGC-823细胞PCNA(0.53±0.05比1.52±0.11;q=26.347,P<0.001和0.53±0.05比1.51±0.13;q=26.081,P<0.001)、MRP1(0.14±0.01比0.89±0.08;q=29.526,P<0.001和0.14±0.01比0.90±0.10;q=29.919,P<0.001)、MDR1蛋白(0.40±0.04比1.07±0.12;q=18.808,P<0.001和0.40±0.04比1.09±0.13;q=19.369,P<0.001)表达显着降低,Bax蛋白表达显着升高(1.32±0.11比0.22±0.02;q=38.105,P<0.001和1.32±0.11比0.23±0.02;q=37.759,P<0.001);与sh-FOXM1组和sh-FOXM1+pcDNA组比较,sh-FOXM1+pcDNA-circ_NOTCH1组BGC-823细胞PCNA(0.86±0.07比0.68±0.06;q=4.790,P=0.027和0.86±0.07比0.69±0.07;q=4.524,P=0.042)、MRP1(0.67±0.07比0.23±0.02;q=17.322,P<0.001和0.67±0.07比0.24±0.02;q=10.106,P<0.001)、MDR1蛋白(0.82±0.07比0.45±0.05;q=10.386,P<0.001和0.82±0.07比0.46±0.03;q=26.081,P<0.001)表达升高,Bax蛋白表达显着降低(0.71±0.06比1.13±0.09;q=14.549,P<0.001和0.71±0.06比1.12±0.10;q=14.203,P<0.001)(图6)。
FOXM1蛋白与circ_NOTCH1的相互作用 RNA下拉实验结果显示,FOXM1蛋白能与circ_NOTCH1相互作用。RNA结合蛋白免疫沉淀实验结果显示FOXM1蛋白可与circ_NOTCH1结合(图7)。
讨论
胃癌作为一种在世界范围内发病率较高的消化道恶性肿瘤,其治疗方法主要取决于肿瘤的发展阶段。据报道,当肿瘤转移至周围组织时,化疗可以显着提高晚期胃癌患者的生存率[9]。阿霉素是一种常用的化疗药物,然而,长期接受阿霉素治疗的胃癌患者容易产生耐药性,导致其临床疗效受到限制,严重影响患者的生存质量和预后[10]。因此,探究调控胃癌进展及耐药性相关的分子机制对于改善胃癌患者的预后具有重要意义。
FOXM1是一种调节肿瘤生长和转移的癌基因[11]。据报道,沉默FOXM1基因可抑制胃癌细胞的增殖和转移[12];敲减FOXM1基因可抑制食管鳞癌的进展[13];FOXM1基因也可介导弥漫大B细胞淋巴瘤细胞产生阿霉素耐药性[14]。本研究结果显示,FOXM1蛋白在胃癌组织和MGC-803、HGC-27、BGC-823细胞中呈高表达,且在BGC-823细胞中表达量最高,因此,选取BGC-823细胞为研究对象进行后续实验。本研究发现干扰FOXM1基因可抑制胃癌细胞的增殖、侵袭及耐药性。PCNA作为增殖相关蛋白,具有促进细胞增殖的作用[15];Bax蛋白表达水平与细胞凋亡能力成正比,可作为评估细胞凋亡的指标[16];MRP1蛋白在胶质母细胞瘤中表达上调以介导替莫唑胺的耐药性[17];MDR1蛋白上调增强了肝癌细胞对阿霉素的耐药性[18]。本研究结果显示,干扰FOXM1基因可抑制胃癌BGC-823细胞PCNA、MRP1、MDR1蛋白表达,促进Bax蛋白表达,从蛋白水平上证实了干扰FOXM1基因可抑制胃癌的进展及耐药性,提示FOXM1可能成为治疗胃癌的潜在靶点。然而干扰FOXM1基因如何调控PCNA、MRP1、MDR1蛋白来抑制胃癌的进展及耐药性还有待进一步探究。
研究发现circANKHD1/FOXM1轴可促进膀胱浸润性尿路上皮癌的发生[19],提示FOXM1蛋白与环状RNA之间的相互作用可能在肿瘤进展中发挥着重要的作用。大量研究证实环状RNA在多种肿瘤的发生和发展中起到关键的调控作用,例如过表达circ_NOTCH1可增强胃癌细胞增殖和侵袭性[20],敲减circ_NOTCH1可抑制鼻咽癌细胞增殖、侵袭和迁移[21]。本研究结果显示,circ_NOTCH1在胃癌组织和细胞中呈高表达,沉默circ_NOTCH1可抑制胃癌细胞的增殖、侵袭及耐药性。此外,本研究还发现,FOXM1蛋白可与circ_NOTCH1相互作用,干扰FOXM1基因可抑制胃癌BGC-823细胞circ_NOTCH1的表达,提示干扰FOXM1基因可能通过沉默circ_NOTCH1表达来抑制胃癌细胞增殖、侵袭及耐药性。因此,本研究在干扰FOXM1基因基础上增加pcDNA-circ_NOTCH1干预胃癌BGC-823细胞,结果显示,pcDNA-circ_NOTCH1减弱了干扰FOXM1基因对胃癌细胞增殖、侵袭及耐药性的抑制作用。但本研究缺少体内实验的验证,后期将结合动物模型进一步探讨机制。
综上,本研究结果显示,干扰FOXM1基因可能通过沉默circ_NOTCH1表达抑制胃癌BGC-823细胞的增殖、侵袭及耐药性。
参考文献
[1]Guo Q,Xu J,Huang Z,et al.ADMA mediates gastric cancer cell migration and invasion via Wnt/β-catenin signaling pathway[J].Clin Transl Oncol,2021,23(2):325-334.DOI:10.1007/s12094-020-02422-7.
[2]Guo Y,Wang Y,Ma Y,et al.Upregulation of lncRNA SUMO1P3 promotes proliferation,invasion and drug resistance in gastric cancer through interacting with the CNBP protein[J].RSC Adv,2020,10(10):6006-6016.DOI:10.1039/c9ra09497k.
[3]Ou W,Lin L,Chen R,et al.Circ_0081143 contributes to gastric cancer malignant development and doxorubicin resistance by elevating the expression of YES1 by targeting miR-129-2-3p[J].Gut Liver,2022,16(6):861-874.DOI:10.5009/gnl210354.
[4]Xing S,Tian Z,Zheng W,et al.Hypoxia downregulated miR-4521 suppresses gastric carcinoma progression through regulation of IGF2 and FOXM1[J].Mol Cancer,2021,20(1):9.DOI:10.1186/s12943-020-01295-2.
[5]林志金,张长青,陈新琦,等.miR-149-3p靶向FOXM1抑制人胃癌细胞SGC-7901生长和迁移[J].中国免疫学杂志,2020,36(10):1212-1216.DOI:10.3969/j.issn.1000-484X.2020.10.012.
[6]宋莉平,王宇.转录因子FoxM1在肿瘤耐药中的研究进展[J].现代肿瘤医学,2019,27(22):4107-4111.DOI:10.3969/j.issn.1672-4992.2019.22.039.
[7]Zhao X,Zhong Q,Cheng X,et al.miR-449c-5p availability is antagonized by circ_NOTCH1 for MYC-induced NOTCH1 upregulation as well as tumor metastasis and stemness in gastric cancer[J].J Cell Biochem,2020,121(10):4052-4063.DOI:10.1002/jcb.29575.
[8]刘源,倪渐凤芳,刘丽娜,等.丹参酮IIA抑制胃癌细胞的阿霉素耐药[J].中国病理生理杂志,2019,35(12):2208-2214.DOI:10.3969/j.issn.1000-4718.2019.12.015.
[9]Hu X,Lou T,Yuan C,et al.Effects of lncRNA ANRIL-knockdown on the proliferation,apoptosis and cell cycle of gastric cancer cells[J].Oncol Lett,2021,22(2):621.DOI:10.3892/ol.2021.12882.
[10]刘子倩,李哲,王胤,等.基于阿霉素治疗的胃癌中lncRNA表达谱的微阵列分析[J].青岛大学学报(自然科学版),2021,34(4):16-22,29.DOI:10.3969/j.issn.1006-1037.2021.11.04.
[11]Zhang Y,Chen L,Ye X,et al.Expression and mechanism of exosome-mediated a FOXM1 related long noncoding RNA in gastric cancer[J].J Nanobiotechnology,2021,19(1):133.DOI:10.1186/s12951-021-00873-w.
[12]Lee NR,Kim DY,Jin H,et al.Inactivation of the Akt/FOXM1 signaling pathway by panobinostat suppresses the proliferation and metastasis of gastric cancer cells[J].Int J Mol Sci,2021,22(11):5955.DOI:10.3390/ijms22115955.
[13]Su M,Tang J,Zhang B,et al.LncRNA GACAT3 promotes esophageal squamous cell carcinoma progression through regulation of miR-149/FOXM1[J].Cancer Cell Int,2021,21(1):478.DOI:10.1186/s12935-021-02192-4.
[14]张瑞,罗彬,刘安贵,等.FOXM1通过影响PI3K-AKT通路介导弥漫大B细胞淋巴瘤阿霉素耐药的产生[J].广西医科大学学报,2022,39(7):1039-1046.DOI:10.16190/j.cnki.45-1211/r.2022.07.003.
[15]Li Y,Lv M,Wang J,et al.LINC00641 inhibits the proliferation and invasion of ovarian cancer cells by targeting miR-320a[J].Transl Cancer Res,2021,10(11):4894-4904.DOI:10.21037/tcr-21-2314.
[16]Wang Z,Chen X,Liu N,et al.A nuclear long non-coding RNA LINC00618 accelerates ferroptosis in a manner dependent upon apoptosis[J].Mol Ther,2021,29(1):263-274.DOI:10.1016/j.ymthe.2020.09.024.
[17]Xu J,Song J,Xiao M,et al.RUNX1(RUNX family transcription factor 1),a target of microRNA miR-128-3p,promotes temozolomide resistance in glioblastoma multiform by upregulating multidrug resistance-associated protein 1(MRP1)[J].Bioengineered,2021,12(2):11768-11781.DOI:10.1080/21655979.2021.2009976.
[18]Shao M,Shi R,Gao ZX,et al.Crizotinib and doxorubicin cooperatively reduces drug resistance by mitigating MDR1 to increase hepatocellular carcinoma cells death[J].Front Oncol,2021,11:650052.DOI:10.3389/fonc.2021.650052.
[19]Wei WS,Wang N,Deng MH,et al.LRPPRC regulates redox homeostasis via the circANKHD1/FOXM1 axis to enhance bladder urothelial carcinoma tumorigenesis[J].Redox Biol,2021,48:102201.DOI:10.1016/j.redox.2021.102201.
[20]Guan E,Xu X,Xue F.circ_NOTCH1 acts as a sponge of miR-637 and affects the expression of its target gene Apelin to regulate gastric cancer cell growth[J].Biochem Cell Biol,2020,98(2):164-170.DOI:10.1139/bcb-2019-0079.
[21]Huang W,Song W,Jiang Y,et al.c-Myc-induced circ_NOTCH1 promotes aggressive phenotypes of nasopharyngeal carcinoma cells by regulating the miR-34c-5p/c-Myc axis[J].Cell Biol Int,2021,45(7):1436-1447.DOI:10.1002/cbin.11582.
(收稿日期:2023-03-17)



