李瑛 李清华 刘桂波 尹晓妮 何宏 陈秋卢 段凝 魏向阳 杜兆东
[摘要]目的探讨肺炎克雷伯菌性肝脓肿(KPLA)继发内源性眼内炎(endogenous endophthalmitis,EE)患者的眼部临床特征及诊疗方案。方法选取2019年1月—2020年12月就诊于我院的KPLA继发EE患者6例(7眼),分析患者的临床表现、检查结果、治疗方案及预后。结果6例患者均为男性,5例伴有发热,所有患者均有视力下降,初诊时视力无光感者4例(5眼),手动视力者1例(1眼),光感者1例(1眼)。所有患者均具有视力下降、结膜充血水肿、眼球胀痛、前房炎症反应等典型眼内炎临床表现,术后眼内液微生物培养均为肺炎克雷伯菌阳性。末次就诊时丧失视力者4例(4眼),视力检查不配合者1例(1眼),失访者1例(2眼)。结论KPLA继发EE对眼球结构和视功能破坏性强,KPLA患者出现发热等全身症状或视力下降、眼红、眼痛等眼部不适时,应建议患者立即去眼科门诊就诊并定期随诊,以警惕眼内炎的发生。
[关键词]眼内炎;肺炎克雷伯菌;肝脓肿;诊断;预后
[中图分类号]R771.2;R575.4[文献标志码]A
Clinical features and prognosis of endogenous endophthalmitis secondary to klebsiella pneumoniae liver abscess: An analysis of six cases LI Ying, LI Qinghua, LIU Guibo, YIN Xiaoni, HE Hong, CHEN Qiulu, DUAN Ning, WEI Xiangyang, DU Zhaodong (Department of Ophthalmology, The Affiliated Hospital of Qingdao University, Qingdao 266003, China)
[ABSTRACT]ObjectiveTo investigate the ocular clinical features and diagnostic and therapeutic protocol of patients with endogenous endophthalmitis (EE) secondary to Klebsiella pneumoniae liver abscess (KPLA). MethodsSix patients (seven eyes) with EE secondary to KPLA who attended our hospital from January 2019 to December 2020 were enrolled and analyzed in terms of clinical manifestation, examination findings, treatment regimen, and prognosis. ResultsAll six patients were male, among whom five had pyrexia. All patients had impaired vision, and at initial diagnosis, there were four patients (five eyes) with no light perception, one patient (one eye) with manual vision, and one case (one eye) with light perception. All patients had the typical clinical manifestations of endophthalmitis such as impaired vision, conjunctival congestion and edema, ocular swelling and pain, and inflammatory response in the anterior chamber, and postoperative microbial culture of intraocular fluid showed positive Klebsiella pneumoniae. At the last visit, four patients (four eyes) had loss of vision, one patient (one eye) did not cooperate in vision check, and one patient (two eyes) was lost to follow-up. ConclusionEE secondary to KPLA is highly destructive to eyeball structure and visual function, and patients with KPLA who develop systemic symptoms (such as fever) or ocular discomfort (such as loss of vision, eye redness, and eye pain) should attend the outpatient service of ophthalmology department and receive regular follow-up examination to be alert to the development of endophthalmitis.
[KEY WORDS]Endophthalmitis; Klebsiella pneumonia; Liver abscess; Diagnosis; Prognosis
内源性眼内炎(endogenous endophthalmitis,EE)是指细菌或真菌经血液循环或淋巴循环进入眼内,累及脉络膜以及视网膜等眼内组织的致盲性炎症[1]。肺炎克雷伯菌(KP)是一种常见的革兰阴性杆菌,常定植于人体皮肤、鼻咽、肠道等处[2],可透过内皮和肠道屏障经门静脉或胆道感染引起细菌性肝脓肿;若侵入眼内可导致EE,其所表现出的临床症状不典型且起病急、发展迅速,短时间内可造成眼内多种组织的破坏[3]。本研究回顾性分析了由KPLA继发EE患者的临床特征、诊治方案及预后。现将结果报告如下。
1资料与方法
将2019年1月—2020年12月就诊于我院的肺炎克雷伯菌性肝脓肿(KPLA)继发EE的患者纳入研究。患者纳入标准:①临床诊断为肝脓肿且肝穿刺细菌培养或血液培养KP阳性;②至少1眼眼内液细菌培养KP阳性;③具有感染性化脓性眼内炎症的体征;④入院后经验性应用抗生素局部及全身治疗;⑤单独或联合进行患眼玻璃体腔注药术、玻璃体切除术或眼内容物剜除术治疗者。排除标准:既往患眼有外伤、内眼手术、角膜溃疡及青光眼病史的患者。
收集患者的性别、年龄、首诊科室、发热及持续时间、全身疾病等一般资料;记录患者眼部表现,包括眼前节结构及眼底等专科情况;获取患者的实验室检查、病原学检查、病理学检查及眼眶CT、眼部B超等影像学检查结果。
2结果
2.1临床表现
纳入研究的6例KPLA继发EE患者均为男性,平均年龄(56.8±9.8)岁;其中首诊的科室为眼科3例,非眼科3例;就诊前5~10 d内持续发热者5例,且5例患者患有糖尿病;无发热症状者1例,为胃恶性肿瘤化疗术后患者;另外,6例患者中,合并高血压者2例,低钾血症者2例,肾脓肿者1例,同时合并感染性休克、胸腔积液以及低蛋白血症者2例,合并糖尿病性酮症酸中毒、克雷伯杆菌败血症、腿脓肿以及肺脓肿伴肺炎者1例;6例患者诊断为KPLA后约2~6 d后均出现不同程度的视力下降、眼红、眼痛等眼部症状,经眼科检查确诊为EE。
6例KPLA继发EE的患者中,5例累及单眼,1例累及双眼。所有患者在就诊前均出现眼部不适,主要为不同程度的视力下降,其中4例伴有患眼胀痛。6例患者中眼部不适时间持续15 d以上者4例,其就诊时视力无光感,另外2例患者为近3 d内眼部不适,就诊时视力分别为手动或者光感视力。6例患者中,2例患者出现眼睑皮肤充血肿胀,眼球突出、转动困难。所有患者均有不同程度的结膜充血水肿;角膜水肿者3例,透明者2例,灰白色浑浊者1例;除角膜灰白色混浊患者眼内结构窥不清外,其余5例患者均可见不同程度的前房炎症反应,包括炎症细胞的浸润(裂隙灯下观察到房水细胞)和房水蛋白浓度的升高(裂隙灯下观察到房水闪辉),并伴有明显的前房积脓或纤维渗出物,渗出膜遮盖瞳孔,5例患者的视网膜受累情况因玻璃体混浊导致无法通过间接眼底镜检查。
2.2辅助检查
实验室检查显示,所有患者的炎性指标(如白细胞计数、C反应蛋白等)均有不同程度的升高。6例患者均行外周静脉血、房水/玻璃体细菌培养,其中血培养KP阳性者5例,阴性者1例,所有患者房水/玻璃体培养KP均为阳性;药敏试验提示6例患者均对头孢他啶、头孢曲松等三代头孢类抗生素及亚胺培南、美罗培南等碳青霉烯类抗生素敏感,对环丙沙星等喹诺酮类抗生素敏感者5例,耐药者1例。
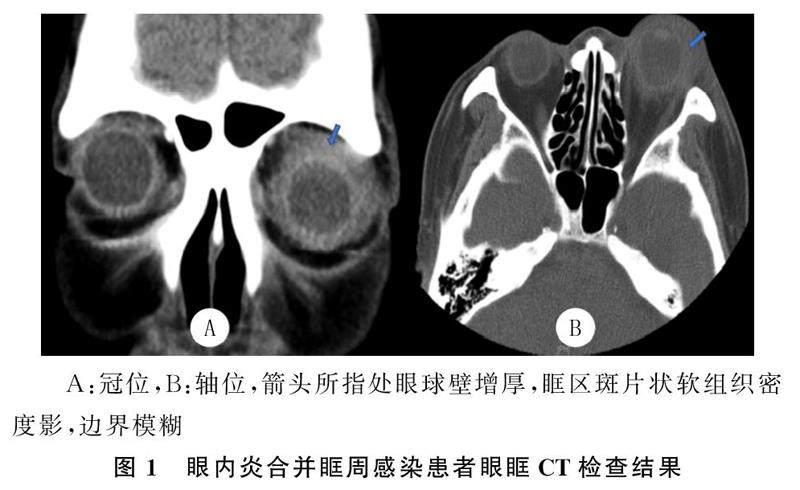
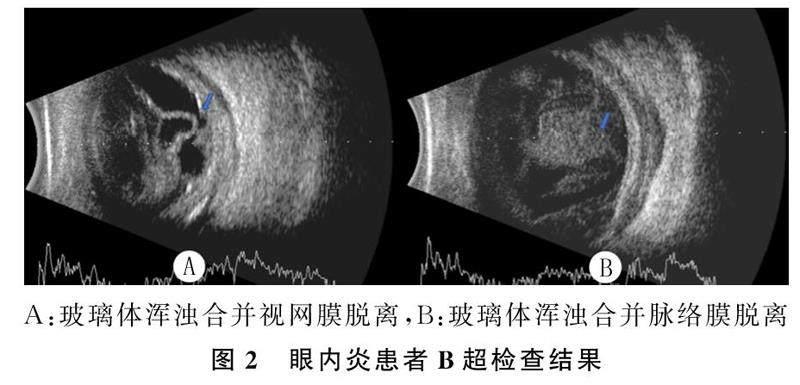
2例眼球突出、转动困难合并眼睑充血肿胀的患者眼眶CT检查显示,眼球壁增厚,眶区斑片状软组织密度影,边界模糊,提示合并眶周感染(均为左眼),结合相关症状和体征,提示全眼球炎(图1)。6例患者的眼部B超检查显示,玻璃体腔均可见到不同程度的密集点线状、絮状混浊表现,后运动实验(+),提示眼内炎;合并视网膜增殖脱离者1例(图2A),合并脉络膜脱离者1例(图2B)。
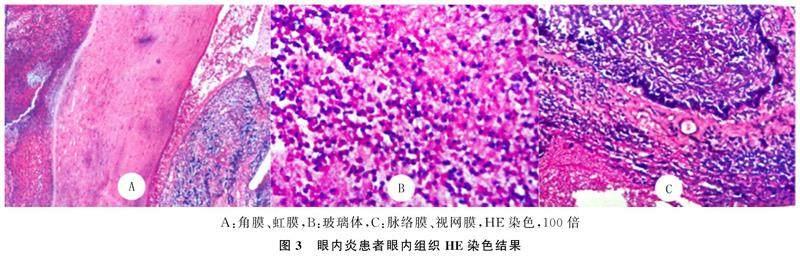
3例行眼内容物剜除术的患者术中刮除眼内组织,可见脓性胶冻样的玻璃体组织,病理学检查HE染色结果显示角膜上皮不均匀增生增厚,基质层胶原纤维肿胀,其间炎症细胞浸润,虹膜基质层血管扩张充血,见大量炎细胞浸润(图3A);玻璃体内大量炎细胞浸润及坏死组织(图3B);眼内结构紊乱,脉络膜及视网膜组织内见大量炎细胞浸润(图3C)。
2.3治疗及预后
本研究纳入的6例(7眼)KPLA继发EE患者中,1例(1眼)因角膜混浊严重且合并全眼球炎直接行眼内容物剜除术;2例(2眼)单独行玻璃体腔注药术,术中注入万古霉素及头孢他啶,术后均因眼内炎症持续加重最终行眼内容物剜除术;2例(3眼)行玻璃体切除联合玻璃体腔注药治疗,术中注入万古霉素及头孢他啶,其中1例(2眼)术后因全身情况较差未能复诊,另1例末次复诊时意识不清,视力检查不配合,眼睑、球结膜充血,角膜窥不清,可见黄白色组织附着;1例(1眼)患者因不能耐受手术而采取保守治疗,末次复诊时患眼视力无光感,前房炎症反应仍明显,瞳孔区可见机化膜,眼部B超检查示患眼玻璃体混浊,视网膜增殖脱离。
3讨论
EE是一种严重的眼部感染,作为眼科急症之一,可以导致患眼视力的永久性丧失[4]。KPLA是EE的一个易感因素[5],KP通过荚膜致病,自身具有抵抗巨噬细胞吞噬的作用,因而容易发生转移性感染[6];另外,KP引起的炎症反应可以破坏血-视网膜屏障,使细菌更易通过受损的屏障,从而导致眼内炎症[7]。
EE的临床表现缺乏特异性,通常急性起病,最常见的全身症状为发热,眼部症状常表现为视力下降、眼红以及疼痛等不适,眼内表现通常是弥漫性炎症[8]。需要注意的是,患者临床表现及眼内炎症的类型,对确认病原微生物具有一定指导意义[9]。当怀疑高毒力KP感染患者时,应密切关注患者的体温变化,当有新的转移性感染灶出现时,往往伴随发热症状。本研究纳入的KPLA继发EE患者在就诊前5~10 d均出现不同程度的发热。此时应积极寻找新感染灶并进行及时有效处理。
EE的早期诊断和及时有效治疗对挽救视力至关重要[10-11]。研究表明,一旦KP侵入眼内,便会导致视网膜光感受器细胞在12 h内发生不可逆损伤[12]。但由于EE患者常伴有严重的全身系统疾病,眼部症状相对于全身表现较轻,往往容易被忽视而延误诊治。在收集的6例EE患者中,有3例患者因糖尿病、感染性休克、低蛋白血症等全身性疾病分别首诊于非眼科科室,早先出现的视力下降、眼红、眼痛等眼部症状易被忽视,致使到眼科就诊时眼内炎症已十分严重,尽管进行了眼内注射敏感抗生素或联合玻璃体切除治疗最终也无法挽回视力,甚至需剜除眼内容物以控制炎症扩散。
细菌培养及药物敏感性试验为EE的诊断和治疗提供了金标准,但普通细菌培养时间较长,且当细菌计数较低或患者接受抗生素治疗后,培养阳性率将下降[13],可能会导致误诊或延诊。在未确定病原菌前,为防止眼内炎症进一步加重,应经验性应用抗生素积极治疗。以往研究表明,头孢菌素、碳青霉烯类和氟喹诺酮类等抗生素对治疗KP有效,而万古霉素对革兰阴性菌无抗菌活性[14],这也与本研究患者的药敏试验结果基本一致。因此,在EE患者的病原学结果未出之前,可选用以头孢他啶为代表的三代头孢菌素和以亚胺培南为代表的碳青霉烯类抗生素进行经验性治疗,后依照药敏试验结果及时调整为合适的抗生素。除KP以外,表皮葡萄球菌、铜绿假单胞菌、金黄色葡萄球菌等也是常见的EE致病菌[15]。几乎所有的EE患者都会出现不同程度的眼痛、视力下降症状,并伴有发热等全身表现,仅从临床表现很难确认致病菌的种类。但KP同时引起肺炎和EE的概率较其他菌种更高,肝脓肿继发的EE病情进展更为迅速[16]。在临床工作中,医生虽然可以根据患者的病史与体征作出一定的推断并经验性选用抗生素,但也应及时进行眼内液培养及药敏试验,尽早更换敏感性抗生素。
总之,对于KP所致的侵袭性感染性疾病,病情进展快,且在疾病早期易发生转移性扩散,预后相对较差。造成上述现象的原因主要包括以下几方面:①宿主本身存在导致免疫功能下降的疾病,如本次观察到的6例感染性眼内炎的病人存在糖尿病、严重的感染、化疗术后等不良全身情况,其中合并糖尿病者居多。②所有患者就诊时均出现视力下降,即眼部症状出现至眼科确诊时间长,导致就诊时眼部感染难以控制。③不同时期、不同区域的致病菌谱以及病原体对抗生素的敏感性有明显的差异[17],并且抗生素使用方式不规范,导致耐药菌株的出现。目前有报道指出,已经出现耐碳青霉烯类、产ESBL高毒力肺克菌株等耐药患者的报道[18],同时由于血-视网膜屏障的存在,抗菌药物无法在眼内达到有效抑菌浓度[19]。
综上所述,EE是一种严重的眼部感染性疾病,虽发病率低,但进展迅速,预后差。正确的早期诊断对于EE患者的治疗和预后至关重要,我们建议外科医生在诊断和治疗肝脓肿患者时应注意患者眼部的症状,特别是对于肝脓肿合并全身原发性或继发性免疫受损疾病患者,如糖尿病、化疗术后等,当出现发热等全身症状或视力下降、眼红、眼痛等眼部不适时,应建议患者立即去眼科门诊就诊并定期随诊,以警惕眼内炎的发生。
伦理批准和知情同意:本研究涉及的所有试验均已通过青岛大学附属医院医学伦理委员会的审核批准(文件号QYFYWZLL27776)。所有试验过程均遵照《赫尔辛基宣言》的条例进行。受试对象或其亲属已经签署知情同意书。
作者声明:李清华、刘桂波、尹晓妮、何宏、陈秋卢、段凝、魏向阳参与了研究设计;李清华、李瑛、杜兆东参与了论文的写作和修改。所有作者均阅读并同意发表该论文,且均声明不存在利益冲突。
[参考文献]
[1]TIECCO G, LAURENDA D, MUL A, et al. Gram-negative endogenous endophthalmitis: A systematic review[J]. Mic-roorganisms, 2022,11(1):80.
[2]陈薇,杨春凤,曹阳,等. 肺炎克雷伯菌肝脓肿发病危险因素及致病菌耐药性分析[J]. 中华传染病杂志, 2018,36(10):630-634.
[3]HUSSAIN I, ISHRAT S, HO D C W, et al. Endogenous endophthalmitis in Klebsiella pneumoniae pyogenic liver abscess: Systematic review and meta-analysis[J]. Int J Infect Dis, 2020,101:259-268.
[4]WADHWANI M, MISHRA S K, MANIKA M, et al. Metastatic endophthalmitis——Has the trend of causative organism changed in the modern antibiotic era——A systematic review[J]. Rom J Ophthalmol, 2020,64(2):105-115.
[5]周佳,沈玺. 内源性肺炎克雷伯杆菌性眼内炎七例[J]. 中华眼底病杂志, 2018,34(3):272-274.
[6]NAMIKAWA H, OINUMA K I, YAMADA K, et al. Predictors of hypervirulent Klebsiella pneumoniae infections: A systematic review and meta-analysis[J]. J Hosp Infect, 2023,134:153-160.
[7]COBURN P S, WISKUR B J, CHRISTY E, et al. The diabetic ocular environment facilitates the development of endogenous bacterial endophthalmitis[J]. Invest Ophthalmol Vis Sci, 2012,53(12):7426-7431.
[8]TEWELDEMEDHIN M, GEBREYESUS H, ATSBAHA A H, et al. Bacterial profile of ocular infections: A systematic review[J]. BMC Ophthalmol, 2017,17(1):212.
[9]DURAND M L. Bacterial and fungal endophthalmitis[J]. Clin Microbiol Rev, 2017,30(3):597-613.
[10]吴永云,李晓梅,赵正华,等. 肺炎克雷伯杆菌侵袭性感染典型病例1例并文献复习[J]. 泰山医学院学报, 2020,41(11):870-871.
[11]FUJITA M, TAKAHASHI A, IMAIZUMI H, et al. Endogenous endophthalmitis associated with pyogenic liver abscess caused by Klebsiella pneumoniae[J]. Intern Med, 2019,58(17):2507-2514.
[12]WISKUR B J, HUNT J J, CALLEGAN M C. Hypermucoviscosity as a virulence factor in experimental Klebsiella pneumoniae endophthalmitis[J]. Invest Ophthalmol Vis Sci, 2008,49(11):4931-4938.
[13]JOSEPH J, SONTAM B, GUDA S J M, et al. Trends in microbiological spectrum of endophthalmitis at a single tertiary care ophthalmic hospital in India: A review of 25 years[J]. Eye (Lond), 2019,33(7):1090-1095.
[14]吴柳,张洁,孙琳,等. 肺炎克雷伯菌肝脓肿70例临床分析[J]. 中国感染与化疗杂志, 2018,18(1):11-17.
[15]BISPO P J M, SAHM D F, ASBELL P A. A systematic review of multi-decade antibiotic resistance data for ocular bacterial pathogens in the United States[J]. Ophthalmol Ther, 2022,11(2):503-520.
[16]王峰,陶勇,孙兵,等. 肺炎克雷伯杆菌肺炎并发内源性眼内炎三例并文献复习[J]. 中华结核和呼吸杂志, 2019,42(6):438-443.
[17]LIU C H, JI J, LI S J, et al. Microbiological isolates and antibiotic susceptibilities: A 10-year review of culture-proven endophthalmitis cases[J]. Curr Eye Res, 2017,42(3):443-447.
[18]SHARIATI A, DADASHI M, CHEGINI Z, et al. The global prevalence of Daptomycin, Tigecycline, Quinupristin/Dalfopristin, and Linezolid-resistant Staphylococcus aureus and coagulase-negative staphylococci strains: A systematic review and meta-analysis[J]. Antimicrob Resist Infect Control, 2020,9(1):56.
[19]毛春洁,田强,由彩云,等. 10例内源性细菌性眼内炎患眼临床特征观察[J]. 中华眼底病杂志, 2017,33(2):162-165.
(本文编辑 范睿心 厉建强)



