(青岛大学附属医院,山东 青岛 266003 1 病理科; 2 乳腺中心)
乳癌是女性常见的恶性肿瘤之一,严重危害广大女性的身心健康及生命安全。近年来,社会健康教育得到普及,大众健康查体意识提高,加上疾病诊断水平不断提高,使乳腺导管原位癌(DCIS)的检出率越来越高[1]。乳腺DCIS被普遍认为是乳腺浸润性导管癌(IDC)的癌前病变,但人们对乳腺DCIS的生物学行为及临床特征的认识仍然不足。乳腺DCIS具有发展为IDC的趋势,但临床实践证明,并不是所有的乳腺DCIS都会进展为IDC。在乳腺DCIS进展为IDC的过程中生物学状态发生了怎样的变化,什么类型的生物学状态更易促进这一进展过程,成为了近年来研究的热点[2]。因此,本研究希望通过检测相关生物学指标在DCIS及IDC中的表达情况来进一步了解此过程,并试图寻找乳腺DCIS进展为IDC的预测因子,从而指导临床对乳腺DCIS病人进行预后评估及制定合理的个体化治疗方案,使乳腺DCIS的治疗更加规范化、合理化、个体化,达到同病异治的精准医疗目的。
1 材料与方法
1.1 材料来源
收集2011年1月—2016年1月我院确诊为乳癌病人的标本600例,包括乳腺单纯DCIS标本300例,乳腺DCIS伴IDC标本300例。病人均为女性,术前未进行任何治疗。
1.2 研究方法
分别对乳腺DCIS伴IDC中的两部分(分别简称为DCIS部分以及IDC部分),乳腺单纯DCIS以及IDC部分的雌激素受体(ER)、孕激素受体(PR)、人表皮生长因子受体2(Her-2)以及细胞增殖指数(Ki-67)进行比较。
1.2.1免疫组织化学染色 ER(1∶200)、PR(1∶200)、Her-2(1∶200)及Ki-67(1∶150)抗体均为兔抗人单克隆抗体。采用PV-9000染色系统检测乳癌组织中以上指标的表达。以已知阳性乳癌组织切片作阳性对照,PBS缓冲液代替一抗作为阴性对照。抗体和辅助试剂均购于北京中杉金桥生物技术有限公司。
1.2.2荧光原位杂交法(FISH)检测 采用Her-2基因检测试剂盒检测600例标本Her-2基因的表达,检测试剂盒购于广州安必平医药科技股份有限公司。
1.3 结果判定标准
1.3.1免疫组化结果判断标准 参照相关文献报道的标准[3-4]。ER、PR均以≥1%癌细胞核着色为阳性。Ki-67阳性染色定位于细胞核,在高倍镜下计数≥500个癌细胞,不考虑其着色强度,根据阳性细胞所占比例进行判断,<14%为阴性,≥14%为阳性。Her-2的判断标准依据2013年10月更新的美国临床肿瘤学会/美国病理医师学会临床实践指南中的标准。
1.3.2FISH检测评分标准 对所有600例标本的Her-2均进行FISH双探针检测,评分标准参考第2版《乳腺疾病病理彩色图谱》中的标准。
1.4 统计学分析
应用SPSS 21.0软件进行统计学分析,计数资料比较采用χ2检验,P<0.05表示差异有统计学意义。
2 结 果
2.1 乳腺DCIS部分与IDC部分生物学指标比较
乳腺DCIS部分与IDC部分比较,ER、PR阳性表达差异无显着性(P>0.05);DCIS部分Her-2阳性表达高于IDC部分,Ki-67阳性表达低于IDC部分,差异有统计学意义(P<0.05)。见表1。
2.2 乳腺单纯DCIS与IDC部分生物学指标比较
乳腺单纯DCIS与IDC部分的ER、PR、Her-2阳性表达差异无显着性(P>0.05),Ki-67阳性表达差异有显着性(P<0.05)。见表2。
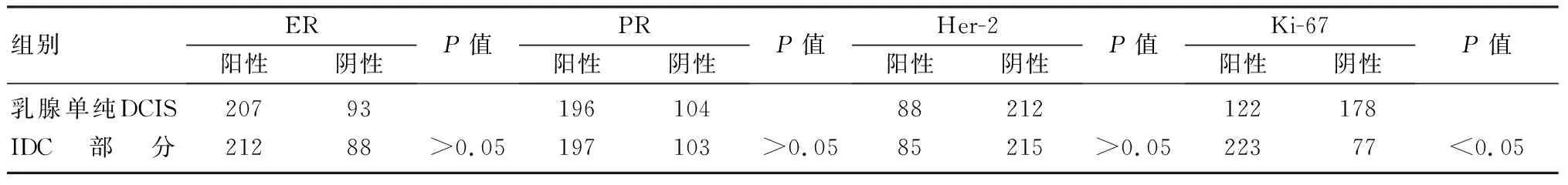
表2 两组ER、PR、Her-2和Ki-67表达的比较(n=300,例)
3 讨 论
乳癌是女性发病率较高的癌症之一,已成为严重威胁女性生命健康的主要疾病。近年来,早期乳癌特别是乳腺DCIS的检出率逐渐升高。目前对DCIS生物学特征、发生发展规律及治疗手段的研究已成为乳腺肿瘤领域的研究热点[1-2]。由于人们对乳腺DCIS的认识还不够,对其自然病史还不清楚,临床上其治疗主要以手术切除乳腺为主,然而随着对乳腺DCIS认识的不断深入,发现有些DCIS一生都不会进展为IDC;同时乳癌的发病率逐渐年轻化,千篇一律地手术切除乳腺无疑给病人身心健康带来严重影响[5-6]。因此探索乳腺DCIS进展的预测因子及为病人制定个体化的治疗方案已成为当前迫切的需要。
在临床实践中,ER、PR、Her-2和Ki-67已成为乳癌病人的常规检测项目,准确检测这些生物学指标对病人的预后评估及治疗方案选择具有重要作用[7]。众所周知,根据ER、PR、Her-2、Ki-67等生物学指标的表达情况,可将浸润性乳癌分为Luminal A、Luminal B、HER2(+)及Basal-like 4种分子分型,临床上常根据病人的不同分子分型制定个体化治疗方案[7-8],但其在乳腺DCIS中的应用仍在进一步探索中[9]。有关报道将乳腺DCIS按照生物学指标表达情况,同样分为4种分子分型[10-12],是否能将这些生物学指标应用于乳腺DCIS现在还没有一致的看法[10]。
本研究结果显示,乳腺DCIS部分与IDC部分相比,ER、PR阳性表达差异无显着性;乳腺单纯DCIS与IDC部分相比,ER、PR、Her-2差异均无显着性。两组结果不同,可能与入组的单纯DCIS取材块数和受制片的限制存在微浸润有关。
有研究显示,Her-2在32%~55%的DCIS中呈阳性[13]。本研究结果显示,Her-2在乳腺DCIS部分中的阳性率为37.3%,在乳腺单纯DCIS中的阳性率为29.3%。由于乳腺DCIS伴IDC病例组属于自身对照,影响的因素更少,因此,乳腺DCIS部分与IDC部分Her-2相比较的结果更加可靠,即DCIS和IDC的Her-2表达可能存在显着差异。
NSABP B-24试验研究显示,对乳腺DCIS病人进行内分泌治疗,ER阳性的DCIS可以从中获益,并且其治疗效果与乳腺IDC一致[14-15]。此结果与本研究中乳腺DCIS部分与IDC部分ER、PR阳性表达差异无显着性的研究结果是相符合的。
Her-2是与乳癌发生发展密切相关的基因,是预测和判断乳癌预后的独立性指标[16],对乳癌的预后评估及治疗指导具有重要的价值。Her-2基因参与癌细胞生长、增殖及分化的调控,Her-2阳性的乳癌其癌细胞分裂增殖速度快,癌细胞间黏附力减小,更易浸润、扩散及转移。随着基因组学的不断发展,Her-2基因在乳癌中的作用逐渐被认识,相关的研究和治疗开始备受关注。Her-2过表达被认为是乳癌预后不良的指标,并可用于指导临床靶向药物赫赛汀的使用[17]。
研究表明,Her-2过表达与保乳术后的局部复发和进展为IDC的趋势有一定的关系;Her-2基因过表达在DCIS特别是粉刺型DCIS中明显高于IDC[18-19]。本研究中乳腺DCIS部分Her-2过表达率为37.3%,IDC部分Her-2过表达率为28.3%,Her-2基因在DCIS部分中过表达率比在IDC部分中过表达率明显增高;乳腺单纯DCIS中Her-2过表达率为29.3%。这一结果表明Her-2基因过表达可能是乳腺DCIS向IDC进展的预测因子,应该对Her-2过表达的DCIS进行提前干预,阻止其进展。
目前Her-2基因在乳腺DCIS与乳腺DCIS伴IDC中表达的比较还很少有报道,Her-2过表达是否参与了乳腺DCIS的进展过程尚未有足够的证据[19-22]。Her-2过表达的乳癌病人术后给予靶向药物赫赛汀进行治疗,病人可从中获益,但是否能将靶向药物应用于乳腺DCIS目前还没有足够的证据。SIZIOPIKOU等[23]开展的NSABP B-43 III期临床试验对Her-2过表达的乳腺DCIS病人进行靶向药物治疗,预期加用靶向药物能够降低约36%的复发风险,远期效果正在随访中,初步结果预计在2019年公布。
Ki-67定位于第10号染色体上,能够识别增殖期细胞核基质内的核蛋白,其功能与细胞有丝分裂有关[24],可在有丝分裂过程中维持DNA的稳定性,被用来评估癌细胞的增殖率、生物学行为,是癌进展、转移、预后的一项重要生物学指标。Ki-67是乳癌进展的一项重要指标,其高表达预示病人的预后不良。本研究中无论是乳腺单纯DCIS还是乳腺DCIS部分的Ki-67阳性表达均低于IDC部分。这说明早期发现、早期诊断、早期治疗对乳癌病人是非常重要的,对乳癌病人进行规范化、个体化的综合治疗,是可以阻断乳癌进展的。
有研究表明,对生物学指标ER、PR、Her-2、Ki-67的检测,在预测乳腺DCIS局部切除术后乳癌复发方面具有一定的价值[25-28]。因此可以根据生物学指标表达的情况将病人分为高、低危险度两类,并指导临床制定合理的个体化治疗方案,使低度危险者避免不必要的过度治疗,使高度险者得到及时有效的治疗。
综上所述,乳腺DCIS和IDC生物学指标表达既有一致性又有差异性,检测这些指标可能为研究乳腺DCIS自然病史及挖掘新的治疗方法提供一定的证据,并可使乳腺DCIS的治疗更加规范化、合理化、个体化,真正做到同病异治的精准医疗。



