童宇轩,杨志惠,汪少华
(西南医科大学附属医院病理科,四川 泸州 646000)
exosomes是直径约为3~100 nm的小囊泡,不同来源的活细胞均可分泌[1-3]。其中,肿瘤细胞来源的exosomes包含许多肿瘤相关的抗原,如TSG101、Alix、Hsp60、Hsp70、Hsp90和CD9等免疫分子,其可以诱导产生特异性免疫反应,起到抑制肿瘤的作用[4]。肿瘤细胞也能分泌exosomes瘤苗,并诱导特异性免疫效应,其抗肿瘤作用已在老鼠和人身上得到证实[5],但腹水来源的exosomes是否也可作为肿瘤疫苗诱导特异性T细胞反应、抑制肿瘤生长尚不明确。因此,本研究首先通过超速离心分别获得腹水来源的exosomes和小鼠肝癌细胞H22来源的exosomes,然后在小鼠肝癌皮下移植瘤模型体内探索exosomes作为肿瘤疫苗激活机体的抗肿瘤免疫效应的价值,现报道如下。
1 材料与方法
1.1 细胞株及动物 小鼠肝癌H22细胞株由重庆医科大学干细胞与组织工程研究室惠赠,本室复苏后保存。6~8周龄的BALB/c小鼠(18±2)g购于重庆医科大学的医学实验动物中心,饲养环境:温度(25±2)℃,湿度(50±10)%,12 h 明暗交替。本研究通过动物伦理审批。
1.2 试剂 胎牛血清(中国杭州四季青生物医学公司);RPMI1640培养基(美国GIBCO公司);小鼠淋巴细胞分离液(中国天津TBD生物公司);小鼠血清IL-2和INF-γ的ELISA检测试剂盒(中国广州晶美生物医学公司);四甲基偶氮唑蓝(MTT)(美国Sigma公司)。
1.3 实验仪器 倒置显微镜(日本Nikon);精密电子天平(中国北京塞多利斯仪器厂JA5003型);CO2培养箱(美国NURARE);无菌超净工作台(中国苏州净化公司);LTP-C型离心涂片机(中国北京四环科学仪器厂);台式低温高速离心机(德国Heareus,Biofuge 15R型)。
1.4 方法
1.4.1细胞培养 取出液氮冻存的小鼠腹水型肝癌细胞株H22细胞,于37 ℃按步骤进行细胞复苏,加入培养液,放置于5% CO2、37 ℃、饱和湿度的培养箱中常规进行半开口的单层细胞培养。
1.4.2腹水瘤动物模型的建立 首先将H22细胞系按照常规细胞培养的方式培养、传代,取其对数生长期的细胞台盼蓝染色,于显微镜下计数细胞。取0.2 ml(约含1×108个瘤细胞)在无菌条件下,分别注射进6~8周的BALB/c小鼠腹腔内,接种后给予常规饮水饮食。
1.4.3 腹 水 和H 2 2 细 胞 来 源e x o s o m e s 的 制 备BALB/c小鼠通过腹腔注射接种H22细胞,腹腔内生长1周后,腹水生长旺盛,小鼠腹胀明显,使用10 ml的注射器吸取腹水。操作在无菌台进行,抽腹水前后使用75%酒精消毒穿刺点附近皮肤。采用文献[5]所述方法将抽取腹水按照超速离心法提取exosomes。然后,采用低温超速分级离心和蔗糖密度梯度离心法纯化提取H22细胞培养上清中的exosomes瘤苗。
1.4.4皮下移植瘤动物模型的建立 BALB/c小鼠H22细胞腹水瘤模型成功构建1周后,腹水明显,抽取腹水。用台盼蓝染色后,于显微镜下行腹水H22细胞计数。参照文献使用无菌生理盐水稀释H22细胞,调整H22浓度为5×l06个/ml,然后每只小鼠右腋皮下注射接种H22细胞0.2 ml,从而构建小鼠H22细胞皮下移植瘤模型。
1.4.5exosomes在移植瘤模型中的治疗 构建小鼠H22细胞皮下移植瘤模型的当天,研究使用随机的方法将18只小鼠分为腹水来源exosomes组、H22细胞系来源exosomes组、对照组,每组6只。腹水来源exosomes组:H22细胞接种当天,在每只小鼠左后肢根部皮下接种腹水来源exosomes(10 µg/只),共给予3次,隔天一次;H22细胞系来源exosomes组:在小鼠左后肢根部皮下注射H22细胞系来源exosomes(10 µg/只),共给予3次,隔天一次;对照组:注入等量PBS。所有小鼠在接种H22细胞后的第15天处死,并且观察各项实验指标。
1.4.6肿瘤抑制率计算 小鼠处死后,完整取出肿瘤瘤体,充分剥离干净,再用滤纸拭去血污,用电子天平称取瘤体重量,按文献[7]所述方法计算抑瘤率。抑瘤率=(1-实验组瘤重/对照组瘤重)×100%。
1.4.7脾脏和胸腺指数的检测 小鼠处死后,无菌条件完整取出脾脏和胸腺后电子天平称重,参考文献[5]的方法,计算脾脏指数和胸腺指数。小鼠脾(胸腺)指数=脾(胸腺)重量/体重(mg/g)。
1.4.8 MTT法检测脾淋巴细胞增殖能力 参考文献[8],在无菌条件下迅速分离脾出淋巴细胞,将1×l05个/ml的淋巴细胞悬液加入96孔平底培养板中,200 µl/孔,各组再加入100 µg/ml ConA溶液,5 µl/孔,用MTT法检测检测脾淋巴细胞增殖活性。阴性细胞对照组200 µl细胞悬液/孔+5 µlRPMI-1640培养液,空白对照组每孔加入205 µl RPMI-1640培养液,每组均设有3个复孔。放置于37 ℃,5% CO2孵箱中继续培养24 h,加入MTT(5 mg/ml),20 µl/孔,将培养板置于孵箱中再培养4 h后,取出离心,小心吸去上清,加二甲亚砜(DMSO)200 µl,在摇床上震荡溶解10 min,用酶标仪波长570 nm检测每孔吸光度(A)值。所有实验重复3次。计算公式:刺激指数(stimulation index,SI)=实验组A值/阴性细胞对照组A值。刺激指数用来表示淋巴细胞的增殖活性。
1.4.9脾淋巴细胞杀伤实验检测 将H22细胞调整密度至1×l06个/ml,作为靶细胞,以小鼠脾淋巴细胞为效应细胞,在96孔板中按效应细胞/靶细胞为20∶1、40∶1、80∶1,分别加入100 µl效应细胞和100 µl靶细胞为实验组,每组均设3个复孔,同时设效应细胞对照组、靶细胞对照组,将培养板置于37℃,5% CO2孵箱中孵育12 h后,用MTT法在酶标仪波长为570 nm检测每孔吸光度(A)值。所有实验重复3次。杀伤率计算公式(%)=[1-(实验组A值-效应细胞A值)/靶细胞对照组A值]×100%。
1.4.10 ELISA法检测血清中细胞因子的变化 各组小鼠处死前先用4%的水合氯醛腹腔麻醉,用摘眼球的方式获取外周血0.6 ml,无需抗凝,3000 rpm/30 min,获得血清标本,应用ELISA试剂盒测定血清中IL-2和INF-γ分泌水平。ELISA法检测步骤严格按照说明书的要求进行。
1.5 统计学方法 采用SPSS 13.0统计学软件进行数据分析。计量资料以(±s)表示,采用t检验或F检验;以P<0.05表示差异有统计学意义。
2 结果
2.1 三组瘤体质量比较 经exosomes瘤苗治疗后H22细胞株移植瘤生长明显受到抑制;腹水来源exosomes组、H22细胞系来源exosomes组瘤体质量高于对照组(P<0.05),见表1。
表1 三组瘤体质量比较( ±s,g)
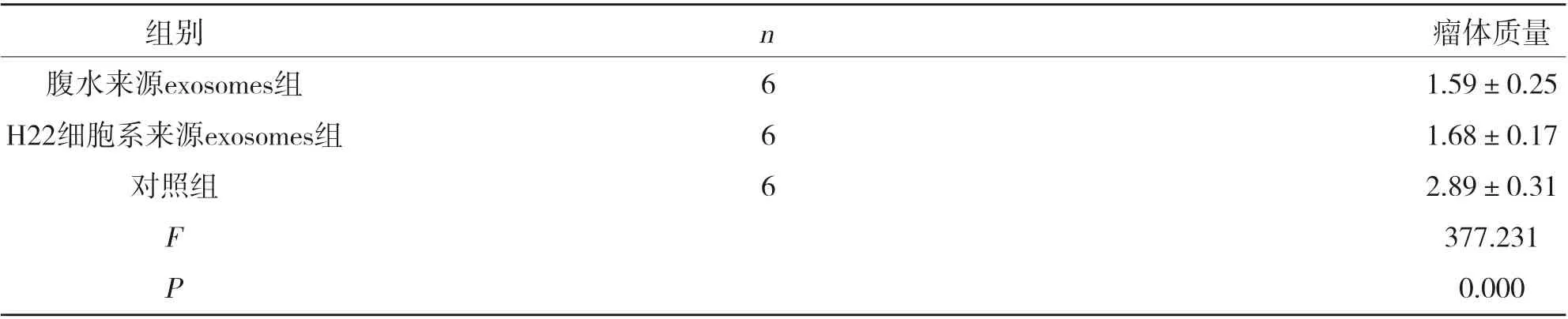
表1 三组瘤体质量比较( ±s,g)
组别腹水来源exosomes组H22细胞系来源exosomes组对照组FP瘤体质量1.59±0.25 1.68±0.17 2.89±0.31 377.231 0.000 n666
2.2 三组脾淋巴细胞增殖活性比较 腹水来源exosomes组、H22细胞系来源exosomes组SI大于对照组(P<0.05),见表2。
表2 三组脾淋巴细胞增殖活性比较(±s )

表2 三组脾淋巴细胞增殖活性比较(±s )
组别腹水来源exosomes组H22细胞系来源exosomes组对照组n666 FP SI 4.19±0.31 3.28±0.27 2.29±0.25 258.354 0.000
2.3 三组小鼠脾脏和胸腺指数比较 腹水来源exosomes组、H22细胞系来源exosomes组脾脏指数和胸腺指数高于对照组(P<0.05),见表3。
表3 三组小鼠脾脏和胸腺指数比较( ±s,mg/g)

表3 三组小鼠脾脏和胸腺指数比较( ±s,mg/g)
组别腹水来源exosomes组H22细胞系来源exosomes组对照组n666 FP脾脏指数11.04±0.39 9.84±0.86 7.28±0.67 192.379 0.000胸腺指数5.76±0.45 3.31±0.63 1.82±0.30 267.622 0.000
2.4 三组脾淋巴细胞杀伤活性比较 小鼠脾细胞细胞毒活性随效靶比的上升而逐渐提高,腹水来源exosomes组、H22细胞系来源exosomes组20∶1、40∶1和80∶1脾淋巴细胞杀伤活性大于对照组(P<0.05),见表4。
表4 三组脾淋巴细胞杀伤活性比较( ±s,%)
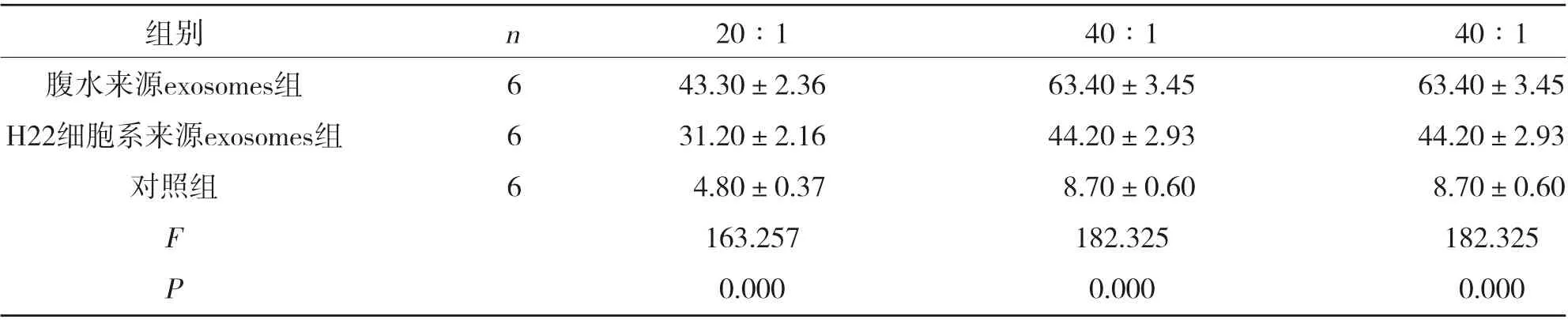
表4 三组脾淋巴细胞杀伤活性比较( ±s,%)
组别腹水来源exosomes组H22细胞系来源exosomes组对照组n666 20∶1 43.30±2.36 31.20±2.16 40∶1 63.40±3.45 44.20±2.93 40∶1 63.40±3.45 44.20±2.93 FP 4.80±0.37 163.257 0.000 8.70±0.60 182.325 0.000 8.70±0.60 182.325 0.000
2.5 三组血清IL-12、INF-γ水平比较 腹水来源exosomes组、H22细胞系来源exosomes组IL-2、INF-γ水平高于对照组(P<0.05),见表5。
表5 三组血清IL-12、INF-γ水平比较( ±s,pg/ml)

表5 三组血清IL-12、INF-γ水平比较( ±s,pg/ml)
组别腹水来源exosomes组H22细胞系来源exosomes组对照组n666 FP IL-12 386.42±35.52 261.19±22.87 131.98±16.28 289.751 0.000 INF-γ 93.48±15.92 72.69±13.27 32.54±10.21 176.852 0.000
3 讨论
肝癌致死率较高,尤其在我国每年因肝癌致死的人数大约占全世界肝癌死亡总数的51%[9,10],特别是晚期肝癌预后极差,且大部分常规治疗方式无效[11]。近年来随着精准医学的发展,肝细胞癌的免疫治疗越来越受到关注,肿瘤疫苗是近年研究的热点之一[12-14]。肿瘤细胞来源的exosomes瘤苗是肿瘤细胞分泌的一种小囊泡,其拥有肿瘤共同抗原,并含有大量的热休克蛋白(heat-shock proteins,HSP)70~90、MHCI类分子等重要抗肿瘤免疫因子,有望成为一种新的亚细胞瘤苗[15,16]。本研究分别从肝癌腹水和小鼠肝癌H22细胞系中分离exosomes瘤苗治疗小鼠H22移植瘤,通过比较不同来源exosomes对小鼠免疫功能及H22细胞皮下移植瘤生长的影响,结果发现肝癌腹水和小鼠肝癌H22细胞系中分离exosomes瘤苗均能增强小鼠的免疫功能,产生一定的抗肿瘤活性。
抗肿瘤免疫是一个由各种相互影响的分子构成的复杂的网络,通过免疫应答反应杀伤肿瘤细胞或通过分泌IL-2、INF-γ等细胞因子来增强CTL活性起抑制肿瘤生长的作用[17]。本实验通过检测exosomes瘤苗对荷瘤小鼠脾脏和胸腺增殖能力、脾脏淋巴细胞增殖活性、脾脏淋巴细胞对H22细胞的杀伤活性以及血清中IL-2和INF-γ水平的影响,基本上可以反映出exosomes瘤苗产生的抗肿瘤免疫反应。脾是人体产生免疫反应的主要基地,而胸腺是CD4+T淋巴细胞分化以及发育的主要基地。本实验结果显示,exosomes瘤苗不但提升了小鼠的脾脏和胸腺指数,而且促进了脾淋巴细胞增殖活性及杀伤活性。课题组前期研究已证实[18],H22细胞株中分离exosomes瘤苗能通过增强小鼠免疫功能,从而抑制移植瘤的生长,而本研究结果进一步说明肿瘤腹水来源exosomes瘤苗的抗肿瘤免疫效应更强。IL-2在抗肿瘤免疫反应中发挥重要作用,其能促进T细胞增殖并增强其活性、激活LAK细胞对肿瘤的杀伤作用、诱导B细胞增殖及分泌抗体、激活NK细胞从而增强抗肿瘤免疫作用[19];INF-γ通常由活化的T细胞和NK细胞产生,它激活机体的抗肿瘤免疫反应,起到使实体瘤的生长受抑制的效应[20,21]。本研究结果表明,exosomes瘤苗促进血清中IL-2和INF-γ水平增高,且肝癌腹水来源的exosomes瘤苗组小鼠血清中IL-2和INF-γ含量更高,说明肝癌腹水来源的exosomes瘤苗也可以通过增强机体抗肿瘤免疫功能,从而发挥较强的抗肿瘤效应。
综上所述,不同来源的exosomes在抗肿瘤免疫反应中均发挥了重要作用,腹水来源的exosomes激活机体免疫系统后,能产生更强的抗肿瘤免疫效应。众所周知,肿瘤往往采用的是多种手段的联合治疗,肿瘤疫苗是未来探索和发展的方向之一,然而单一肿瘤疫苗本身诱导的免疫作用有限,还需探寻更多更好的分子生物医学技术,来增强exosomes诱导的CTL活性,从而发挥更强的抗肿瘤效应。



