余 健 聂国明 齐曼丽 邹敏书 李 琳 罗莉漫 徐洪涛 丁冬胜
Wnt信号通路因其启动蛋白Wnt而得名,其中Wnt/β-连环蛋白(catenin)信号通路为经典的信号转导途径:Wnt蛋白与其受体复合体结合,导致胞内蛋白β-catenin活化,并转位到核内,从而改变目的基因的表达,此信号通路在器官的发育、心血管疾病及肿瘤等起调控作用[1,2]。近年来,Wnt/β - catenin在肾脏疾病调控作用日渐受到重视,可诱导间质上皮转化(EMT)、肾纤维化的发生发展,成为抗肾纤维化治疗的靶点之一[3]。
骨形态发生蛋白(BMP-7)是转化生长因子-β(TGF-β)超家族成员之一,它在胚胎肾脏的发育以及成体肾脏功能的维持上具用重要作用。与TGF-β1诱导足细胞凋亡及促进肾纤维化作用相反,BMP-7是重要的足细胞存活因子及抗纤维化因子[4、5]。足细胞位于肾小球滤过屏障的最外层,主要防止血浆蛋白的滤出,BMP-7可通过激活Smad1/5/8信号通路并抑制TGF-β/Smad2/3信号通路从而减轻足细胞损伤[6]。BMP-7对 Wnt1/β -catenin信号通路的影响尚不清楚。为此,本研究探讨BMP-7对Wnt1/β-catenin信号通路的调节作用。
材料与方法
1.动物模型的制备:清洁级雄性Sprague-Dawley大鼠,约2月龄,体质量200±20g,购自武汉总医院动物实验中心[动物合格证号为SYXK(鄂)2008-0007]。采用1次性尾静脉注射嘌呤霉素氨基核苷酸100mg/kg诱导PAN模型[7]。大鼠首次给药后2周尿蛋白相对稳定时确认PAN模型制备成功。将20只PAN模型鼠随机分为两组:①PAN组(n=10);②BMP治疗组(BMP,n=10):自造模成功之日起,每周2次腹腔注射人重组BMP-7 30微克/(千克·次)[8]。正常组(NC,n=10)及PAN组给予等量的生理盐水注射,每周2次。各组共治疗10周。12周末实验结束时,异戊巴比妥腹腔注射麻醉大鼠,取肾皮质甲醛固定、脱水、石蜡包埋备用。嘌呤霉素氨基核苷酸购自美国Sigma公司,人重组BMP-7购自美国Curis公司。
2.尿液指标测定:处死鼠前收集24h尿液标本,在1800r/min离心5min。随机选择20个高倍视野(×400)进行红细胞计数,结果用每个视野平均红细胞数表示;24h尿蛋白用双缩脲法测定。
3.血清指标测定:ELISA法测定血清 Cys C、MIF浓度。Cys C试剂盒购自上海德波生物技术公司。MIF试剂盒购自Gibco BRL公司。
4.RT-PCR检测肾小球Wnt1、β-catenin mRNA的表达:肾皮质剪成1mm3左右的碎片,加胶原酶A(1mg/ml),放入水平摇床中,轻轻摇动,37℃消化30min,后转入100μm的筛网中,轻轻辗磨挤压分离肾小球,PBS洗3次,备用。依据生产商(美国Invitrogen公司)操作说明,应用TRIzol RNA系统提取总的RNA。应用反转录酶试剂盒按说明合成cDNA第一链,以cDNA第一链为模板在TaqDNA聚合酶作用下进行PCR扩增。利用Primers软件设计引物,引物序列如下:①Wnt1:正义5'-GAA CCT GCT TACAGA CTCCAA GAGT -3',反义5'-CCG GAT TTT GGCTAT CAG A -3',产物长度为98bp;②β-catenin引物:正义5'-GTCAGCTCGTGT CCT GTG AA-3',反义:5'- AGT GGCTGA CAG CAG CTT TT -3',扩增产物片段为150bp;③GAPDH引物为:正义5'-ATT CGG ACG CCT GGT TAC-3',反义5'-CTG TGC CGT TGA ACT TGC -3',扩增片段为180bp;扩增条件为:预变性94℃ 3min,进入循环,变性95℃ 15s,退火 54℃ 80s,延伸72℃ 60s,32 个循环后72℃ 8min。将PCR产物在1.5%琼脂糖凝胶中进行电泳,置于凝胶图像分析系统(UVP公司,美国)行吸光度扫描,用目的基因的吸光度与GAPDH吸光度的比值代表目的基因的相对表达含量。
5.蛋白印迹测定肾小球Wnt1、β-catenin蛋白的表达:按上述方法分离肾小球,取100mg溶解于细胞裂解液中(25 mmol/L Tris - HCl,150mmol/L NaCl,10mmol/L EDTA,0.2mmol/L PMSF,1%Triton X -100,冰浴 1h,4℃ 12000r/min离心15min,抽提细胞总蛋白,Lowry法测定蛋白浓度。取细胞裂解蛋白50μg经Tricine SDS凝胶电泳后转移至PVDF膜;5%脱奶粉封闭PVDF膜2h,加入羊抗Wnt1、兔抗catenin多克隆一抗。4℃过夜,洗膜后加辣根过氧化物标记的二抗(1∶500稀释),37℃孵育2h;洗膜后加ECL试剂,显色后,用凝胶成像及分析系统对条带进行定量分析。Wnt1、β-catenin蛋白相对含量用GAPDH作为内参。
6.统计学方法:采用SPSS11.0软件进行数据处理,所有数据用表示,方差齐时,多组比较用One-way ANOVA LSD方差分析;方差不齐,多组比较用Kruskal-Wallis方法,两组间比较用Mann-Whitney方法,p<0.05为差异有统计学意义。
结 果
1.尿液及血清指标检测:PAN组尿液红细胞(UE)及24h尿蛋白(24h UP)的排泄较NC组显着升高(p<0.01);血清 Cys C 较 NC 组亦显着升高(P <0.01),MIC升高(p<0.05),差异有统计学意义。BMP-6组UE及24h UP的排泄较PAN组显着降低(p<0.01),血清中Cys C、MIC 降低 (P <0.05),见表1。
表1 3组大鼠尿液及血清指标的比较
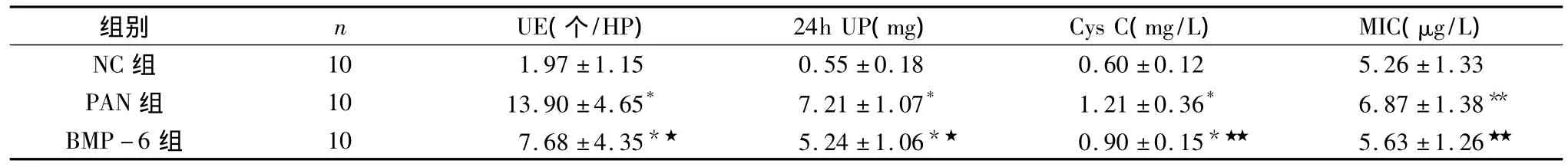
表1 3组大鼠尿液及血清指标的比较
与 NC 组相比,*P <0.01,**P <0.05;与 PAN 组相比,★P <0.01,★★P <0.05
组别 n UE(个/HP) 24h UP(mg) Cys C(mg/L) MIC(μg/L)10 1.97 ±1.15 0.55 ±0.18 0.60 ±0.12 5.26 ±1.33 PAN 组 10 13.90 ±4.65* 7.21 ±1.07* 1.21 ±0.36* 6.87 ±1.38**BMP -6 组 10 7.68 ±4.35*★ 5.24 ±1.06*★ 0.90 ±0.15*★★ 5.63 ±1.26 NC组★★
2.肾小球Wnt1、β-catenin mRNA的表达:PAN组Wnt1、β-catenin mRNA的表达较NC组分别增加121%、164%(P <0.01);而 BMP-6组较 NC 组分别增加57.9%、50.0%(P <0.05 或P <0.01)。与PAN组比较,BMP-6组 Wnt1、β-catenin mRNA的表达分别减少28.5%、43.2%(P <0.01),见图 1、表2。

图1 3组大鼠肾小球Wnt1、β-catenin mRNA的表达
表2 3组大鼠肾小球Wnt1、β-catenin mRNA表达相对值的比较
与 NC 组相比,*P <0.01,**P <0.05;与PAN 组相比,★P <0.01
10 0.19 ±0.06 0.14 ±0.07 PAN 组 10 0.42 ±0.09* 0.37 ±0.09*BMP -6组 10 0.30±0.06*★ 0.21±0.06-catenin NC组组别 n Wnt1 β**★
3.肾小球Wnt1、β-catenin蛋白的表达:Wnt1和β-catenin蛋白表达与两者mRNA的表达类似。NC组Wnt1、β-catenin两者仅微量表达。PAN组Wnt1、β-catenin蛋白表达较 NC组分别增加147%、57.6%(p<0.01);而BMP-6组较NC组分别增加73.3%(P <0.01)、18.2%(P >0.05)。与 PAN 组比较,BMP-6组Wnt1、β-catenin mRNA的表达分别减少 29.8%、25.0%(P <0.05 或 P <0.01),见图 2、表3。
表3 3组大鼠肾小球Wnt1、β-catenin蛋白表达相对值的比较
与 NC 组相比,*P <0.01;与 PAN 组相比,★P <0.01,★★P <0.05
10 0.15 ±0.05 0.33 ±0.05 PAN 组 10 0.37 ±0.09* 0.52 ±0.07*BMP -6组 10 0.26±0.08*★★ 0.39 ±0.06-catenin NC组组别 n Wnt1 β★
讨 论
Wnts是一种分泌型糖蛋白家族,包括19种Wnt蛋白,目前仅了解其中的少部分如Wnt1、Wnt4等。β-catenin是一种细胞骨架蛋白,与E-钙黏蛋白(E-cadherin)、α-连环蛋白(α-catenin)等共同参与细胞连接的构建和细胞间的黏附机制[9]。正常状态下β-catenin主要表达于上皮细胞胞膜,极少表达于胞质。同时β-catenin也是Wnt/β-catenin途径的核心分子,β-catenin的异位表达即在胞质内聚集并进入胞核是Wnt途经发挥生物学作用的关键步骤:Wnts与细胞膜受体Frizzled及共同受体LRP5/6结合,激活胞质内的蛋白,使β-catenin的降解复合物β-catenin去磷酸化而降解减少,并转移至细胞核,与T细胞因子/淋巴增强因子结合,促进EMT的发生和肾间质的纤维化[10]。啮鼠动物模型中,BMP-7对慢性肾疾病(CKD)有保护作用,外源性给予BMP-7减轻肾纤维化和足细胞的凋亡,使用rh BMP-7有望成为治疗CKD的有效药物之一[11]。
血清Cys C较血肌酐更早、更准确反映肾损伤[12]。MIF是一种炎症细胞因子,在CKD病人血清中升高,并与氧化应激的标志物密切相关[13]。本研究结果表明,PAN 组 UE、24h UP、Cys C、MIC水平较正常组均显着升高,使用BMP-6组上述指标明显改善。可见BMP-7可减轻血尿、蛋白尿,对肾损伤及炎症反应有保护作用。PAN大鼠模型以足细胞足突融合及大量蛋白尿为特点,主要病变在足细胞[14]。肾小球足细胞是BMP-7作用的主要靶点。我们研究显示,BMP-7可减少PAN鼠肾小球Wnt1和βcatenin mRNA和蛋白质的表达,为其治疗足细胞疾病提供了一定的依据。
TGF-β1是足细胞损伤因子,可诱导足细胞发生EMT,并抑制nephrin的表达;而BMP-7是足细胞保护因子,可拮抗 TGF - β1诱导 EMT 的发生[15,16]。外源性BMP-7可有效抑制糖尿病鼠引起的nephrin表达下降,维持其在足细胞上的正常分布[8]。Dai等[17]研究表明,在体内Wnt信号通路在足细胞功能异常和白蛋白尿中起中心作用:足细胞损伤激活Wnt/βcatenin信号通路,抑制nephrin的表达,导致白蛋白尿;去除足细胞β-catenin大鼠可以防止足细胞功能失常和白蛋白尿。可见,BMP-7的肾保护作用与拮抗 TGF-β1,抑制β-catenin通路,上调nephrin的表达有关。
总之,Wnt1/β-catenin信号可能是治疗以蛋白尿为主的肾疾病的新靶点,而BMP-7可拮抗Wnt1/β-catenin信号通路对肾损伤的保护作用。
1 Bergmann MW.WNT signaling in adult cardiac hypertrophy and remodeling:lessons learned from cardiac development[J].Circ Res,2010,107(10):1198-1208
2 Yeang CH,McCormick F,Levine A.Combinatorial patterns of somatic gene mutations in cancer[J].FASEB J,2008,22(8):2605 -2622
3 Liu Y.New insights into epithelial-mesenchymal transition in kidney fibrosis[J].J Am Soc Nephrol,2010,21(2):212 -222
4 Phillips AO,Fraser DJ.BMP-7 stops TGF-βin peritoneal fibrosis[J].Nephrol Dial Transplant,2010,25(4):1036 -1038
5 Kazama I,Mahoney Z,Miner JH,et al.Podocyte-derived BMP7 is critical for nephron development[J].J Am Soc Nephrol,2008,19(11):2181-2191
6 Xiao HQ,Shi W,Liu SX,et al.Podocyte injury is suppressed by 1,25-dihydroxyvitamin D via modulation of transforming growth factor-beta 1/bone morphogenetic protein-7 signalling in puromycin aminonucleoside nephropathy rats[J].Clin Exp Pharmacol Physiol,2009,36(7):682-689
7 Matsui I,Hamano T,Tomida K,et al.Active vitamin D and its analogue,22-oxacalcitriol,ameliorate puromycin aminonucleoside-induced nephrosis in rats[J].Nephrol Dial Transplant,2009,24(8):2354-2361
8 Xiao HQ,Shi W,Zhang Y,et al.Effect of bone morphogenic protein 7 on nephrin expression and distribution in diabetic rat kidneys[J].Nan Fang Yi Ke Da Xue Xue Bao,2009,29(4):671-675
9 Brembeck FH,Rosário M,Birchmeier W.Balancing cell adhesion and Wnt signaling,the key role of beta - catenin[J].Curr Opin Genet Dev,2006,16(1):51-59
10 He W,Dai C,Li Y,et al,Wnt/beta-catenin signaling promotes renal interstitial fibrosis[J].J Am Soc Nephrol,2009,20(4):765 -776
11 Mitu G,Hirschberg R.Bone morphogenetic protein-7(BMP7)in chronic kidney disease[J].Front Biosci,2008,13:4726 -4739
12 van Deventer HE,Paiker JE,Katz IJ,et al.A comparison of cystatin C- and creatinine-based prediction equations for the estimation of glomerular filtration rate in black South Africans[J].Nephrol Dial Transplant,2011,26(5):1553-1558
13 Bruchfeld A,Carrero JJ,Qureshi AR,et al.Elevated serum macrophage migration inhibitory factor(MIF)concentrations in chronic kidney disease(CKD)are associated with markers of oxidative stress and endothelial activation[J].Mol Med,2009,15(3 -4):70 -75
14 Pippin JW,Brinkkoetter PT,Cormack-Aboud FC,et al.Inducible rodent models of acquired podocyte diseases[J].Am JPhysiol Renal Physiol,2009,296(2):F213 -F229
15 Li Y,Kang YS,Dai C,et al.Epithelial-to-mesenchymal transition is a potential pathway leading to podocyte dysfunction and proteinuria[J].Am JPathol,2008,172(2):299 -308
16 Loureiro J,Schilte M,Aguilera A,et al.BMP-7 blocks mesenchymal conversion of mesothelial cells and prevents peritoneal damage induced by dialysis fluid exposure[J].Nephrol Dial Transplant,2010,25(4):1098-1108
17 Dai C,Stolz DB,Kiss LP,et al.Wnt/beta-catenin signaling promotes podocyte dysfunction and albuminuria[J].J Am Soc Nephrol,2009,20(9):1997-2008



