蔡多特
直肠癌是消化系统的常见肿瘤,并且它的发病率正在迅速提高[1]。准确的早期诊断对于直肠癌的早期治疗和提高患者生存率很重要。病理组织活检仍是诊断直肠癌的金标准,但是手术活检亦有其自身的局限性,是一种有创检查,可引起术后并发症[2]。目前,经直肠内超声检查(endorectal ultrasonography,ERUS)已广泛应用于临床,被认为是一种无创,无痛苦,快速,较客观检测直肠癌的方法。然而,不同的研究者在报道手术活检与直肠内超声两者的对比,诊断ERUS的准确率是不同的。本文旨在用Meta分析的方法分析ERUS对直肠癌肿瘤直肠壁浸润和淋巴结转移的诊断结果,以评价其对直肠癌的诊断价值。
对象与方法
1.研究对象:搜索截止日期至2010年12月已公开发表的关于使用经直肠内超声检查(endorectal ultrasonography,ERUS)作为检查方法对直肠癌进行诊断的研究。
2.资料检索:在MEDLINE和EMBASE等公共检索系统中以检索词为“endorectal ultrasound and rectal cancer”、“endorectal sonography and rectal cancer”为关键词,检索所有使用ERUS作为检查方法诊断直肠癌的公开发表的文献,搜索截止日期至2010年12月。(1)纳入标准:患者患有腺瘤或腺癌(包括原位癌);以病理检查作为金标准,且确诊为直肠癌;用ERUS和病理检查作为比较;用四格表表示诊断的相关数据;病例数不低于20例。(2)排除标准:接受过放射治疗或直肠狭窄妨碍超声探头进入者;综述和动物研究。(3)数据提取:提取数据包括:第一作者、国家、发表年份;样本大小;真阳性、假阳性、真阴性、假阴性的数据结果;灵敏度,特异度,阳性预测值,阴性预测值;病人基本情况(平均年龄、性别等)。
3.统计学方法:本篇Meta分析采用Stata 9.2版和Meta-DiSc for Windows[3]。受试者工作特征曲线分析和森林图则用于得出灵敏度和特异度的关系。DOR、Q值和受试者工作特征曲线下的面积则用于分析在ERUS的诊断价值[4,5]。P值和I2值用于检测各纳入研究的异质性。当P<0.05和I2>50%时,表示有统计学意义。
结果
1.纳入研究的基本情况:共收集了446篇适合分析的相关文献,经按照纳入标准、排除标准筛选后最终有11篇研究完全符合纳入标准,共有964名受试者[6~16]。ERUS诊断肿瘤直肠壁浸润、肿瘤淋巴转移相关研究概要见表1。
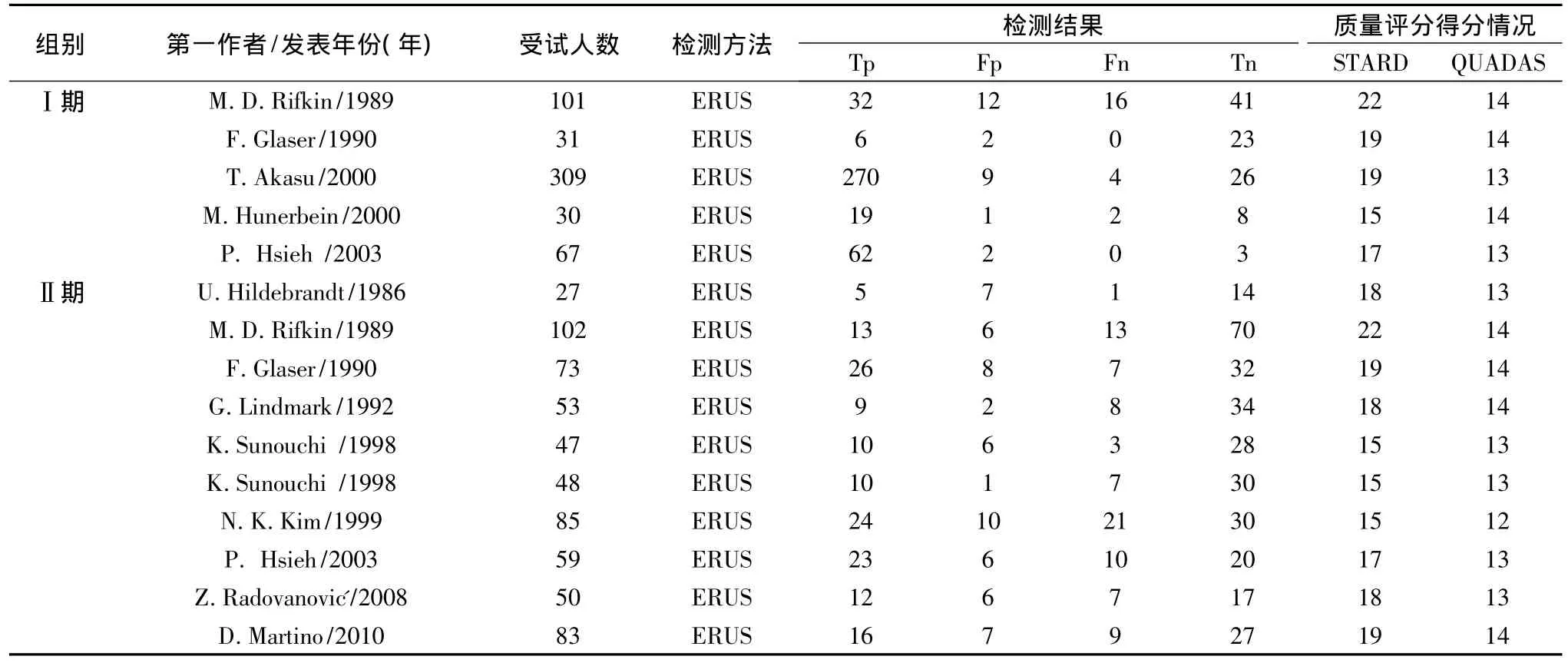
表1 ERUS诊断肿瘤直肠壁浸润(Ⅰ期)、肿瘤淋巴转移(Ⅱ期)相关研究概要
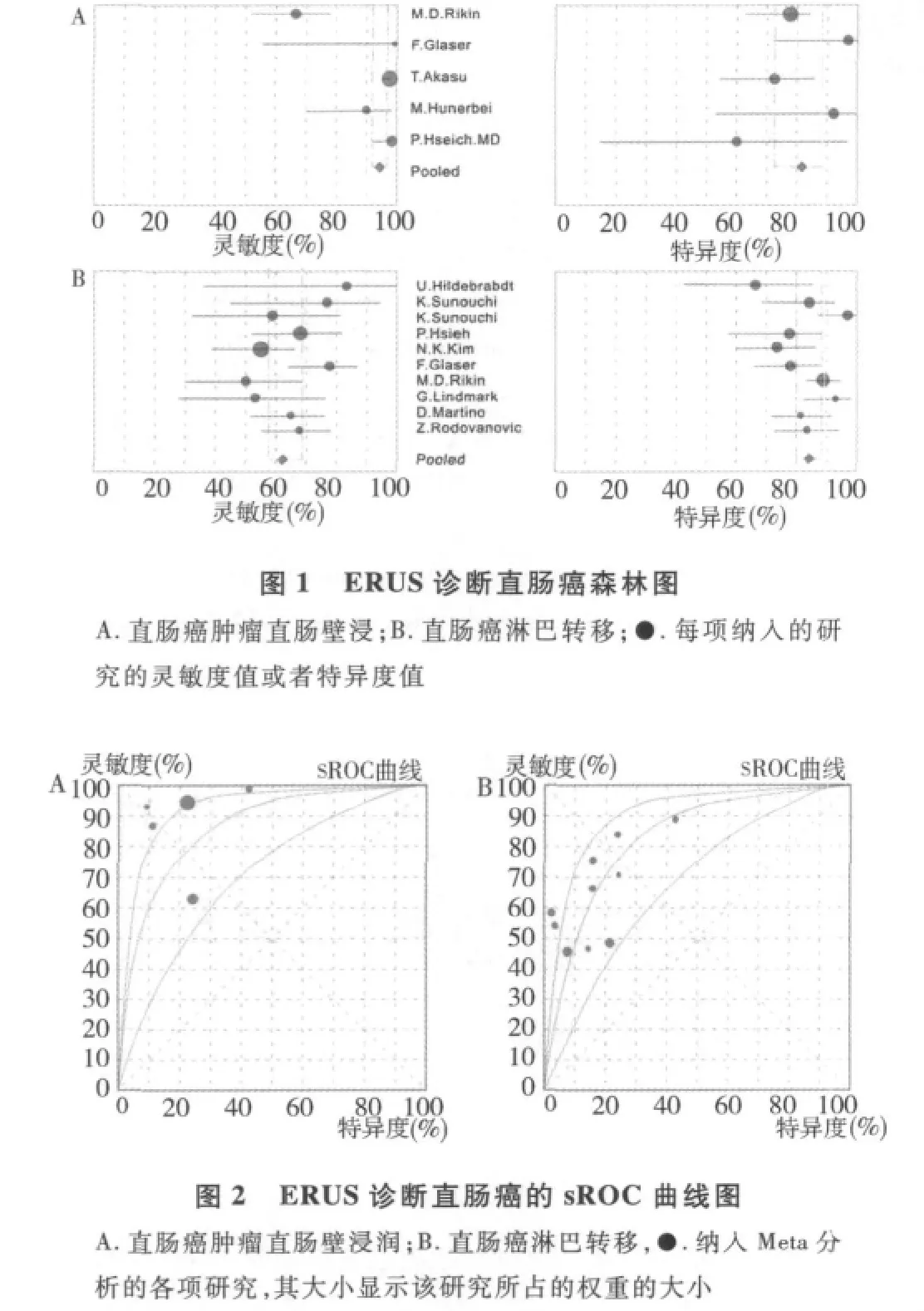
2.ERUS诊断直肠癌肿瘤直肠壁浸润、直肠癌淋巴转移的Meta分析:把这些研究分成2个亚组分别做了Meta分析,一组是关于肿瘤直肠壁浸润(Ⅰ期),另一组是关于肿瘤有淋巴结转移(Ⅱ期)。(1)肿瘤直肠壁浸润组:总的灵敏度是94.6%(95%可信区间:0.920~0.966),总的特异度是79.5%(95%可信区间:0.715~0.862)。诊断优势比(DOR)、阳性似然比(PLR)、阴性似然比(NLR)分别为62.878 (95%可信区间:9.295~425.33),3.659(95%可信区间:2.484~5.389),0.072(95%可信区间:0.013~0.400)。见图1。灵敏度、特异度、PLR、NLR和DOR的I2值分别为92.8%(P=0.000)、23%(P= 0.268),15.1%(P=0.318),89.9%(P=0.000)和81.9%(P=0.000)。sROC曲线见图2,曲线下面积(AUC)为0.8590,Q值为0.7897。(2)淋巴转移组:总灵敏度是63.2%(95%可信区间55.9%~70.0%),总特异度是 84.9%(95%可信区间80.3%~88.7%)。诊断优势比(DOR)、阳性似然比(PLR)、阴性似然比(NLR)分别是9.789(95%可信区间:5.807~16.502),3.734(95%可信区间: 2.594~5.374),0.467(95%可信区间:0.378~0.578)(图1)。灵敏度、特异度、PLR、NLR和DOR的I2值分别为37.9%(P=0.127)、66%(P= 0.004),35.7%(P=0.144),15%(P=0.313)和15.7%(P=0.306)。sROC曲线见图2,曲线下面积(AUC)为0.807,Q值为0.7416。
讨论
在过去的20年里,直肠癌的患病率持续增长,尤其在南美和欧洲。目前术前临床常采用直肠指诊、肠镜、CT、MRI及直肠腔内超声(ERUS)来评估直肠癌。ERUS在直肠癌诊断上的价值是显而易见的,对浸润深度、肠周淋巴结转移诊断准确性均较高,而且无创伤、无辐射、操作方便、费用低,经直肠超声可能是直肠癌患者术前分期的有效方法。我们设计了这个Meta分析,主要关注其灵敏度,特异度,评估腔内超声对直肠癌诊断准确性。
从sROC曲线和AUC可以看出这个检测方法总的工作效果,并显示了灵敏度和特异度的折中效果。根据Meta分析,ERUS的总灵敏度为94.6%,总特异度为79.5%,Q值为0.789,AUC为0.859,这些数据显示ERUS有高级别的准确率。DOR是直肠癌患者被检测出阳性的比率和不是直肠癌患者被检测出阳性的比率的一个比值。DOR值为62.878,显示ERUS在诊断直肠癌肿瘤直肠壁浸润方面是有用的。但是因为sROC曲线和DOR值不能简单的解释和应用于临床实验,而似然比被认为更有临床意义。因此,也用PLR和NLR对ERUS的准确性进行了分析。PLR值3.659,NLR值0.072。PLR的结果意味着用ERUS检测肿瘤直肠壁浸润的患者比为被侵犯者的阳性机会高出约4倍。同样,NLR值表示如果ERUS检测结果为阴性,这部分阴性结果中,可能约有7%的人是肿瘤直肠壁浸润患者。当似然比 >10或者<0.1的时候,会使验前概率到验后概率产生巨大的决定性的转变,而这正是高准确率的指标。因此,根据我们计算出的似然比值,当ERUS检测出结果为阴性时,该受检者是可以被排除有肿瘤直肠壁浸润的。相反,当检测结果为阳性时,临床医生是不能确诊受检者有肿瘤直肠壁浸润的。
肿瘤淋巴转移亚组的AUC值、Q值、总灵敏度、特异度分别为0.807,0.742,63.2%和84.9%;PLR和NLR值分别为3.734和0.467。比起ERUS诊断肿瘤直肠壁浸润,本组的准确率,灵敏度,特异度是相对较低的。显然用ERUS诊断肿瘤直肠壁浸润优于诊断淋巴转移。而且从PLR<10,NLR>0.1可以看出ERUS是不能在临床上单独用于诊断直肠癌有无淋巴结转移的。
I2值和P值是用于异质性分析的。尽管纳入的研究数据都是有意义的,但是我们注意到有的研究是用盲法而有的没有,有的是横断面研究,有的却是贯序研究或者随机研究,同样,有的是前瞻性研究而有的是回顾性研究。根据I2≤50%和P>0.05以上差别都没有统计学意义,并不会实质上影响到对诊断准确性的分析。
在肿瘤直肠壁浸润方面的诊断,Meta分析显示直肠内超声检查有较高的灵敏度,适用于疾病的普查筛选。并且当ERUS检测出结果为阴性时,该受检者是可以被确定地排除有肿瘤直肠壁浸润的,而当检测结果为阳性时,还需要结合其他诊断手段才能确诊。而用于淋巴转移方面检查根据Meta分析结果,这种诊断方法的报告应与临床其他常规检查互相利用用于诊断,比如病理检查、CT、MRI、PET-CT等等。
1 Bernal M,GomezGJ,Gomez FJ.Tendency of the colorectal cancer in a zone of northern Spain[J].Acta Gastroenterol Latinoam,2007,37 (2):84-90
2 Bipat S.Rectal cancer:local staging and assessmentof lymph node involvement with endoluminal US,CT,and MR imaging-Ameta-analysis[J].Radiology,2004,232(3):773-783
3 Glaser F,Schlag P,Herfarth C.Endorectal ultrasonography for the assessment of invasion of rectal tumours and lymph node involvement[J].British Journal of Surgery,1990,77(8):883-887
4 Whiting P.The development of QUADAS:a tool for the quality assessment of studies of diagnostic accuracy included in systematic reviews[J].BMCMed Res Methodol,2003,3(1):25
5 Bossuyt PM.Towards complete and accurate reporting of studies of diagnostic accuracy:the STARD initiative[J].Clin Radiol,2003,58 (8):575-580
6 Hildebrandt U.Endorectal ultrasound:instrumentation and clinical aspects[J].International Journal of Colorectal Disease,1986,1(4): 203-207
7 Hsieh PS.Comparing results of preoperative staging of rectal tumor using endorectal ultrasonography and histopathology[J].Chang Gung Medical Journal,2003,26(7):474-478
8 Akasu T.Endorectal ultrasonography and treatmentof early stage rectal cancer[J].World Journal of Surgery,2000,24(9):1061-1068
9 Kim NK.Comparative study of transrectal ultrasonography,pelvic computerized tomography,andmagnetic resonance imaging in preoperative staging of rectal cancer[J].Diseases of the Colon and Rectum,1999,42(6):770-775
10 Sunouchi K.Limitation of endorectal ultrasonography:what does a low lesion more than 5 mm in size correspond to histologically?[J].Dis Colon Rectum,1998,41(6):761-764
11 Hunerbein M.Prospective comparison of endorectal ultrasound,three-dimensional endorectal ultrasound,and endorectal MRI in the preoperative evaluation of rectal tumors:preliminary results[J].Surgical Endoscopy,2000,14(11):1005-1009
12 Lindmark G.The value of endosonography in preoperative staging of rectal cancer[J].International Journal of Colorectal Disease,1992,7 (3):162-166
13 Rifkin MD,Ehrlich SM,Marks G.Staging of rectal carcinoma:prospective comparison of endorectal US and CT[J].Radiology,1989,170(2):319-322
14 Martino D.The role of endorectal ultrasonography in preoperative staging of rectal cancer[J].Arch Ital Urol Androl,2010,82(4):256-258



