叶天民 肖 佳 杨健之 范宇平 滕晓明
不孕症是当今人类生殖的一个大问题。虽然我们已经拥有了辅助生殖的各种技术、适宜着床的内膜、和优质的胚胎等,均可以在一定程度上进行选择和检测,但在实际临床工作中,许多移植的胚胎仍然难以得到成功妊娠。其中的主要问题之一在于胚胎的着床。所以,目前不孕症的治疗成功率仍然在30%左右徘徊[1]。胚胎着床这个在生殖过程中非常重要的事件,在哺乳动物的不同物种之间,其几个基本的步骤都是非常相似的。主要分为定位、黏着和侵入3 个步骤。定位是指囊胚在内膜表面不稳定的黏着。此后,黏着步骤是指囊胚滋养细胞开始具有黏着能力并黏于子宫内膜表面。紧接着,滋养细胞会穿破子宫内膜的腔上皮层,进入内膜的间质,即侵入过程[2]。这些步骤需要胚胎和子宫之间和谐而精密的对话[3]。该系列对话是由诸多分子通路所介导的,其中包括了性激素、细胞因子、生长因子、黏着分子和脂质等[4]。
子宫中进行胚胎着床的环境是一个相对缺氧的环境,这种环境可能更加利于胚胎的发育。一些研究发现,如果将胚胎置于大气氧浓度的环境,将对胚胎产生不利的影响,甚至导致胚胎的死亡[5]。有文献报道,兔子、鼠类及灵长类恒河猴输卵管处的氧分压大约是5% ~8%,而恒河猴的着床胚胎部位的氧分压浓度大约是1.5% ~2.0%。在兔子和仓鼠的子宫内氧分压是随着发情周期的变化而变化的,并且从非着床期到着床期,氧分压浓度从5. 3% 下降到了3.5%[6]。在很多胚胎体外培养的实验中都发现,若将胚胎培养环境中的氧浓度从大气氧浓度降至文献报道的生理浓度将会有利于胚胎的体外发育,具体表现在培养后囊胚发育率及胚胎细胞数目的差异[7~11]。在小鼠的胚胎体外培养中,氧浓度5%或者7%的培养环境中囊胚发育率及胚胎细胞数目将会>20%的大气氧浓度。纯品系及远系杂交品种小鼠均得到相同的结果[7,11~13]。但迄今为止,低氧浓度对胚胎着床的影响机制还不甚清楚。本研究将基于已经建立的三维小鼠体外胚胎着床模型,将整个培养环境的氧浓度调整为2%,从而探究缺氧环境对胚胎着床的作用和影响。
材料与方法
1.小鼠体外胚胎着床模型及缺氧处理后黏着率的对比:本研究所有健康雌性及雄性ICR 小鼠由同济大学实验动物中心提供。所有实验均得到同济大学实验动物伦理委员会批准。按照Ye 等[14]已经建立的小鼠体外着床模型,将其中一组置于氧浓度2%的密封箱(美国Cell signaling 公司)内,用2%氧气、98%二氧化碳的气体进行换气5min,然后密封好,置于培养箱内进行培养。另外一组为对照组,直接置于培养箱中进行培养。之后观察对比这两组之间胚胎与内膜的黏着率。
2.HE 染色及细胞凋亡TUNEL 实验:三维模型中的胚胎内膜组织经常规固定包埋后切片,进行HE 染色,脱水后使用中性树脂封片。切片中细胞凋亡的检测通过TUNEL - POD试剂盒来完成(美国罗氏公司),最后用辣根过氧化物酶氧化底物进行显色,用中性树脂封片,具体实验过程参见该公司试剂盒说明书。
3.统计学方法:两组胚胎黏着率的比较,用卡方检验进行比较;两组内膜上皮层厚度的比较,用ANOVA 检验进行比较,以P <0.05 表示差异有统计学意义。
结 果
1.2%氧浓度和大气氧浓度下体外胚胎黏着的对比:小鼠囊胚在2%的氧浓度及大气氧浓度下的胚胎黏着率分别为41.4%和53.2%,这两组的胚胎黏着率比较没有统计学差异。
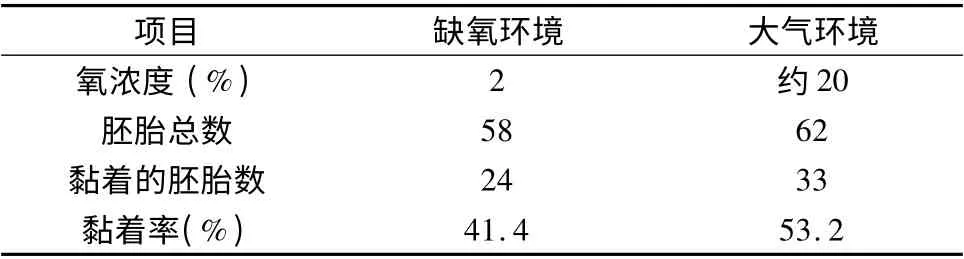
表1 2%氧浓度和大气氧浓度下三维体外着床模型中的黏着率
2.三维模型组织切片HE 染色:为了观察不同氧浓度下胚胎黏附着床情况,将已经在体外模型中黏附于子宫内膜的胚胎连同内膜组织进行固定切片,进行HE 染色,观察胚胎的发育情况及内膜组织的形态。缺氧条件及大气氧浓度环境下胚胎体外黏附着床的形态情况见图1。图1 中可见,两种情况下的小鼠胚胎均已经黏着于体外共培养的子宫内膜上皮层表面,未见明显形态学异常。

图1 2%氧浓度(A)及大气氧浓度下(B)的
3.内膜组织腔上皮细胞层厚度的测定:为了对比两种氧浓度下子宫内膜形态,对两种情况下子宫内膜的腔上皮层厚度进行多点采样,照相后用Image Pro软件进行测量,然后对比发现,两组上皮层厚度比较没有统计学差异(P=0.095,图2)。
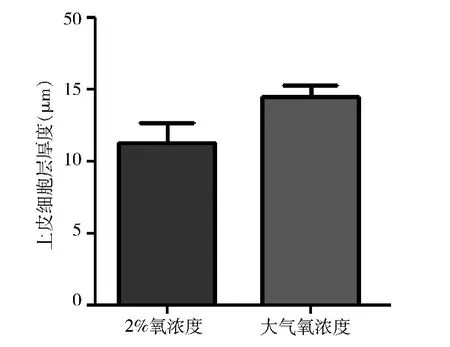
图2 2%氧浓度及大气氧浓度下的三维体外着床模型培养后,内膜组织腔上皮细胞层的厚度
4.细胞凋亡的检测:对两种氧浓度下体外培养内膜组织及黏附胚胎进行细胞凋亡的检测,发现在2%氧浓度下,子宫内膜组织中较多间质细胞发生了细胞凋亡(图3)。
讨 论
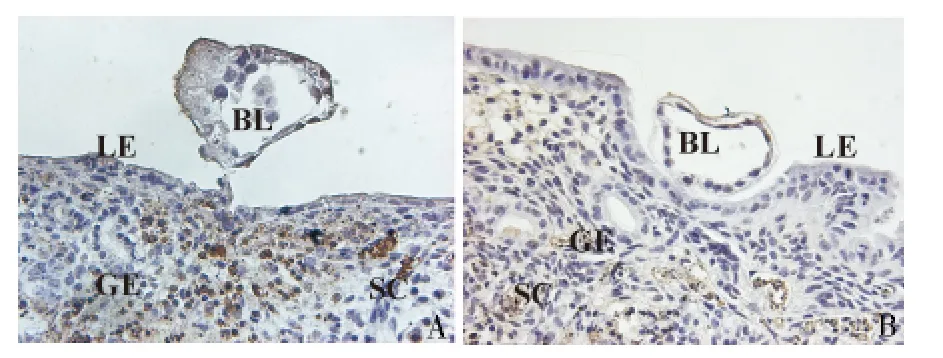
图3 2%氧浓度(A)及大气氧浓度下(B)的
目前许多生殖医学中心在进行临床体外受精治疗的时候,采用普通的二氧化碳培养箱进行胚胎的体外培养,其培养环境的氧浓度大约是大气的氧浓度(约20%)。因为在体内环境下,胚胎并没有处在这样高氧浓度的环境中(约2% ~8%),所以该培养条件潜在地将胚胎置于了氧化压力之中,并增加了氧自由基的浓度对胚胎的影响[6]。对于小鼠的胚胎而言,Whitten 等已经证实,在5%的氧浓度下,大部分小鼠受精卵可以体外发育至囊胚,但如果氧浓度为20%就不会有受精卵发育成囊胚。Quinn 等[12]则发现在高浓度氧的环境中,只有5%的小鼠受精卵可以发育至囊胚。在其他的动物实验中,也得到了相似的结果。但也有文献报道,如给予较长时间的培养(78 ~95h),小鼠受精卵在体外20%的氧浓度环境下也能够发育至囊胚[5]。这些结果的差异可能是因为胚胎来自于不同的实验小鼠品系,也可能源于实验技术的提高[5]。
在本实验的预实验中,曾经先尝试了小鼠胚胎同样环境下的体外培养。在20%氧浓度的情况下,从受精卵到囊胚的体外培养所需的时间大概落后于体内情况12 ~24h。为了保证实验中胚胎的质量,笔者的三维体外着床模型中采用的是新鲜采取小鼠囊胚进行共培养。所以在预实验中,笔者也将小鼠囊胚放在同样的培养液中在20%的氧浓度下进行单独培养,发现小鼠囊胚在1 ~2 天后外面透明带均会消失,然后大约1 ~2 天之后,会黏着在培养皿的底部,然后在底部发育摊开,变成饼状。中间是内细胞团的细胞,外周为滋养细胞。这就证明,在这样的培养环境中,小鼠囊胚可以存活很多天,只是它无法遇到能够着床的子宫内膜组织或者细胞。
尽管如此,胚胎除了存活的能力外,最关键的是它着床和最终发育成个体的潜力和能力。在本研究中,运用笔者已经建立的三维体外着床模型来对胚胎着床的氧浓度环境进行检测,同时直接取小鼠的囊胚和内膜进行共培养。整个着床模型的共培养时间是28h,因为预实验发现在同样的培养环境下,28h 不会影响胚胎的生存。在本模型中,笔者第1 次见到了体外内膜胚胎共培养时见到了内膜组织蜕膜化的改变,在形态学外的生化学和组织化学水平证明了此模型确实发生了体外着床[14]。但是,胚胎着床黏附以后的穿入或者侵入则相对少见。虽然笔者也试过将培养的时间从28h 延长到36h 或者更长,但是胚胎很容易消失或者变形塌陷。这种情况有可能和胚胎处于氧浓度过高的环境中所致。当将低氧环境运用到已经建立的体外着床模型的时候,结果显示在2%氧浓度的环境下,胚胎黏着率为41.4%,虽然从绝对数值上低于大气氧浓度对照组的53.2%,但两组的胚胎黏着率并没有统计学差异,似乎和体内缺氧环境适宜胚胎着床的情况不相吻合。
进一步观察发现,从形态学上,内膜组织及胚胎均并未发生异常改变。如图2 所示,两组的内膜细胞未有明显形态学差异,并且缺氧组的组织细胞也未出现细胞皱缩坏死等现象。在本实验中,笔者还进一步将两组内膜组织的切片图片进行了多点的采样,对比它们两组内膜组织腔上皮层厚度,结果发现没有统计学差异。更加说明了在形态学层面,内膜组织没有发生改变。但是,通过TUNEL 细胞凋亡实验的检测,笔者发现体外模型中的子宫内膜组织的间质细胞明显出现了凋亡细胞。这说明缺氧的环境未必能够维持体外培养内膜组织在体内的状况,这可能就是导致胚胎黏着率降低的原因。胚胎着床的过程需要胚胎和子宫内膜完美对话。以往的观点认为,只要胚胎好,着床的概率就会提高,但近几年的研究认为,子宫是一个比较灵活的器官,它对外界的环境也是非常灵敏的,如它可以识别胚胎的好坏以及环境的不同而做出不同的反应[15~17]。
虽然在本研究中运用的是小鼠子宫内膜组织的体外培养,但它对体外的环境依然非常敏感,在缺氧的环境中,内膜间质细胞开始出现凋亡,从而引起了早期胚胎黏着率的下降。虽然两组没有统计学差异,但如果延长培养的时间,或者增加实验的样本量,可能会有统计学差异。早在1961 年,Glenister 等就第1次报道了兔的胚胎与内膜组织共培养体外着床模型,他们经过几天的培养也看到了子宫内膜组织明显看的坏死。另外一个问题就是2%的浓度可能适宜胚胎的生长发育,但对于子宫内膜的培养来说,不太适宜。未来应继续探索略微提高培养环境的氧浓度(如提高到5% ~8%),这样既可以一定范围内保持内膜细胞的活性,又可以尽量给予胚胎适宜的着床环境。综上所述,笔者发现,2%的氧浓度在三维体外胚胎着床模型的运用中,虽然没有导体外胚胎黏着率的显着降低,但却诱导了体外培养子宫内膜组织中细胞的凋亡。
1 Paria BC. Molecular signaling in uterine receptivity for implantation[J].Semin Cell Dev Biol,2000,11(2):67 -76
2 McEwan M.Cytokine regulation during the formation of the fetal-maternal interface:Focus on cell -cell adhesion and remodelling of the extra-cellular matrix[J].Cytokine & Growth Factor Reviews,2009,20(3):241 -249
3 Achache H,Revel A.Endometrial receptivity markers,the journey to successful embryo implantation[J]. Hum Reprod Update,2006,12(6):731 -746
4 Vigano P.Maternal-conceptus cross talk-a review.Placenta,2003,24(Suppl B):S56 -61
5 Feil D.Effect of culturing mouse embryos under different oxygen concentrations on subsequent fetal and placental development[J].J Physiol,2006,572(Pt 1):87 -96
6 Fischer B,Bavister BD. Oxygen tension in the oviduct and uterus of rhesus monkeys,hamsters and rabbits[J].J Reprod Fertil,1993. 99(2):673 -679
7 Pabon JE,Findley Jr WE,Gibbons WE.The toxic effect of short exposures to the atmospheric oxygen concentration on early mouse embryonic development[J].Fertil Steril,1989,51(5):896 -900
8 Savolainen VT.Alcohol consumption and alcoholic liver disease:evidence of a threshold level of effects of ethanol[J]. Alcohol Clin Exp Res,1993,17(5):1112 -1117
9 Thompson JG.Effect of inhibitors and uncouplers of oxidative phosphorylation during compaction and blastulation of bovine embryos cultured in vitro[J].J Reprod Fertil,2000,118(1):47 -55
10 Thompson JG.Effect of oxygen concentration on in-vitro development of preimplantation sheep and cattle embryos[J]. J Reprod Fertil,1990,89(2):573 -578
11 Orsi NM,Leese HJ. Protection against reactive oxygen species during mouse preimplantation embryo development:role of EDTA,oxygen tension,catalase,superoxide dismutase and pyruvate[J]. Mol Reprod Dev,2001,59(1):44 -53
12 Quinn P,Harlow GM.The effect of oxygen on the development of preimplantation mouse embryos in vitro[J].J Exp Zool,1978,206(1):73 -80
13 Umaoka Y. Effects of oxygen toxicity on early development of mouse embryos[J].Mol Reprod Dev,1992,31(1):28 -33
14 Ye TM.Development and characterization of an endometrial tissue culture model for study of early implantation events[J]. Fertil Steril,2012,98(6):1581 -1589
15 Mansouri-Attia N.Endometrium as an early sensor of in vitro embryo manipulation technologies[J]. Proc Natl Acad Sci USA,2009,106(14):5687 -5692
16 Teklenburg G.Natural selection of human embryos:decidualizing endometrial stromal cells serve as sensors of embryo quality upon implantation[J].PLoS One,2010,5(4):e10258
17 Weimar CH.Endometrial stromal cells of women with recurrent miscarriage fail to discriminate between high- and low-quality human embryos[J].PLoS One,2012,7(7):e41424



