江丹丹 郭敬强 陈 亮
人参皂甙Rg3对胰腺癌裸鼠皮下移植瘤血管生成拟态的研究
江丹丹 郭敬强 陈 亮
目的 本实验通过建立胰腺癌SW-1990细胞株皮下移植瘤模型,探讨人参皂甙Rg3对胰腺癌皮下移植瘤血管生成拟态的影响。方法 首先建立人胰腺癌细胞裸鼠模型,后给予不同药物浓度的人参皂甙Rg3(0、5、10、20mg/kg)处理裸鼠,观察人参皂甙Rg3对裸鼠移植瘤生长的影响,免疫组化-PAS双染观察人参皂甙Rg3对裸鼠胰腺癌皮下移植瘤血管生成拟态和血管内皮因子CD31的影响,并用荧光定量PCR和Western blot法分别检测MMP-2、MMP-9在mRNA和蛋白水平的表达。结果人参皂甙Rg3能够抑制胰腺癌裸鼠皮下移植瘤的生长,其中20mg/kg人参皂甙Rg3组最明显;Western blot法和荧光定量PCR示用药组与空白组比较,MMP-2、MMP-9在蛋白和mRNA水平的表达下降,且差异有统计学意义(P<0.05);免疫组化-PAS双染后发现血管拟生(+)和CD31(+)数量均较空白组减少。结论 通过体内实验笔者证实人参皂甙Rg3能够通过降低MMP-2、MMP-9的表达来抑制胰腺癌血管生成拟态的形成。
胰腺癌 胰腺癌裸鼠皮下移植瘤 血管生成拟态 基质金属蛋白酶
胰腺癌是一种恶性程度非常高的消化道肿瘤,由于其起病隐匿,临床发现时大部分已处于晚期,治疗上手术切除是目前主要的治疗方式,但由于术后易复发,其5年的生存率仅为20%[1]。肿瘤的生长主要依靠新生血管的形成,传统观念认为新生血管的形成大都起源于血管内皮细胞。然而Maniotis等[2]发现在人眼葡萄膜黑色素瘤中存在一种由细胞外基质和黑色瘤细胞包绕组成的,在电子微镜下观察到在管腔中存在红细胞而无内皮细胞的互相连接的环袢状网络结构,通常将这种不依赖于内皮细胞的肿瘤内血管生成状态称为血管生成拟态,随后人们陆续在其他肿瘤中同样证实这种血管生成拟态的存在。有临床报道,胰腺癌中存在血管生成拟态,但是其形成具体机制仍不清楚。
人参皂甙Rg3是从人参中提取的一种微量四环三萜皂甙,其能够通过多种机制发挥抗肿瘤作用[3~7]。笔者前期实验研究发现胰腺癌SW-1990细胞株在体外三维培养环境中能形成血管生成拟态,人参皂甙Rg3能够使MMP-2、MMP-9的表达下降,抑制胰腺癌SW-1990细胞株在三维培养环境中血管生成拟态的生成,但体外三维培养环境与体内的差异较大,对实验结果会造成影响。本实验通过建立胰腺癌SW-1990细胞株裸鼠皮下移植瘤模型,探讨人参皂甙Rg3对胰腺癌裸鼠皮下移植瘤血管生成拟态的影响。
材料与方法
1.试剂:人参皂甙Rg3标准品(纯度≥98%),购买于美国Sigma公司,DMEM培养液、胰酶购于Gibco公司,MMP-9、MMP-2抗体购买于Abcam公司。
2.细胞培养和胰腺癌动物模型的建立:胰腺癌细胞株SW-1990购买于美国ATCC公司,培养于DMEM培养液中,置于37℃、饱和湿度含5%C02及95%氧气的孵箱中培养。动物实验经过嘉兴学院医学院伦理文员会批准。BALB-/C-nu裸鼠28只,18~22g,4~6周龄,购自中科院上海实验动物中心,饲养于嘉兴学院医学院实验动物中心(SPF级),有关动物的实验操作均按规定进行。动物模型的建立:待SW-1990细胞培养至铺满瓶底70%~80%时,用胰酶消化贴壁细胞,用含DMEM和血清1∶1的液体稀释成2×106/100μl的单细胞溶液,在无菌条件下于裸鼠背侧近右后肢处皮下接种100微升/只。当癌细胞接种后3天,把裸鼠随机分成4组,每组7只,之后通过腹腔注射给予不同人参皂甙Rg3浓度处理(0、5、10、20mg/kg),隔日1次,共给药4周,最后一次给药后3天处死裸鼠,取移植瘤组织用于后续实验研究。
3.免疫组化-PAS双染:上述留取的裸鼠移植瘤组织,经4%的多聚甲醛固定,石蜡包埋后切片,经3%的双氧水灭活过氧化物酶20min,1×PBS洗涤3次,每次5min,后经5%的山羊血清室温下封闭20min,一抗CD31(1∶100)4℃过夜孵育,PBS洗涤后经辣根标记的山羊抗鼠二抗(1∶100)37℃孵育1h。DAB复染8min,高碘酸作用10min,然后置于Schiff液中,目测组织出现紫红质后流水冲洗终止。苏木素复染2min,流水冲洗12min,分化、反蓝、常规脱水、透明、树胶封片。CD31/PAS阳性结果判定及量化方法如下[8]:400×高倍显微镜下随机选取10个视野,肿瘤细胞彼此融合,连接成网络结构且PAS阳性的为形成拟生态血管;肿瘤组织中出现CD31阳性、PAS染色阴性的为血管内皮依赖的管道,CD31阴性、PAS染色阳性且管腔内发现红细胞者为拟生态血管,以平均数来计算两者的量。
4.荧光定量PCR检测MMP-2、MMP-9 mRNA的表达:根据说明用TRIzol一步法提取裸鼠移植瘤组织中总的RNA,按RNA反转录试剂盒说明反转录合成cDNA,cDNA用DEPC水稀释3倍。MMP-2、MMP-9和内参GAPDH的引物用1×TBE Buffer 稀释成10pmol/ml待用,其引物序列见表1。将扩增好的cDNA,待用的稀释引物,荧光PCR水,SYRB Green按照SYRB Green 5μl、上游下游引物各1μl、cDNA 1μl、余下用荧光PCR水补足配成10μl的反应体系,上机(Roche)扩增45个循环。结果用Light Cycler 480软件分析。
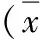
表1 引物序列和扩增产物长度 ±s)
5.Western blot法检测MMP-2、MMP-9蛋白水平的表达:裸鼠移植瘤组织获取后立即放入加有液氮的研钵中碾磨,提取移植瘤组织的蛋白,之后用BAC试剂盒测定蛋白的浓度,配体系。制好10%的胶板后,蛋白60μg浓度上样电泳,恒流300mA 转膜,1×TBS平衡5min,后5%的脱脂牛奶封闭2h,一抗(MMP-9 1∶1000,MMP-2 1∶100)4℃过夜,二抗(1∶5000) 室温下2h,1×TBST洗涤后,加ECL 化学发光曝光,结果用AlphaEaseFC 4.0软件分析。
结 果
1.人参皂甙Rg3对胰腺癌裸鼠皮下移植瘤生长的影响: 与不用药组比较,人参皂甙Rg3可以抑制裸鼠胰腺癌皮下移植瘤的生长,并且随着用药浓度的增加,移植瘤的形成有逐渐变小的趋势,其中10mg/kg和20mg/kg浓度人参皂甙Rg3作用最明显。裸鼠麻醉后取瘤称重,测量瘤体长和宽,按照(4/3)π[(长度+ 宽度)/4][9]计算瘤体的体积,各组瘤体重量和体积的量化差别见表2所示。

图1 不同浓度的人参皂甙Rg3(0、5、10、20mg/kg)分别作用于裸鼠皮下移植瘤4周后,对胰腺癌皮下移植瘤的影响A.0mg/kg;B.5mg/kg;C.10mg/kg;D.20mg/kg;由图A、B、C、D可以看出,随着药物浓度的升高,移植瘤的形成有逐渐变小的趋势
表2 不同浓度的人参皂甙Rg3对裸鼠皮下移植瘤重量和体积影响的量化
2.人参皂甙Rg3对胰腺癌裸鼠皮下移植瘤血管生成拟态的影响:单纯CD31染色,可见一抗CD31将具有血管内皮结构的血管部分染成棕黄色(图2A);单纯PAS染色,将血管拟态区管道壁及细胞外基质染成紫红色(图2B);图2C所示在PAS(+)的通道中能够见到肿瘤细胞,说明肿瘤细胞可以经过血管生成拟态发生转移;图2D所示CD31染色(+)的管道和PAS(+)的通道相连,说明血管生成拟态和内皮依赖性血管相通,血管生成拟态同样可以给肿瘤组织的生长、侵袭、复发和转移提供基础;空白组和用药组的双染结果分别如图2E、F、G、H所示,随着人参皂甙Rg3的用药,血管拟生态的形成能力逐渐下降,CD31/PAS阳性量逐渐下降,其具体数值如表3所示。
3.Western blot法和FQ-PCR检测各组裸鼠移植瘤组织MMP-2、MMP-9蛋白和mRNA的表达:如图3A所示,随着人参皂甙Rg3用药浓度的增加,与不用药组比较,移植瘤组织的MMP-2、MMP-9蛋白的表达逐渐下降;其中20mg/kg组下降最明显,差异有统计学意义(P<0.05) ;与Western blot法的结果相对应的荧光定量PCR结果如图3B所示,随着人参皂甙Rg3用药浓度的增加,与不用药组比较,移植瘤组织的MMP-2、MMP-9在mRNA水平表达均下降,其中20mg/kg组下降最明显,差异有统计学意义(P<0.05)。
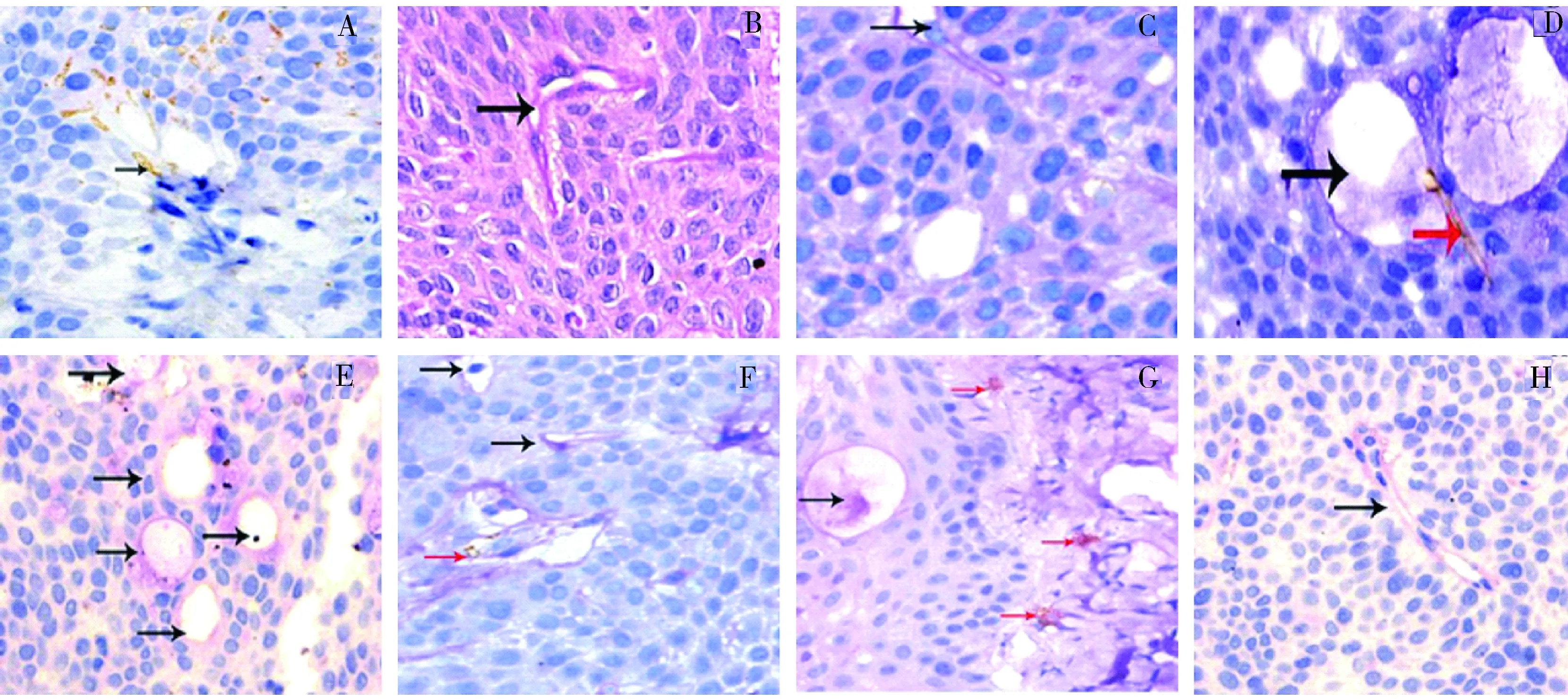
图2 采用免疫组化-PAS双染法观察人参皂甙Rg3对胰腺癌裸鼠皮下移植瘤血管生成拟态的影响
表3 裸鼠CD31/PAS阳性量化计数具体数值
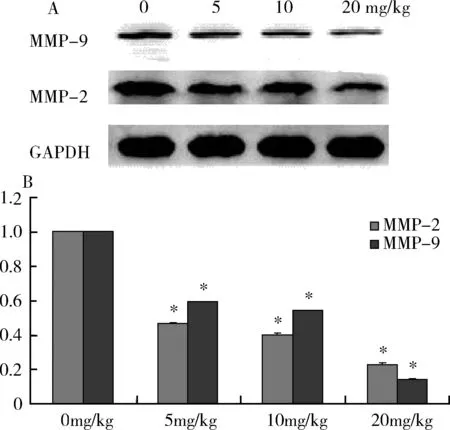
图3 采用Western blot法和FQ-PCR分别检测不同用药浓度的人参皂甙Rg3对MMP-2、MMP-9蛋白和mRNA的表达的影响与对照组比较,P<0.05
讨 论
传统观念认为肿瘤血管的形成主要依靠内皮细胞,据研究发现在黑色素瘤中存在一种由肿瘤细胞自身和细胞外基质形成的能够运输红细胞的管型通道,即血管生成拟态[2]。血管生成拟态一般出现在高度恶性的肿瘤组织中,是肿瘤细胞形成的新型血管网络结构[5]。正如本实验证实,在胰腺癌裸鼠移植瘤组织中存在血管生成拟态,血管可以形成花环状结构,其为肿瘤的生成和侵袭提供营养基础,随着人参皂甙Rg3的用药,裸鼠移植瘤组织形成血管拟生态的能力逐渐下降,主要表现在免疫组化-PAS双染中CD31(+)和PAS(+)阳性数量逐渐下降。
基质金属蛋白酶(MMP)是一组锌依赖性内肽酶,与肿瘤浸润和转移等密切相关。据Seftor等[10]报道在高侵袭性黑色素瘤组织中 MMP2、MMP9的表达较其他肿瘤组织中明显增加,使肿瘤细胞结合更多的层黏连蛋白,最终促进血管生成拟态的形成。研究发现人参皂甙Rg3抑制MMP-2、MMP-9的表达而发挥抗肿瘤作用[11]。正如本研究所证实,在裸鼠移植瘤组织中,MMP2、MMP9呈高表达状态,随着人参皂甙Rg3的用药,与不用药组比较MMP-2、MMP-9在蛋白和mRNA水平的表达均下降。故通过本实验笔者推测人参皂甙Rg3抑制胰腺癌皮下移植瘤的生长和其可抑制MMP2、MMP9的表达有关,并进一步抑制血管生成拟态的形成。
总之,血管生成拟态的提出是对经典的内皮依赖性肿瘤血管的补充,为部分临床肿瘤抗血管治疗效果不佳提供一合理的解释。通过体内实验笔者证实人参皂甙Rg3能够通过降低MMP-2、MMP-9的表达来抑制胰腺癌血管生成拟态的形成,该发现可能为临床治疗工作提供帮助。
1 Saif M, Lee Y,Kim R. Harnessing gemcitabine metabolism: a step towards personalized medicine for pancreatic cancer[J]. Ther Adv Med Oncol ,2012,4(6) 341-346
2 Maniotis AJ,Folberg R,Hess A,etal.Vascular channel formation by human melanoma cells in vivo and in vitro: vasculogenic mimicry[J].Am J Pathol,1999,155(3):739-752
3 Pan XY, Guo H, Han J,etal. Ginsenoside Rg3 attenuates cell migration via inhibition of aquaporin expression in PC-3M prostate cancer cells[J]. Eur J Pharmacol, 2012,683(1-3):27-34
4 Kim JW, Jung SY, Kwon YH,etal. Ginsenoside Rg3 attenuates tumor angiogenesis via inhibiting bioactivities of endothelial progenitor cells[J]. Cancer Biol Ther,2012,13(7):504-515
5 Zhang C, Liu L, Yu Y, et al. Antitumor effects of ginsenoside Rg3 on human hepatocellular carcinoma cells [J]. Mol Med Rep ,2012,5(5):1295-1298
6 Lee CK, Park KK, Chung AS,etal. Ginsenoside Rg3 enhances the chemosensitivity of tumors to cisplatin by reducing the basal level of nuclear factor erythroid 2-related factor 2-mediated heme oxygenase-1/NAD(P)H quinone oxidoreductase-1 and prevents normal tissue damage by scavenging cisplatin-induced intracellular reactive oxygen species[J]. Food Chem Toxicol,2012,50(7):2565-2574
7 Liu JP, Lu D, Nicholson RC,etal. Toxicity of a novel anti-tumor agent 20(S)-ginsenoside Rg3: a 26-week intramuscular repeated administration study in Beagle dogs[J]. Food Chem Toxicol, 2011,49(8):1718-1727
8 Sun B, Zhang S, Zhang D,etal. Wang Y: Doxycycline influences microcirculation patterns in B16 melanoma[J].Exp Biol Med :Maywood,2007, 23(2):1300-1307
9 Wei WT, Chen H, Ni ZL,etal. Antitumor and apoptosis promoting properties of emodin, an anthraquinone derivative from Rheum oficinale Baill, against pancreatic cancer in mice via inhibition of Akt activation[J]. Int J Oncol,2011, 39(2): 1381-1390
10 Seftor RE, Seftor EA, Koshikawa N,etal. Cooperative interactions of laminin 5gamma2 chain, matrix metalloproteinase-2, and membrane type-1-matrix/metalloproteinase are required for mimicry of embryonic vasculogenesis by aggressive melanoma[J]. Cancer Res,2001, 61(17): 6322-6327
11 Shin YM, Jung HJ, Choi WY,etal. Antioxidative, anti-inflammatory, and matrix metalloproteinase inhibitory activities of 20(S)-ginsenoside Rg3 in cultured mammalian cell lines[J]. Mol Biol Rep,2013. 40(1): 269-279
(修回日期:2015-01-06)
Effects of Ginsenosides Rg3 on Vasculogenic Mimicry of Pancreatic Cancer Xenograft.
JiangDandan,GuoJingqiang,ChenLiang.
DepartmentofHepatobiliarySurgery,FirstHospitalofJiaxing,Zhejiang314000,China
Objective To investigate the effects of ginsenosides Rg3 on vasculogenic mimicry of pancreatic cancer xenograft through the establishment of pancreatic cancer cell line SW-1990 subcutaneous xenograft model. Methods After pancreatic cancer xenograft in nude mice model beening established, All the mice were randomly divided into 4 groups and treated intraperitoneally (IP) with saline and various concentrations (5,10,20 mg/kg) of ginsenosides Rg3. To observe the effect of ginsenoside Rg3 on tumor growth. Immunohistochemical-PAS staining was used to detect the effects of ginsenosides Rg3 on vasculogenic mimicry of pancreatic cancer xenograft. and mRNA and protein expression of MMP2、MMP9 were respectively evaluated by FQ-PCR and Western blot. Results The ginsenosides Rg3 can inhibit the growth of the tumor xenografts in nude mice. The inhibitory effect is the most obvious the 20 mg/kg of ginsenosides Rg3 group. The expression of MMP-2, MMP-9 were down-regulated compare with the control group, and the difference was significant; the Immunohistochemical-PAS staining showed the number of vasculogenic mimicry (+) and CD31 (+) were less than that in the control group. Conlusion Our results demonstrate that pancreatic vascular mimicry formation can be suppressed by Ginsenoside Rg3 though reducing the expression of MMP-2, MMP-9 in our vivo experiments,
Pancreatic cancer; Xenograft model of pancreatic cancer; Vasculogenic mimicry; Matrix metalloproteinase
314000 嘉兴市第一医院(江丹丹、陈亮);310012 丽水市中心医院(郭敬强)
R6
A DOI 10.11969/j.issn.1673-548X.2015.10.035
2014-12-13)



