高 峰 李 凡 孙 婷 邹鹏林 刘 龙 金利芳 邵春娟 史秋生 杜联芳
胰腺癌(PaCa)是一种世界上最常见的恶性肿瘤,也是造成患者死亡的主要癌症之一[1]。在欧洲和美国,在与癌症相关的疾病致死案例中,PaCa排名第4位。虽然近些年来大量科研工作者不断提出新的方案来治疗PaCa,但其治愈率仍维持在一个很低的水平,给公共医疗和社会资源造成了巨大的负担[2]。研究显示,在PaCa常规化疗中存在的最主要问题之一是化疗药物渗透性差,难以通过细胞膜,造成癌细胞内药物浓度低,因此无法有效杀伤肿瘤[3,4]。超声分子影像学技术为解决这一问题提供了新的思路,特别是对于药物递送来说,超声靶向破坏微泡(ultrasound targeted microbubble destruction, UTMD) 技术可以利用微泡在超声介导下产生的空化效应增加血管及细胞膜通透性,促进抗癌药物或大分子进入细胞, 提高靶点细胞内的药物浓度,达到高效治疗并减少正常组织毒性不良反应的效果[5]。而且,UTMD技术具有造影效果,可以为实时监测肿瘤治疗效果提供便利[6]。另外,由于肿瘤部位细胞不受控制的增殖水平,需要大量的血管来输送营养物质及氧气,因此肿瘤位置血管生长丰富[7]。据文献报道,增殖细胞 Ki67 蛋白是一种与血管壁细胞增殖密切相关的核蛋白,抑制Ki67的表达可以降低血管细胞的生长水平,从而阻断肿瘤细胞的营养及氧气供应[8]。本课题组之前的研究结果显示,UTMD技术可以有效促进siRNA转染细胞,且通过超声定点照射病灶(肿瘤)位置,具有特异、高效的特点[9,10]。笔者在前期工作基础上,将抗癌模型药物紫杉醇(PTX)与Ki67沉默siRNA共给药治疗PaCa,并辅以UTMD研究其抗癌效果,为今后医学上治疗PaCa提供理论基础。
材料与方法
1.材料与试剂:PaCa细胞(SW1990) 购自中国科学院上海细胞库;1640培养基、胎牛血清、青霉素、链霉素、胰蛋白酶以及PBS缓冲液均购自美国Gibco公司;PTX购自北京百灵威科技有限公司;Ki67 siRNA合成及质粒构建购自上海吉玛科技公司;超声微泡造影剂声诺维(SonoVue) 购自意大利 Bracco 公司;CCK-8细胞活性检测试剂盒购自江苏凯基生物科技公司;SPF级雄性BALB/c 裸鼠 (6~8周, 体质量17~20g,购自上海Sippr-BK实验动物有限公司);PIPA组织裂解液、PMSF蛋白酶抑制剂以及BCA蛋白定量试剂盒均购自北京碧云天生物科技有限公司;Anti-Ki67抗体购自英国Abcam公司(ab15580),Anti-β-actin抗体购自美国Cell Signalling Technology 公司,二抗购自北京中杉金桥公司;PVDF膜和化学发光ECL试剂购自美国Millipore公司;Tween-20、伊红和苏木精染液均购自北京索莱宝生物试剂公司。
2.细胞培养及CKK-8法检测细胞存活率:购买的SW1990细胞培养在T25培养瓶中,内含5ml的RPMI-1640培养基,培养基中含有10%的胎牛血清, 青霉素 (100U/ml) 和链霉素(100mg/ml),所有培养的细胞静置于5%CO2、37℃恒温的培养箱中生长。当细胞长满培养瓶时,用胰蛋白酶消化下细胞,种入96孔细胞培养板中,每孔密度约为1×105个细胞/孔,每孔加入180μl全培养基培养24h。实验分组:(1)空白对照组:每孔细胞中加入20μl的PBS溶液。(2)PTX组:将PTX溶酝10%DMSO中,向每孔中加入20μl,使PTX溶液最终浓度为50μg/ml。(3)PTX+UTMD组:每孔中加入20μl PTX溶液以及50μl SonoVue溶液,维持每孔的总体积为200μl,使PTX最终浓度为50μg/ml,同时将超声探头涂抹少量耦合剂,贴于96孔板底部进行超声辐照,根据本课题组前期优化结果辐照条件选择:超声功率1.0W/cm2;占空比20%;辐照时间60s。(4)Ki67 siRNA组:每孔加入20μl Ki67 siRNA溶液,使Ki67 siRNA最终浓度为10μg/ml。(5)Ki67 siRNA+UTMD组:每孔中加入20μl Ki67 siRNA溶液以及50μl SonoVue溶液,使Ki67 siRNA最终浓度为10μg/ml,并进行超声辐照。(6)PTX+Ki67 siRNA+UTMD组:每孔中加入10μl PTX溶液同时加入10μl Ki67 siRNA溶液以及50μl SonoVue溶液,使PTX最终浓度为50μg/ml,Ki67 siRNA最终浓度为10μg/ml,并进行超声辐照。37℃ 孵育24h后,每孔加入10μl CCK-8溶液,37℃孵育4h后在酶标仪(PowerWave XS, Bio-Tek) 上450nm测量吸光度,每种用药设定6个副孔,每组实验重复3次。
3.动物造模及分组:36只BALB/c 裸鼠于20~22℃无菌环境下饲养,小鼠自由进食及进水,适应性喂养2周后,所有小鼠随机分为6组(每组6只),通过注射器在皮下组织注射150μl约 5×106个SW1990细胞,构建小鼠PaCa皮下瘤模型,造模位置在小鼠后背大腿上方。按照公式肿瘤体积V=长×宽×高×π/6记录皮下瘤直径,当V达到100~120mm3时,开始给药治疗,空白对照组(control组)给予荷瘤小鼠瘤内注射20μl生理盐水、PTX组注20μl PTX溶液 (5mg/kg)、Ki67 siRNA组注射20μl Ki67 siRNA质粒溶液(1mg/kg),每两天给药1次。辅助UTMD治疗组的荷瘤小鼠,在注射药物15min后,在小鼠眼眶后静脉注射(4ml/kg) SonoVue造影剂,然后将超声探头涂上耦合剂后置于皮下瘤组织,以超声功率1W/cm2进行超声辐照时间6min。给药15天后超声造影检测荷瘤小鼠瘤体抑制效果,30天后处死所有小鼠。
4.蛋白质免疫印迹(Western blot)法检测分析:体外培养的各治疗组SW1990细胞,胰蛋白酶消化后,3000r/min离心收集细胞,沸水浴中煮30min后提取总蛋白。荷瘤小鼠出死后的肿瘤组织,取约20mg置于加有PMSF的10% RIPA组织裂解液中匀浆提取样本总蛋白,BCA法定量总蛋白质浓度。各样本取50μg, 10%SDS-聚丙烯酰胺凝胶106V恒压电泳2.5h分离蛋白,将目的蛋白半干法转移到PVDF膜上, 5%脱脂奶粉中封闭2h后,加入Ki67一抗(1∶500)或β-actin (1∶2000)一抗, 4℃孵育过夜。取出膜带后,清洗3次,在室温下孵育相应的辣根酶标记二抗2h。最后在蛋白条带上加入ECL化学发光试剂,暗室曝光,压片于胶片上,扫描胶片,使用Image J专业图像分析软件扫描灰度值,用 β-actin标准化蛋白表达量,每组实验重复3次。
5.Ki67免疫组织化学(IHC)检测:所有荷瘤小鼠处死后,收集肿瘤组织经PBS冲洗干净后行免疫组织化学染色检测肿瘤组织内Ki67表达水平变化。各肿瘤组织样本浸于4%甲醛溶液中固定48h,取出后石蜡包埋,切片机上制成4μm组织切片,切片进行封闭2h, 加入一抗(Anti-Ki67抗体,1∶1000),摇床放置2h后4℃过夜, 加入二抗(1∶2000),封片,显微镜下采集图片。每个样本选取3个随机视野,观察视野中Ki67阳性细胞数。
6.HE组织学检测:按照免疫组织化学步骤收集肿瘤组织,并制成石蜡切片。分别加上伊红和苏木精溶液染色,DAB复染,制成HE染色切片。所有HE染色切片在光学显微镜下采图,收集图片,每个样本随机选取3个观察视野。
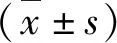
结 果
1.各组细胞药物处理后Ki67蛋白表达改变:体外培养的PaCa细胞(SW1990)经各组药物孵育24h后,经Western blot法检测发现,与PBS处理后的空白对照组比较,PTX处理后Ki67的蛋白表达水平未发生明显变化(P>0.05), 增加UTMD处理后也未能使Ki67的表达上升;而SW1990细胞在经过Ki67 siRNA处理后,Ki67的蛋白表达水平明显下降(P<0.05)。在加入UTMD处理后,Ki67的蛋白表达水平进一步降低,显示出UTMD对基因转染较强的促进作用,对细胞同时给予PTX和Ki67 siRNA处理,Ki67的下降水平与Ki67 siRNA组相似(图1)。

图1 SW1990细胞经各组药物处理后Ki67蛋白表达变化与空白对照组比较,*P<0.05
2.各组药物对PaCa细胞增殖的影响:细胞与药物共培养24h后,经CCK-8检测发现,与空白对照组比较,PTX对肿瘤细胞有明显的杀伤作用(P<0.05),而UTMD的辅助治疗增加了药物在细胞中的渗透性,使得细胞的存活率更低(P<0.01);Ki67 siRNA的孵育可以降低细胞中Ki67的表达,也会对细胞增殖有抑制作用,差异无统计学意义(P>0.05),但是UTMD的辅助使得其对细胞增殖的抑制作用增强,与空白对照组比较差异有统计学意义(P<0.05);PTX与Ki67 siRNA联合给药并辅以UTMD,显示出了最低的细胞存活率(P<0.01),其对肿瘤细胞的杀伤作用大于单独PTX与Ki67 siRNA效果之和(图2)。
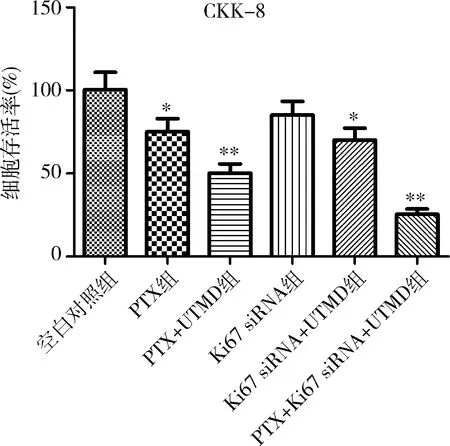
图2 SW1990细胞经各组药物处理后细胞存活率变化与空白对照组比较,*P<0.05,**P<0.01
3.UTMD介导的小鼠肿瘤组织超声造影:各组裸鼠在皮下SW1990细胞肿瘤造模成功后,予以各组药物治疗。15天后,经UTMD超声造影观察显示,空白对照组小鼠的肿瘤体积大,边缘清晰,血供丰富;PTX治疗后肿瘤体积缩小,血供开始减少,肿瘤中央出现空隙,说明其内部细胞开始坏死,而每次给药后的UTMD辅助,明显增加了肿瘤组织的坏死,中央空隙变得更大;Ki67 siRNA治疗组小鼠,也出现了肿瘤组织的坏死,以及血供减少现象,UTMD促进了肿瘤细胞对Ki67 siRNA的摄取,进一步减少了肿瘤内部血供;PTX+Ki67 siRNA+UTMD组肿瘤组织则明显缩小,血供稀少,中央几乎完全坏死(图3)。
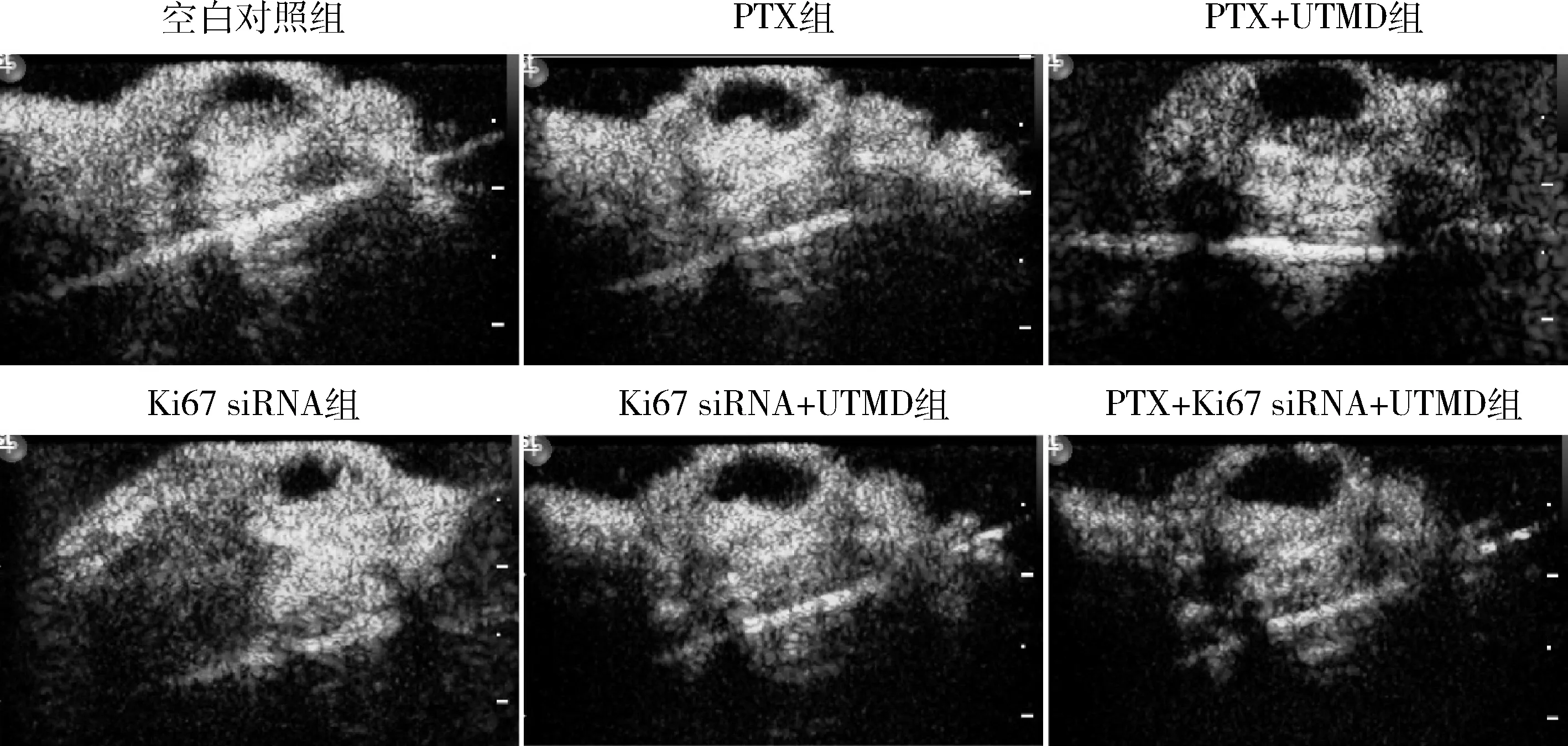
图3 荷瘤小鼠经各组治疗后第15天肿瘤组织的超声造影
4.Western blot法检测小鼠肿瘤组织Ki67变化:造模成功后,荷瘤小鼠经各组药物处理30天后,肿瘤组织经Western blot法检测结果显示,与空白体外细胞实验结果相似,与空白对照组比较,PTX没有对肿瘤组织Ki67的蛋白表达水平产生明显影响(P>0.05), 而在经过Ki67 siRNA处理后,Ki67的蛋白表达水平明显下降(P<0.05),且在加入UTMD处理后,Ki67的蛋白表达水平进一步降低(P<0.01);对荷瘤小鼠同时给予PTX和Ki67 siRNA注射,并辅以UTMD处理后,肿瘤组织中Ki67的表达水平也出现了明显的下降(P<0.01,图4)。
5.免疫组织化学检测各组小鼠肿瘤组织Ki67蛋白表达:PaCa荷瘤小鼠在经过各组药物处理30天后,肿瘤组织病理切片经Ki67抗体染色结果发现,与Western blot法结果相似,Ki67 siRNA顺利转染到了肿瘤细胞内,成功的抑制了Ki67蛋白的表达,而UTMD可以促进siRNA的转染,因此,与空白对照组比较,Ki67 siRNA以及Ki67 siRNA+UTMD组肿瘤组织内Ki67阳性细胞数显着降低,PTX+Ki67 siRNA+UTMD处理后肿瘤组织内Ki67阳性细胞的数量最低,而PTX对肿瘤细胞内Ki67的表达没有显着影响,详见图5。
6.各组荷瘤小鼠肿瘤组织形态结构变化:荷瘤小鼠在经过各组药物治疗30天后,肿瘤组织切片HE染色观察发现,经生理盐水处理的空白对照组小鼠肿瘤组织形态正常,细胞丰富,细胞核较大,胞质胞核,未见坏死现象;PTX或Ki67 siRNA处理后,小鼠肿瘤组织均出现不同程度坏死,癌细胞萎缩,细胞边缘开始皱缩,伴随片状坏死;而加助UTMD处理后,这两种药物处理后的肿瘤组织坏死程度都显着加深,其中PTX+Ki67 siRNA+UTMD处理后肿瘤的坏死程度最为显着,详见图6。

图4 肿瘤组织经各组药物处理后Ki67蛋白表达变化与空白对照组比较,*P<0.05,**P<0.01
图5 各组荷瘤小鼠肿瘤组织Ki67蛋白表达(IHC,×200)A.空白对照组;B.PTX组;C.PTX+UTMD组;D.Ki67 siRNA组;E.Ki67 siRNA+UTMD组;F.PTX+Ki67 siRNA+UTMD组
图6 各组荷瘤小鼠肿瘤组织形态结构变化(HE,×100)A.空白对照组;B.PTX组;C.PTX+UTMD组;D.Ki67 siRNA组;E.Ki67 siRNA+UTMD组;F.PTX+Ki67 siRNA+UTMD组
讨 论
在全球范围内,PaCa是发生率和病死率最高的恶性肿瘤之一,且其预后极差[9]。由于PaCa起病非常隐匿,在临床上大多数患者一经就诊发现时就已处于病程晚期,此阶段已无法通过手术切除的手段而控制病情。因此只能依靠服用抗肿瘤药物来控制病情,而目前常用的临床药物普遍存在靶向性差、对机体毒性不良反应强、易产生耐药性等缺点。PTX就是一种此类的化疗药物,临床上用药后,PTX不能高效地进入肿瘤细胞内发挥杀伤作用,游离在肿瘤细胞以外的PTX就会对正常组织产生损伤[10]。为此寻找其他的辅助治疗手段来增加化疗药物在肿瘤位置的靶向渗透性迫在眉睫。目前,已有大量研究证实UTMD能够通过瞬间空化作用增加细胞膜渗透性有效介导化疗药物及大分子进入细胞,从而发挥靶向性治疗作用。本研究通过CCK-8以及HE染色实验也证实,在对肿瘤细胞或荷瘤小鼠给药后,辅助UTMD处理,可以显着增加PTX的抗肿瘤效果,SW1990细胞存活率降到更低,肿瘤组织切片坏死更严重,这些都验证了UTMD促进药物渗透发挥杀伤作用的效果。
另一方面,基因治疗是当前一种肿瘤治疗的研究热点,通过特异性的沉默细胞内目标基因,抑制其功能蛋白的表达以此抑制肿瘤的增殖,达到抗肿瘤效果[11]。但是基因治疗同样存在着渗透性差、转染效率低的问题。本实验选择了一种与细胞增殖密切相关的蛋白质——Ki67。Ki67经常被用来评价细胞增殖活性和肿瘤的生长及恶性程度。将Ki67 siRNA与PTX联合用药来治疗PaCa。结果显示,PaCa细胞和荷瘤小鼠在经过Ki67 siRNA处理后,Ki67的蛋白表达水平都明显下降,且在加入UTMD处理后,Ki67的蛋白表达水平进一步降低。PTX没有对肿瘤细胞中Ki67的蛋白表达水平产生明显影响。HE结果也证明,UTMD处理能够显着加深PTX或Ki67 siRNA治疗后,小鼠肿瘤组织的坏死程度,而PTX+Ki67 siRNA+UTMD处理后肿瘤的坏死程度最为显着。除此之外,UTMD技术还可以造影成像,用来实时监测肿瘤的生长情况,笔者通过实验观察到UTMD促进了肿瘤细胞对Ki67 siRNA和PTX的摄取,进一步减少了肿瘤内部血供,促进了肿瘤组织坏死。
综上所述,UTMD技术具有高效、实用、靶向以及可成像等优点,可以作为临床化疗和基因治疗的辅助手段来治疗PaCa,是未来的研究发展方向之一,将UTMD和其他疗法联合在肿瘤的治疗中必将具有极为广阔的应用前景。



