骆 秦 陶维俊 王梦卉 汪迎春 李南方
阻塞性睡眠呼吸暂停(OSA)是一种病因尚不十分明确的睡眠呼吸障碍性疾病,其发生率高、可致多个系统受损,对患者的身心健康产生不良影响。该病可引起间歇性低氧、高碳酸血症以及睡眠结构紊乱,并可导致高血压、冠心病、心律失常、认知功能障碍、糖尿病等疾病。流行病学调查结果显示,OSA发生率在美国约为2.90%,印度约为3.57%,而在日本人群中约为6.10%[1~4]。以往的研究表明,OSA在高血压专科的检出率可达24.7%[5]。
高血压(hypertension,HTN)是OSA的常见临床表现之一,是一种高致死率、高致残率的常见慢性疾病。研究结果显示,HTN和OSA有着密切的关系,根据2008年美国心脏协会和美国心脏病学基金会(AHA/ACCF)联合发表的《睡眠呼吸暂停与心血管疾病科学声明》,目前至少30%的高血压患者伴有OSA,约有50%~60% 的OSA患者合并有高血压[6]。OSA导致高血压的发病机制目前尚不明确,主要有以下几种假说来解释这种关系,如肾素-血管紧张素-醛固酮系统(RAAS)激活、交感神经系统激活、氧化应激、炎性反应、脂肪因子的激活等,其中RAAS激活在OSA合并高血压患者中较受关注[7]。多项研究显示血浆肾素活性(PRA)及血浆醛固酮水平(PAC)能够反映RAAS的活跃程度。一项来自欧洲的病例对照研究发现OSA患者的PRA明显高于正常人群[8]。而Barcelo等[9]的研究却未发现PRA在OSA患者和正常人群中存在明显差异。但是,Di Murro等[10]的研究结果却恰恰与之相反,他们发现在OSA患者中PRA反而低于正常对照人群。一项Meta分析显示,高血压合并OSA患者的PRA和PAC水平的研究结果不相一致,提示不同研究人群的结果存在差异[11]。
本研究针对高血压合并不同严重程度OSA患者的PRA、PAC进行分析比较,探讨OSA严重程度对高血压患者PRA及PAC的影响。
资料与方法
1.一般资料:回顾2008年10月~2010年12月收住于新疆维吾尔自治区人民医院高血压诊疗中心的高血压患者的住院资料,按照诊断及排除标准纳入符合条件的290例患者,其中男性222例,女性68例,患者年龄22 ~71岁。
纳入标准:①完善标准状态下PRA、PAC测定的高血压患者(见检测方法);②存在夜间睡眠过程中打鼾、呼吸暂停、憋醒或白天嗜睡、口干等症状;③完成夜间多导睡眠监测(polysomnography, PSG)。排除标准:①经过严格的体格检查、仔细的病史询问和记录、实验室检查(血常规、尿常规、肾功能、甲状腺功能、肾素、醛固酮、静脉盐水负荷试验、皮质醇节律、血儿茶酚胺、尿儿茶酚胺测定等)、辅助检查如肾动脉超声(测量双肾大小)、核素扫描、影像学检查等,经专科医生综合判断原发性醛固酮增多症、肾动脉狭窄、肾实质性高血压、嗜铬细胞瘤、库欣综合征等继发性高血压;②中枢性睡眠呼吸暂停综合征患者;③患有哮喘、急慢性阻塞性肺疾病、间质性肺疾病、肺结核、支气管扩张等呼吸系统疾病的患者;④6个月内的心脑血管事件患者;⑤严重肝脏、肾脏功能不全者;⑥不能成功完善PSG者及睡眠效率低于60%患者。OSA诊断标准:根据阻塞性睡眠呼吸暂停低通气综合征(OSAHS)诊治指南[12],按睡眠呼吸暂停低通气指数(AHI)将研究对象分为OSA组(AHI≥5次/小时)和非OSA组(AHI<5次/小时);OSA严重程度根据AHI水平分为轻度(AHI:5~15次/小时)、中度(AHI:15~30次/小时)、重度(AHI>30次/小时)。
2.问卷调查:采用中华医学会呼吸病学分会睡眠呼吸疾病学组编制的《睡眠呼吸暂停与高血压发病情况问卷调查表》;问卷内容主要包括:姓名、性别、年龄、民族、职业、身高、体重[计算体重指数(BMI)=体重(kg)/身高(m)2]、腰围、睡眠相关体征及收缩压(SBP)、舒张压(DBP)水平;根据问卷调查表结果建议有OSA高危因素的患者完善多导睡眠监测(PSG)。
3.多导睡眠监测:监测采用澳大利亚Compumedics 公司生产的44道睡眠监测仪。软件为Profusion PSG 睡眠分析软件,监测项目包括脑电图、颌下肌电图、眼动电图、鼻口气流、胸腹运动、血氧饱和度、心电图、腿动、体位,均完成每天夜里7h以上的睡眠监测。所有研究对象监测前禁饮用茶、咖啡等饮料,避免使用镇静催眠药物。记录呼吸暂停低通气指数(AHI)、最低血氧饱和度(LSaO2)、平均血氧饱和度(MSaO2)、氧减饱和度指数(ODI3、ODI4)和血氧饱和度低于 90%的时间所占总睡眠时间比例(TST90)等指标。睡眠的分期根据当前的判定标准分为睡眠1期、睡眠2期、睡眠3期、睡眠4期和REM期,总睡眠时间的计算为前述各期的总和,睡眠各期占睡眠总时间的比例表述为睡眠各期的睡眠时间百分比。睡眠分期采用Rechtshaffen and Kales′ 法评定。
4.PRA和PAC水平检测方法:所有纳入者在测定PRA、PAC前均停用血管紧张素转换酶抑制剂(ACEI)、血管紧张素受体拮抗剂(ARB)、双氢吡啶类钙拮抗剂(CCB)、β受体阻滞剂至少4周;利尿剂、盐皮质激素受体拮抗剂至少6周。需要降压的患者给予对PRA、PAC检测影响较小的降压药物:维拉帕米缓释片或甲磺酸多沙唑嗪片,二者单用或联用。所有受试者于次日清晨起床后空腹,保持坐位至少15min,于上午9:00时分别采集2管肘静脉血各5ml送往新疆维吾尔自治区高血压研究所临床检测室检查;采用放射免疫法测定坐位PAC、PRA。
结 果
1.两组间一般临床资料、PRA和PAC的比较:与非OSA组比较,OSA组患者的年龄、BMI、腹围、AHI、ODI较高,氧饱和度较低(包括MSaO2、LSaO2),差异均有统计学意义(P<0.05),两组间的PRA和PAC比较差异无统计学意义(表1)。
表1 OSA组和非OSA组两组间的一般临床资料的比较
2.50岁以下高血压患者中两组间一般临床资料、PRA和PAC的比较:以往的研究显示,50岁以上高血压患者的PRA和PAC均下降,且PRA下降较PAC更明显[13]。因此,为排除年龄的潜在影响,笔者进一步分析比较50岁以下高血压患者在OSA(n=161)与非OSA(n=64)的一般临床资料,结果显示,与非OSA组比较,OSA组的舒张压、BMI、腹围、AHI及ODI较高,氧饱和度 (包括MSaO2、LSaO2) 水平较低(P<0.05),两组间的年龄、PRA、PAC及ARR比较差异无统计学意义,详见表2。
表2 50岁以下的非OSA组与OSA组的一般临床资料的比较
3.50岁以下高血压患者合并不同程度OSA的一般临床资料比较:进一步分析50岁以下高血压患者合并不同程度OSA (n=161)的临床资料:与轻度及中度OSA比较,重度OSA患者的舒张压、BMI均较高,重度OSA患者的腹围较轻度OSA患者显着增加(P<0.05)。PRA在轻、中、重度OSA患者中逐步递增,在轻度与重度之间差异有统计学意义[1.24±0.96ng/(ml·h) vs 1.82±1.18ng/(ml·h),P<0.05], 但在轻度与中度以及中度与重度之间比较,差异无统计学意义(P>0.05)。PAC水平在重度OSA患者中明显高于轻度OSA (15.3±6.7ng/dl vs 12.3±4.3ng/dl,P<0.05)及中度OSA患者 (15.3±6.7ng/dl vs 12.0±4.5ng/dl,P<0.05),详见表3。
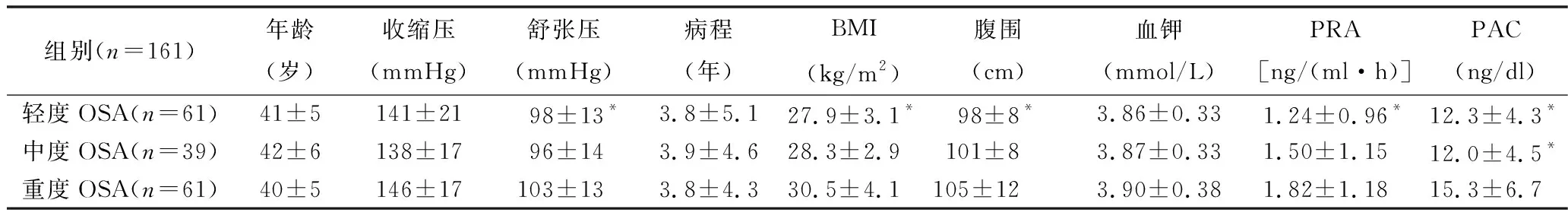
表3 不同程度OSA患者一般临床资料、实验室检查的比较
4.50岁以下高血压合并OSA患者基线及PSG参数与PRA和PAC的Spearman相关性分析:与PRA的相关性分析显示,年龄与PRA存在负相关(r=-0.26,P=0.010),AHI (r=0.24,P=0.002)、ODI3(r=0.24,P=0.002)、ODI4(r=0.24,P=0.002) 均与PRA呈正相关。与PAC的相关性分析显示,AHI(r=0.20,P=0.011)、 ODI3(r=0.22,P=0.004)、ODI4(r=0.20,P=0.011) 与PAC呈正相关(表4)。

表4 基线及PSG参数与PRA、PAC之间的Spearman相关分析
5.50岁以下高血压合并OSA患者PSG参数与PRA的多元线性回归分析:以PRA为因变量、有相关意义的指标为自变量采用逐步进入的方法进行多元线性回归分析,结果显示,年龄与PRA呈独立负相关 (β=-0.051,P=0.01),与AHI呈独立正相关(β=0.009,P=0.014),详见表5。
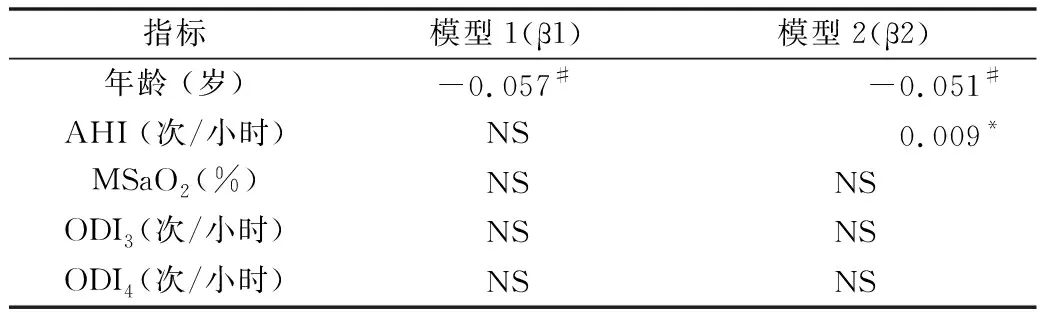
表5 PSG参数与PRA的多元线性回归分析
讨 论
阻塞性睡眠呼吸暂停是一种独立于年龄、体重、饮食和遗传等因素引起高血压发生、发展的重要危险因素,也是较为常见的一种继发性高血压,而且与心力衰竭、缺血性心脏病和脑血管病均有一定关系[5,14]。RAAS在血压的调控中起到了重要的作用,其与心血管疾病包括高血压在内的关系已经被确立[15]。笔者单位研究表明,随着年龄的增加,PRA和PAC的水平均下降,且与PAC比较,PRA下降幅度较大。但以往对高血压合并OSA患者的PRA、PAC的研究结果存在争议,因此,在排除年龄因素的干扰下,进一步探讨OSA严重程度对高血压患者肾素及醛固酮水平的影响。
本研究显示,在不同程度OSA患者的亚组分析中,PRA在轻中重度OSA患者中逐步递增,PRA在重度OSA患者中最高。Spearman相关分析显示,高血压合并OSA患者的年龄与PRA呈负相关,睡眠呼吸暂停参数AHI、ODI3、ODI4均与PRA呈正相关,MSaO2与PRA呈负相关;多元性线性回归分析显示,年龄及AHI与PRA的水平独立相关。在与OSA相关的可能导致血压升高的几个因素中,间歇性夜间低氧血症和部分睡眠不足是交感神经活性增加的重要机制,而交感神经兴奋性增加在肾素释放和高血压中起着关键作用。但以往研究显示,OSA患者的RAAS的研究结果并不一致。Raff等[16]在动物实验中研究发现严重的高碳酸血症和低氧血症增加了PRA和PAC。同样,在一个连续纳入325例新诊断的高血压患者的研究中,OSA患者的PRA与AHI之间呈正相关[9]。本研究与这些研究结果相一致。这些研究结果均提示随着OSA的严重程度增加,其RAAS活性增加。然而,Murro等[11]却发现OSA组的PRA显着低于健康对照组,由于其研究对象为OSA合并原发性醛固酮增多症(PA),而PA是由于肾上腺皮质自主分泌过量醛固酮,导致体内潴钠排钾,血容量增多,肾素-血管紧张素系统活性受抑制的一种疾病,其主要表现为高血压伴低血钾,在临床中常与OSA共存[17]。有研究者认为这两种疾病之间存在双向关系,即PA患者高醛固酮分泌引起钠水潴留,夜间液体重新分布引起上气道咽周水肿,增加气道阻力进而加重OSA的严重程度,而OSA患者反复夜间低氧可能激活肾素-血管紧张素系统,从而提高醛固酮水平,进一步升高血压[18]。
另外,本研究还显示,与轻度及中度OSA患者比较,重度OSA患者的PAC水平也明显升高,且相关分析显示AHI、ODI水平与PAC呈正相关。De Souza等[19]研究表明,在难治性高血压患者中,在不受BMI、动态血压水平和螺内酯使用的影响下,OSA严重程度与PAC和24h尿醛固酮有关。Jin等[8]最近发表的一项纳入13篇文献的Meta分析表明,在高血压中OSA与较高的AngⅡ和醛固酮水平有关,OSA患者血压增高的原因至少部分是通过激活RAAS活性引起的。杨丽睿等[20]的研究也证实了醛固酮水平较高的难治性高血压患者通过醛固酮引起水钠潴留,夜间液体重新分布引起上呼吸道狭窄及咽周水肿,增加气道阻力进而加重OSA的严重程度。
综上所述,本研究显示,在50岁以下高血压合并OSA患者中,PRA、PAC水平与OSA严重程度呈正相关,并在重度OSA患者中最高,提示OSA可能通过反复夜间低氧激活RAAS,这可能在OSA患者血压升高过程中起重要作用。由于本研究为横断面研究,尚不能得出OSA与RAAS之间的因果关系,仍需要开展大规模、前瞻性、干预性研究来进一步证实。



