孙桂芳 王孝微 张 静
慢性心力衰竭(chronic heart failure,CHF)时缺血缺氧、神经体液因子释放增加,导致机体活性氧(reactive oxygen species,ROS)产生过多,抗氧化能力降低,出现氧化应激[1~3]。ROS包括超氧阴离子、羟自由基等产物,导致心肌细胞凋亡、肥厚,心脏胶原合成,参与心肌重构及心脏功能障碍[4,5]。
黄嘌呤氧化酶(xanthine oxidase,XO)是机体产生ROS的主要酶之一[6]。研究证实,CHF时心脏XO表达及活性增强,导致心肌ROS生成过多[7,8]。ROS作用于细胞膜脂质,产生代谢终产物丙二醛(malondialdehyde,MDA)。别嘌呤醇(allopurinol,ALLO) 抑制XO,减少超氧阴离子、过氧化氢等ROS产物。本研究应用大剂量异丙肾上腺素(isoproterenol,ISO)建立CHF动物模型,给予ALLO治疗,观察心脏结构及功能、心脏XO活性及MDA含量变化,以评价其治疗效果并探究机制[9]。
材料与方法
1.CHF动物模型建立及实验分组:36 只Wistar 雄性大鼠, 体质量180~220g,哈尔滨兽医研究所动物实验中心提供。28 只大鼠腹部皮下注射 ISO(美国Sigma公司),剂量为340mg/kg,间隔24h,重复注射1次,随机分为CHF组及ALLO组,每组14只。8只大鼠腹部皮下注射0.9%氯化钠注射液作为对照组。ALLO组自实验第3天起每天给予ALLO(广东彼迪药业有限公司)灌胃,剂量为50mg/kg。CHF组、对照组给予0.9%氯化钠注射液灌胃,连续8周。
2.心脏彩超检查:8周后,大鼠给予戊巴比妥钠(上海生物化学制药厂)腹腔注射,剂量为40mg/kg。麻醉后取平卧位,应用Vevo 770型号超声心动仪(加拿大Visual sonics公司)检查。探头置于左侧胸前,取得二维超声心动图左室长轴切面,在此切面上将取样线置于腱索水平获得M型超声左心室波群,测量左心室收缩末内径(left ventricular end-systolic diameter,LVDs)、舒张末内径(left ventricular end-diastolic diameter,LVDd),记录左心室射血分数 (left ventricular ejection fraction,LVEF)、短轴缩短率(left ventricular fractional shortening,LVFS)。测量3个不同的心动周期,每个指标取均值。
3.测量左心室重量/体质量:分离出左心室, 用电子天平(浙江东新仪器设备有限公司)称重, 计算左心室重量/体质量。液氮保存左心室心肌,-80℃冰箱保存。
4.左心室病理检查:截取左心室室间隔中间段心肌, 以4%多聚甲醛溶液固定24h以上,常规石蜡包埋,均匀间断切片5~10张,层厚5μm,行HE染色。
5.左心室超微结构检查:取左心室心内膜心肌,经3%戊二醛前固定、1%锇酸后固定,丙酮梯度脱水,环氧树脂常规包埋,制作超薄切片,醋酸轴、枸椽酸铅双重染色,应用JEM-1220型号透射电镜(日本电子公司)观察心肌超微结构。
6.测定心肌蛋白含量:采用考马斯亮蓝法。用电子天平称重心肌组织,小剪刀剪碎,迅速置于冰浴中的微型手动匀浆器中,加入组织重量9倍的4℃ 0.9%氯化钠注射液,研磨10min制成匀浆,以3000r/min离心15min,然后取上清液用0.9%氯化注射液配制成2%的组织匀浆,按照考马斯亮蓝蛋白测定试剂盒(南京建成生物工程研究所)步骤进行测定。
7.测定心肌XO活性:基于底物次黄嘌呤,在XO的催化下,生成过氧化氢,然后借助过氧化酶的作用,与对羟基苯甲酸和氨基安替比林反应,形成有色醌亚胺,通过其吸收峰值的变化,来定量分析黄嘌呤氧化酶的活性。取心肌组织匀浆液,按照XO测试盒(南京建成生物工程研究所)说明书进行测定。
8.测定心肌MDA含量:利用硫代巴比妥酸与MDA反应,生成硫代巴比妥酸反应物质(thiobarbituric acid reactants,TBARS)。按照TBARS测试盒(南京建成生物工程研究所)说明书步骤检测心肌组织匀浆液MDA 的含量。单位为纳摩尔/毫克(nmol/mg)。
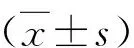
结 果
1.CHF动物模型建立情况:8周后CHF组大鼠存活9只,存活率为64.3%。ALLO组大鼠存活11只,存活率为78.6%。两组存活率比较差异无统计学意义(P>0.05)。CHF组LVEF<50%,证实CHF模型成立。
2.心脏彩超检查:与对照组比较,CHF组及ALLO组LVDs、LVDd增加(P<0.05),LVEF、LVFS降低(P<0.05)。与CHF组比较,ALLO组LVDs、LVDd降低(P<0.05),LVEF、LVFS升高(P<0.05),详见表1。
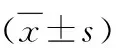
表1 心脏彩超检查结果
3.左心室重量/体质量:与对照组比较,CHF组、ALLO组显着升高(P<0.05),分别为1.61±0.20、2.12±0.18、1.85±0.16mg/g。ALLO组显着低于CHF组(P<0.05)。
4.左心室HE染色:与对照组比较,CHF组心内膜下心肌水肿,散在凝固性坏死,胶原沉积。ALLO组心肌水肿、坏死及胶原沉积较CHF组改善(图1)。
5.心肌超微结构检查:CHF组肌节崩解、消失,线粒体肿胀、嵴断裂。ALLO组上述病变改善(图2、图3)。
6.心脏XO活性及MDA含量测定:与对照组比较,CHF组、ALLO组心脏XO活性、MDA含量显着升高(P<0.05)。ALLO组XO活性、MDA含量显着低于CHF组(P<0.05),详见表2。
讨 论
大鼠皮下注射大剂量ISO,激动心脏β-肾上素能受体,出现心肌细胞内氧化应激、炎性介质释放、Ca2+超载等多种损伤,导致心肌急性坏死,产生心肌重构及心脏功能障碍[10,11]。CHF组心脏XO活性及MDA含量增加,证实氧化应激参与CHF。与对照组比较,ISO注射8周后存活大鼠心肌病理显示坏死、纤维化、肌节崩解及线粒体破坏,左心室肥厚并扩张以及收缩功能降低,说明CHF模型成立。
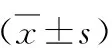
表2 心脏XO活性及MDA含量
应用ALLO治疗CHF大鼠,减轻心肌水肿、坏死、纤维化、超微结构损伤,降低左心室重量/体质量、LVDs、LVDd,提高左心室收缩功能,说明ALLO有效治疗CHF。本研究给予CHF大鼠ALLO治疗8周,减轻左心室肥厚及扩张,表明其逆转心肌重构,阻遏了CHF的病理生理进程。动物实验证实ALLO改善心肌梗死大鼠非梗死区域心肌重构,ALLO提高左心室容量负荷过重大鼠心脏收缩功能[12,13]。临床研究证实ALLO有效治疗CHF患者[7,14,15]。
机体通过多条途径产生ROS,包括儿茶酚胺单胺氧化酶途径、线粒体电子呼吸链途径、NADPH氧化酶途径、XO途径等[16]。其中XO是心肌产生ROS的主要酶之一[6]。XO作用于次黄嘌呤、黄嘌呤,生成尿酸、过氧化氢、超氧阴离子等产物。过氧化氢、超氧阴离子这些ROS产物使磷脂分子中不饱和脂肪酸氧化生成过氧化脂质,产生毒性终产物MDA[17]。MDA损伤生物膜,引起蛋白质、核酸等生命高分子的交联聚合,是反映氧自由基损伤的指标之一[18]。ALLO降低CHF大鼠心脏XO活性和MDA含量,表明ALLO拮抗XO降低CHF心脏膜脂过氧化。
MDA损伤心肌细胞膜、线粒体等细胞器生物膜。ALLO减少CHF大鼠心脏MDA,改善心肌水肿及线粒体肿胀,有助于减少心肌坏死及纤维化,从而抑制左心室肥厚及扩张等代偿性反应。既往研究证实MDA破坏心脏线粒体结构,干扰心脏能量代谢,导致肌浆网Ca2+摄取异常,出现心肌细胞内Ca2+超载,引起心脏收缩及舒张功能异常[19,20]。本研究中ALLO提高CHF大鼠LVEF是否与改善心脏能量代谢及心肌细胞Ca2+通路有关,需要进一步研究证实。今后开展的研究可观察ALLO对CHF心脏线粒体呼吸链复合物的活性变化来评价其对能量代谢的影响,以及应用膜片钳和荧光探针钙图像分析技术记录心肌细胞内Ca2+浓度变化来探究对Ca2+通路的影响。本研究显示ALLO可抑制心脏XO活性,延缓CHF进展,为其治疗提供新的手段。



