杨杰智 倪明立 徐 倩 杨明月 王 宁 吕红琼 黄 静
乳腺癌是女性最常见的恶性肿瘤之一,发生率呈逐年上升趋势[1, 2]。早期乳腺癌患者经手术联合放化疗预后较理想,然而晚期乳腺癌患者目前尚缺乏有效治疗手段,寻找乳腺癌的早期诊断标志物和分子治疗靶点具有重要临床价值[3]。环状RNA(circRNA)是一类内源性非编码RNA,来源于前体信使RNA(mRNA)反向剪接[4]。circRNA的稳定性较高,可通过多种机制影响基因表达,参与调控细胞的生理活动[5]。越来越多的circRNA被发现在肿瘤细胞的生长、转移中发挥重要作用,影响肿瘤的发生、发展[6]。circRNA已成为乳腺癌分子研究领域的热点。hsa_circ_0024707是一种新发现的circRNA,尚未被报道研究过,其在乳腺癌细胞中的作用亦不明确。本研究通过检测hsa_circ_0024707在乳腺癌组织和乳腺癌细胞株中的表达,并以乳腺癌细胞株为研究对象, 探讨hsa_circ_0024707对乳腺癌细胞增殖和侵袭的影响及其作用机制, 为circRNA分子靶向治疗研究提供实验依据。
材料与方法
1.材料:(1)临床标本:收集2016年3月~2018年7月于笔者医院行手术切除治疗的乳腺癌临床标本53例,包括乳腺癌组织和距离肿瘤边缘超过5cm的癌旁组织,术后均经病理医生确认为乳腺浸润性导管癌。患者年龄为28~65岁,平均年龄为46.89±8.52岁。组织学分级Ⅱ级18例,Ⅲ级35例,TNM分期T1期5例,T2期29例,T3期19例。患者术前均未行放化疗,本研究经笔者医院医学伦理学委员会批准, 参与患者均签署知情同意。(2)细胞与试剂:人乳腺癌细胞株SKBR3、BT549、MCF7、MB-MDA-468、HCC1937和永生化乳腺上皮细胞MCF-10A购自中国科学院上海细胞库;实时定量聚合酶链反应(qPCR)试剂盒购自大连宝生物试剂公司;qPCR引物由上海生工生物工程有限公司合成;载有hsa_circ_0024707的慢病毒和空载慢病毒由上海汉恒科技有限公司合成;小牛血清、DMEM/F12培养基、RPMI-1640培养基均购自美国Gibco公司;CCK-8试剂盒购自上海碧云天生物技术有限公司;Transwell小室购自美国Costar公司;抗体(SPRY2、Wnt、β-catenin、GSK-3β、APC、α-tubulin)、Matrigel基质胶购自美国BD公司。
2.细胞培养和慢病毒感染:人乳腺癌细胞株MB-MDA-468和永生化乳腺上皮细胞MCF-10A复苏后,培养于含10%胎牛血清的DMEM/F12培养基中,乳腺癌细胞株SKBR3、BT549、MCF7、HCC1937复苏后,培养于含10%胎牛血清的RPMI-1640培养基,在37℃、5% CO2培养箱中培养。将对数期生长的BT549细胞接种在6孔细胞板,细胞融合度为50%时,选择感染复数(MOI)=50,根据慢病毒说明书进行操作,采用慢病毒感染BT549细胞。12h后观察细胞状态并更换新鲜培养基。
3.实时定量聚合酶链反应(qPCR)检测:采用Trizol法提取乳腺癌组织和乳腺癌细胞株总RNA,反转录合成cDNA后行qPCR检测。以GAPDH为内参基因,检测组织或细胞中hsa_circ_0024707和SPRY2 mRNA的相对表达量。以U6为内参基因,检测细胞中miR-448的相对表达量。U6上游引物:5′-CTCGCTTCGGCAGCACA-3′,下游引物:5′-AACGCTTCACGAATTTGCGT-3′;GAPDH上游引物:5′-GGAGCGAGATCCCTCCAAAAT-3′,下游引物:5′-GGCTGTTGTCATACTTCTCATGG-3′;miR-448上游引物:5′-GGGCAGTGCGTGTCG-3′,下游引物:5′-CAGTGCGTGTCGTGGAGT-3′;hsa_circ_0024707上游引物:5′-TGCACAGGGGAAGGAAATAA-3′,下游引物:5′-GATGATGGGGTTGCAAACTT-3′;SPRY2上游引物:5′-CCTACTGTCGTCCCAAGACCT-3′,下游引物:5′-GGGGCTCGTGCAGAAGAAT-3′。qPCR值采用2-ΔΔCt方法进行计算。
4.CCK-8检测:将感染后的BT549细胞接种于96孔板。CCK-8方法连续检测5天,绘制细胞生长曲线。检测时,每孔加5mg/ml的CCK-8试剂10μl,培养箱培养4h,每孔加150μl二甲基亚砜,SpectraMax plus384型全波长酶标仪检测每孔在波长450nm处的吸光度(A)值。
5.Transwell侵袭实验:采用Matrigel基质胶制备Transwell小室上室;将感染后的BT549细胞用血清培养基重悬后,接种于Transwell小室上室;下室加入含10%FBS的RPMI-1640培养基;培养24h后,取出上室,多聚甲醛固定10min,0.1%的结晶紫染液染色10min,棉签拭去上室未穿膜的细胞,PBS溶液漂洗;晾干后,采用倒置显微镜计数穿膜细胞数并统计。
6.生物信息学技术预测:starBase v2.0靶基因预测数据库预测hsa_circ_0024707的下游miRNA,TargetScan Release 3.1靶基因预测数据库预测miRNA的下游mRNA。
7.蛋白免疫印迹(Western blot)法:将感染后的BT549细胞裂解并提取总蛋白,采用十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶(PAGE)电泳,聚偏氟乙烯(PVDF)膜转膜,5%脱脂牛奶封闭1h。加入一抗SPRY2(1∶1000稀释)、Wnt(1∶2000稀释)、β-catenin(1∶500稀释)、GSK-3β(1∶2000稀释)、APC(1∶2000稀释)、α-tubulin(1∶3000稀释),4℃孵育过夜,在室温下二抗孵育2h。ECL显影液在凝胶成像系统显影。
结 果
1.hsa_circ_0024707在乳腺癌组织中的表达:qPCR结果显示,hsa_circ_0024707在乳腺癌组织和癌旁组织中的表达分别为1.73±0.46和4.53±0.76,hsa_circ_0024707在乳腺癌组织中呈低表达(P<0.05)。
2.hsa_circ_0024707在乳腺癌细胞中的表达:qPCR结果显示,hsa_circ_0024707在SKBR3、BT549、MCF7、MB-MDA-468、HCC1937细胞株和永生化乳腺上皮细胞MCF-10A中的表达量分别为0.75±0.03、0.12±0.02、0.37±0.02、0.52±0.05、0.39±0.01和1.00±0.05,相比永生化乳腺上皮细胞MCF-10A,hsa_circ_0024707在乳腺癌细胞株中表达下调,差异均有统计学意义(P均<0.01)。hsa_circ_0024707在BT549细胞表达降低最明显(P<0.01),故以BT549细胞为对象进行研究,详见图1。
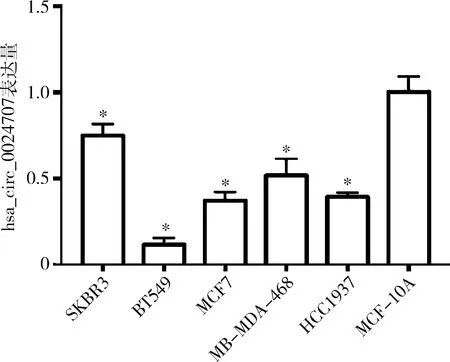
图1 hsa_circ_0024707在永生化乳腺上皮细胞株和乳腺癌细胞株中的表达
3.qPCR检测感染后BT549细胞中hsa_circ_0024707的表达:qPCR结果显示,对照组和实验组乳腺癌BT549细胞中hsa_circ_0024707的表达分别为1.02±0.09和8.05±0.76,差异有统计学意义(P<0.01),证明外源性hsa_circ_0024707在BT549细胞中成功表达。
4.hsa_circ_0024707对乳腺癌BT549细胞增殖的影响:采用CCK-8法检测hsa_circ_0024707过表达对 BT549细胞增殖能力的影响,与对照组比较,实验组BT549细胞从第3天开始,细胞增殖能力明显降低,差异有统计学意义(P<0.05),见图2。
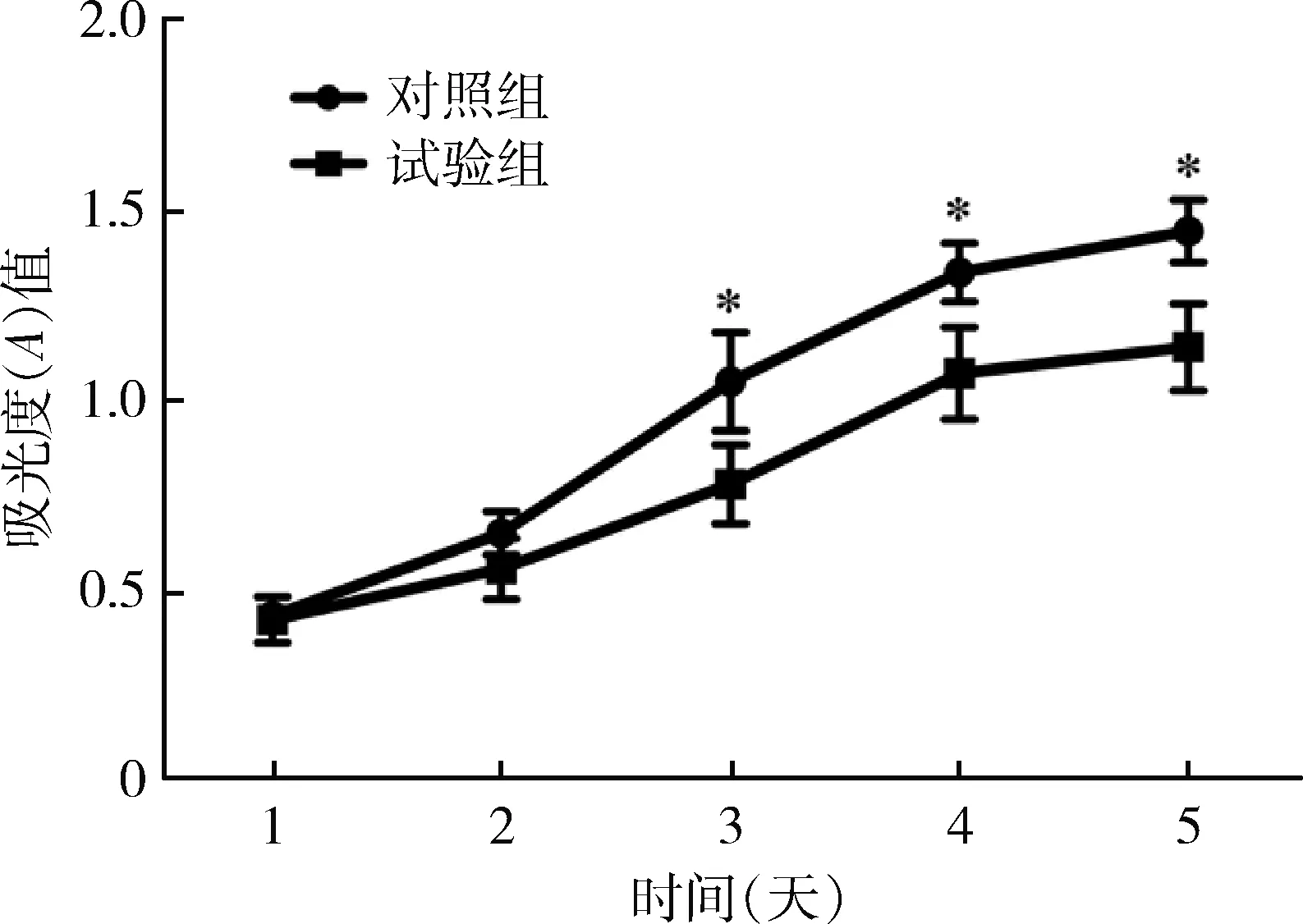
图2 hsa_circ_0024707过表达对乳腺癌BT549细胞增殖的影响
5.hsa_circ_0024707对乳腺癌BT549细胞侵袭的影响:采用Transwell侵袭实验检测hsa_circ_0024707过表达对 BT549细胞侵袭的影响,对照组和实验组BT549穿膜细胞数分别为82.46±8.49和38.34±8.84,差异有统计学意义(P<0.05),证明hsa_circ_0024707过表达能抑制乳腺癌细胞BT549的侵袭,详见图3。
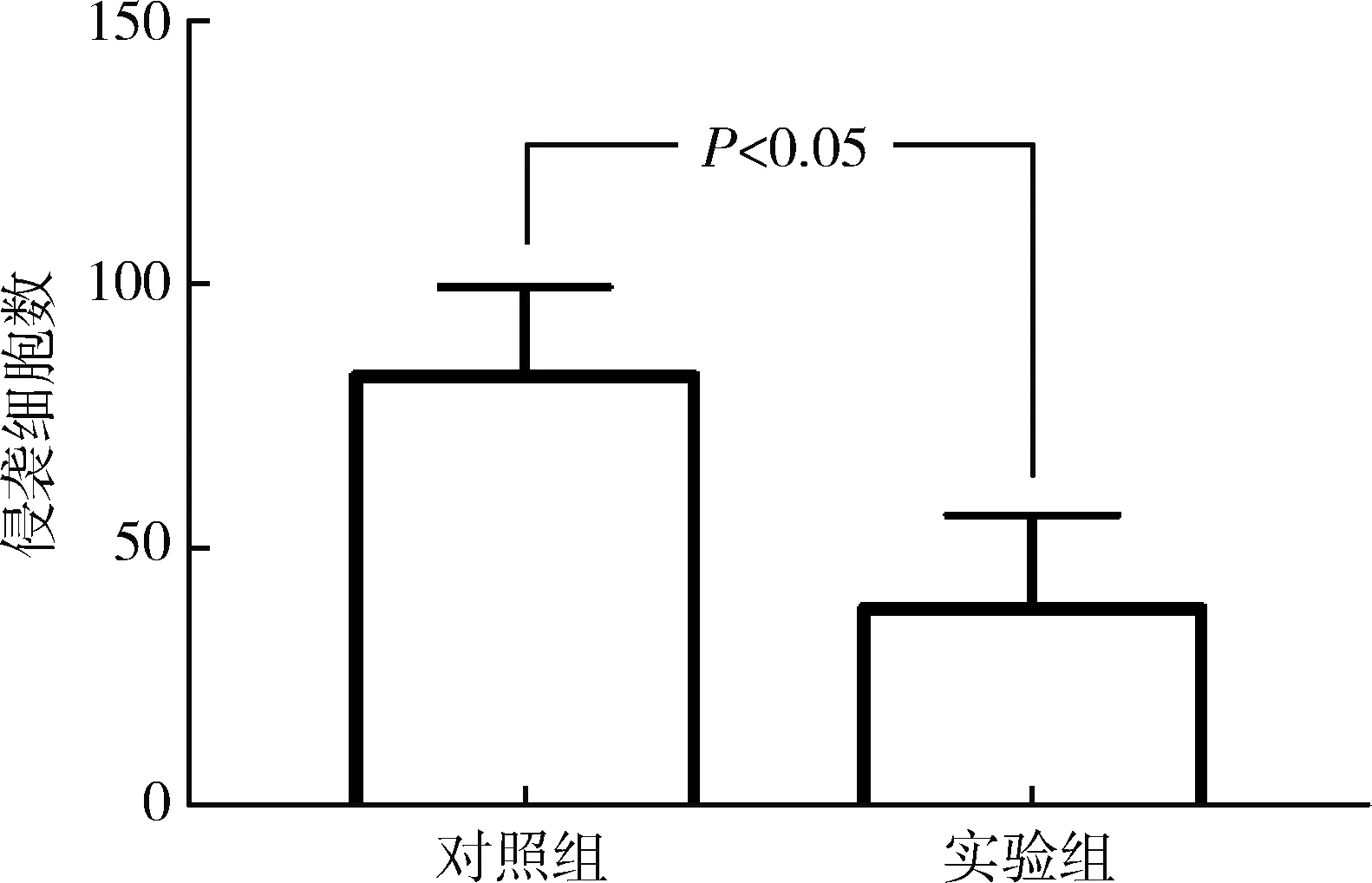
图3 hsa_circ_0024707过表达对乳腺癌BT549细胞侵袭的影响
6.生物信息学预测hsa_circ_0024707的下游基因:starBase v2.0靶基因预测数据库显示,hsa_circ_0024707靶基因可能为miR-448。TargetScan Release 3.1靶基因预测数据库显示,miR-448靶基因可能为SPRY2,详见图4。

图4 生物信息学预测hsa_circ_0024707的下游基因
7.qPCR检测感染后BT549细胞中miR-448和SPRY2 mRNA的表达:qPCR结果显示,对照组和实验组乳腺癌BT549细胞中miR-448的表达分别为1.00±0.07和0.27±0.05(P<0.01),证明hsa_circ_0024707过表达可下调BT549细胞中miR-448的表达。对照组和实验组乳腺癌BT549细胞中SPRY2 mRNA的表达分别为1.01±0.07和5.16±0.30(P<0.01),证明下调miR-448可上调BT549细胞中SPRY2 mRNA的表达。
8.hsa_circ_0024707过表达对乳腺癌BT549细胞SPRY2蛋白及Wnt/β-catenin信号通路蛋白表达的影响:Western blot法结果显示,与对照组比较,实验组的 SPRY2蛋白表达上调,而Wnt/β-catenin信号通路蛋白Wnt、β-catenin、GSK-3β、APC表达下调,详见图5。
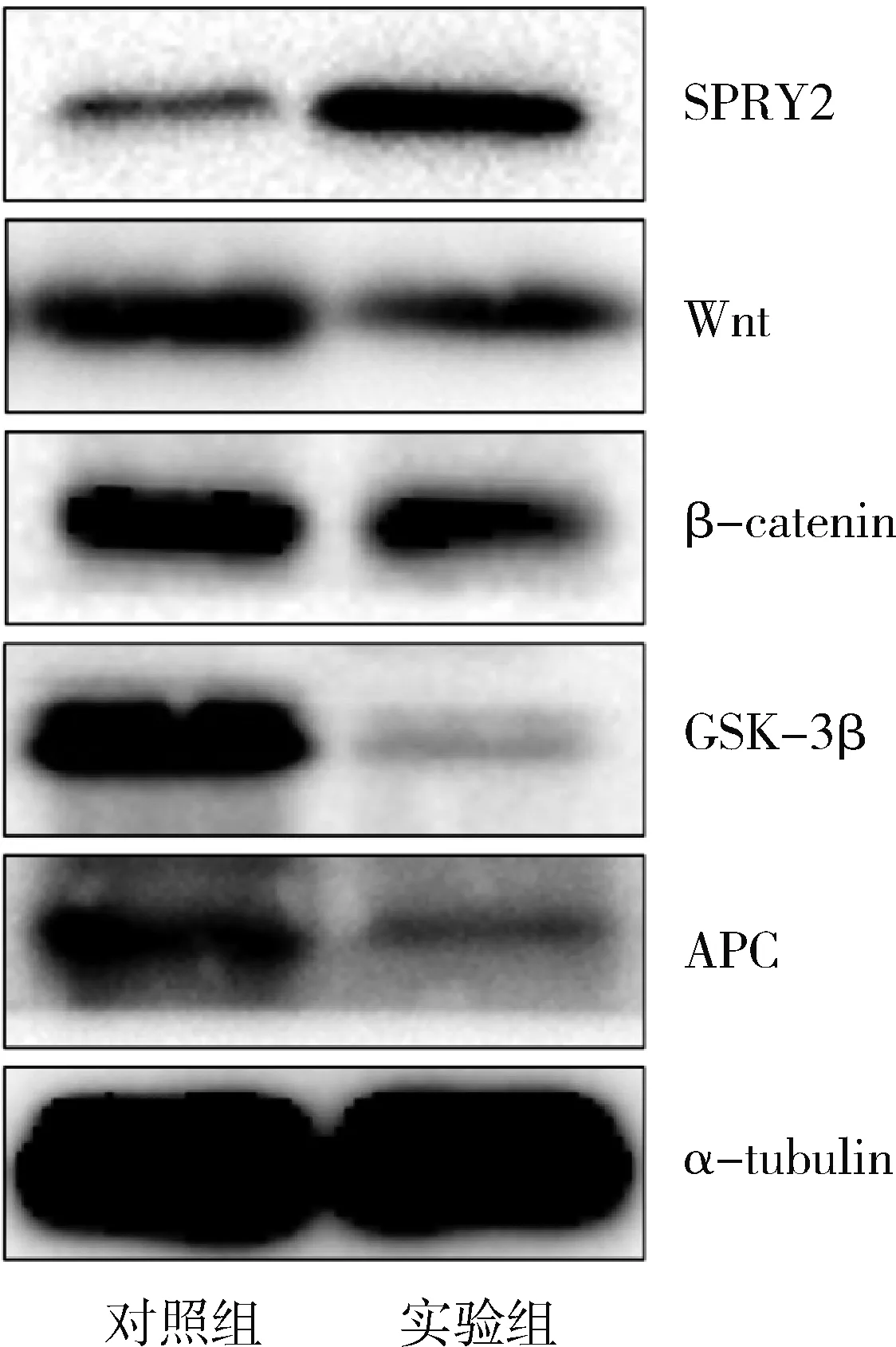
图5 hsa_circ_0024707过表达对乳腺癌BT549细胞中SPRY2蛋白及Wnt/β-catenin信号通路蛋白表达的影响
讨 论
环状RNA(circRNA)最初被认为是错误的剪接副产物,没有生物学功能[7]。随着高通量测序技术的发展,大量的circRNA被发现和鉴定,在多种肿瘤中发挥癌基因或者抑癌基因的作用[8]。近年来研究表明,circRNA的异常表达与乳腺癌的发生、发展相关[9]。circRNA如hsa_circ_0001982、circDENND4C、circ-ABCB10、hsa_circ_0008039在乳腺癌组织和细胞株中呈过表达,具有促进乳腺癌的恶性生物性行为的作用,与乳腺癌的不良预后相关[10~13]。circRNA如hsa_circ_0072309、MTO1在乳腺癌组织和细胞株中呈低表达,与乳腺癌的病理分期及预后等相关,具有抑制乳腺癌的增殖、迁移和侵袭的作用[8, 9]。hsa_circ_0024707是一个新发现的lncRNA,hsa_circ_0024707在乳腺癌中的表达和作用机制尚不明确。
本研究发现,hsa_circ_0024707在乳腺癌组织和细胞株中呈低表达,提示hsa_circ_0024707可能在乳腺癌中发挥抑癌基因作用。本研究进一步通过CCK-8实验和Transwell侵袭实验发现,hsa_circ_0024707过表达可明显抑制乳腺癌细胞BT549的增殖能力和侵袭能力,进一步提示hsa_circ_0024707在乳腺癌中发挥抑癌基因作用。有研究表明,circRNA含有miRNA反应元件,能通过海绵作用竞争性结合miRNA,下调miRNA的表达,从而调节miRNA下游基因mRNA的翻译[14]。starBase v2.0靶基因预测数据库显示,hsa_circ_0024707靶基因可能为miR-448。TargetScan Release 3.1靶基因预测数据库显示,miR-448靶基因可能为SPRY2。miR-448在胃癌、口腔鳞状细胞癌中表达明显升高,与患者的不良预后显着相关,发挥癌基因的作用[15,16]。
SPRY2蛋白由315个氨基酸构成,是一种潜在的抑癌蛋白,在胃癌、卵巢癌、神经胶质瘤等多种肿瘤中低表达,过表达SPRY2可抑制肿瘤的生长和转移[17,18]。本研究发现,hsa_circ_0024707在乳腺癌细胞BT549中过表达后,miR-448的表达明显下调,SPRY2基因的表达明显上调,表明hsa_circ_0024707可能通过下调miR-448的表达,促进SPRY2基因的表达。有研究表明,SPRY2可通过降低β-catenin蛋白的表达,发挥抑制肿瘤的生长和转移的作用[19]。Western blot法结果显示,乳腺癌细胞BT549中SPRY2基因表达增加后,Wnt/β-catenin信号通路蛋白如Wnt、β-catenin、GSK-3β、APC的表达下调,Wnt/β-catenin信号通路的转导被抑制。
综上所述,本研究首次验证hsa_circ_0024707在乳腺癌组织和乳腺癌细胞株中的表达下调,过表达hsa_circ_0024707可抑制乳腺癌细胞的增殖和侵袭,其作用机制可能是hsa_circ_0024707通过下调miR-448的表达,促进SPRY2基因的表达,并抑制Wnt/β-catenin信号通路的转导。hsa_circ_0024707可能成为乳腺癌治疗的分子靶标。



