张连芹 刘金东
冠脉动脉旁路移植术(coronary artery bypass surgery,CABG)是目前临床上治疗冠心病的主要方法,根据患者血管腔阻塞的程度以及心功能状态,相当一部分患者需要在体外循环(cardiopulmonary bypass,CPB)辅助下进行手术,但在体外循环期间,由于心脏停跳,心肌发生缺血缺氧,恢复血流再灌注时可发生严重的缺血再灌注损伤,导致患者术后并发症发生率增加。远端缺血预处理(remote ischemic preconditioning,RIPC)是在组织发生缺血前,通过对患者肢体进行间断的血流阻断与开放,可产生早期和延迟的器官保护作用[1]。本研究拟实施改良肢体RIPC,通过增加肢体RIPC的预处理次数,观察其对心肌损伤的保护作用,为临床应用提供依据。
资料与方法
1. 一般资料: 本研究获徐州医科大学附属医院医学伦理学委员会批准(XYFY2016-KL035-01)并进行临床试验注册(NCT-03010839),患者均签署知情同意书。选择笔者医院择期行CABG患者162例,患者年龄45~70岁,体重 46~85 kg,ASA分级Ⅱ~Ⅲ级。排除标准:①有严重外周血管闭塞性疾病;②本次手术为不停跳冠状动脉旁路移植术(off pump coronary artery bypass grafting,OPCABG)手术;③术前心脏超声显示射血分数<30%;④术前患者有置入心脏起搏器或除颤器;⑤术前有严重的肝肾衰竭。将患者随机分为改良远端缺血预处理组(R组)和对照组(C组),每组81例。
2.方法:患者入室后监测心电图、脉氧,局部麻醉下行左桡动脉穿刺置管测压。麻醉诱导:静脉注射依托咪酯0.3mg/kg,咪达唑仑0.05mg/kg,舒芬太尼1μg/kg,罗库溴铵1mg/kg。气管插管后行机械通气,VT6~8ml/kg,RR 10~12次/分。麻醉诱导后行右侧颈内静脉穿刺置管测压,监测鼻咽温、直肠温,置入TEE探头行术前与术中评估。麻醉维持:静脉输注丙泊酚4~8mg/(kg·h)和顺阿曲库铵0.08~0.12mg/(kg·h)。本研究根据参考文献[2],R组给予远端缺血预处理措施,C组为对照组,R组分别于术前24h、术前12h、麻醉诱导后进行改良肢体RIPC处理,每次在患者右上肢上臂绑上止血带,对止血带进行充气加压至无法触及肱动脉搏动,持续5min阻断上肢血流,然后将止血带放气使其再灌注5min,此过程进行3个周期。C组不进行任何操作。手术均采用标准胸骨正中切口,建体外循环前予以肝素1.5mg/kg,测ACT >480s后开始体外循环。阻断主动脉后,从主动脉根部灌注冷血停搏液(晶体∶血液=1∶4,总体积约1L,每隔30min灌注1次),顺行灌注约18ml/kg。远端吻合完毕后开放主动脉,心脏自动复跳或起搏心率,待近端吻合完毕后进行TEE评估心功能,予以鱼精蛋白1∶1拮抗。
3.观察指标: 本研究主要观察指标为肌钙蛋白I(cTnI)含量,次要观察指标包括心脏复跳方式和再灌注心律失常发生率,术后30天的并发症发生率。分别于术前及术后1、6、12、24、24及48h采集静脉血2ml置于EDTA抗凝管中,离心10min后取上清液,检测肌钙蛋白I(cTnI)含量浓度,记录心脏复跳方式和再灌注心律失常发生率,记录患者术后30天的并发症发生率。
结 果
C组与R组48h内肌钙蛋白的平均值分别为30.1ng/ml和27.7ng/ml,以检验效能为80%,α为0.05,利用PASS软件计算出样本量为162例。
本研究共纳入194例患者,其中有32例患者被剔除出组,其中4例有严重外周血管疾病,5例患者术前射血分数<30%,3例患者术前置入心脏起搏器,16例患者术中改为不停跳冠脉旁路移植术,4例患者术后失随访。最终共纳入患者162例,两组分别为81例。两组患者在性别、年龄、BMI、射血分数(EF)、术前合并症、心脏功能、术前用药等方面比较,差异无统计学意义(P>0.05,表1)。

表1 两组患者一般情况比较
两组患者主动脉阻断时间、手术时间、心脏停搏液灌注量、搭桥数量、桥血管流量等比较,差异无统计学意义(P>0.05,表2)。
表2 两组患者临床指标比较
两组患者机械通气时间、住院时间比较,差异无统计学意义(P>0.05,表3)。与C组比较,R组患者cTnI>20ng/ml和cTnI>30ng/ml人数减少,R组自动复跳率高,再灌注心律失常发生率低(P<0.05)。

表3 两组患者术后指标比较
两组患者T0~T2时cTnI浓度比较,差异无统计学意义(P>0.05,表4),与C组比较,R组T3~T5时cTnI浓度降低(P<0.05)。
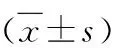
表4 两组患者cTnI浓度比较
在术后30天的并发症发生率比较,两组患者在死亡数、心肌梗死、脑卒中、肾衰竭等发生率方面比较,差异无统计学意义(P>0.05,表5)。

表5 两组患者术后30天并发症发生率比较[n(%)]
讨 论
冠心病是全球范围内引起患者死亡的主要原因,其发生率与病死率呈逐年上升的趋势[3]。冠心病是由于血管腔的狭窄或阻塞,造成心肌缺血、缺氧甚至坏死,因此冠心病患者的冠状动脉储备能力很低,易出现心肌氧供需平衡障碍,进一步加重心肌缺血损伤的程度[4]。体外循环下冠脉搭桥术是一种用于治疗心肌梗死、心肌缺血等缺血性心脏病的主要方法,通过血运重建改善心肌冠脉血流灌注,恢复缺血心肌组织的收缩功能。
临床上根据患者血管病变的范围、血管腔阻塞的程度、患者心功能状态,往往需要在体外循环下进行CABG手术。然而在体外循环中,由于低体温、主动脉阻断、术中停跳导致心肌发生缺血,主动脉开放后的血液再灌注会使心肌受到不同程度的损伤,因而体外循环下CABG手术中的心肌保护措施显得尤为重要[5]。
研究表明,肢体RIPC对心肌缺血再灌注损伤有保护作用,肢体RIPC主要是通过外科止血带或者袖带,对患者肢体进行数次短暂的缺血处理,使肢体局部产生一系列的炎性细胞因子,进而激活一系列的信号转导通路而产生心肌保护作用。RIPC的保护作用存在两个时间窗。早期相在预处理后即刻产生,维持2~3h,主要是增加心肌缺血的耐受性,作用短而有效,晚期相在预处理后24h产生,维持48~72h,此期RIPC不仅提高对缺血的耐受力,还能防止心肌顿抑,作用时间较早期相更为持久[6]。相关研究表明,肢体RIPC可以降低心肌肌钙蛋白、心肌酶的浓度从而产生心肌保护作用[7~9]。但近年来随着大样本、多中心的临床研究发现,肢体RIPC对器官的缺血再灌注损伤并无保护作用,因而有关肢体RIPC的临床效果目前尚不确定[10~12]。通过文献分析,笔者认为导致研究结果出现差异的主要原因可能是缺血预处理时间过短造成的,RIPC的心肌保护作用可能与缺血刺激的强度存在密切的关系,刺激强度不足可能无法获得有效的心肌保护效果。本研究中采用改良肢体RIPC处理措施,在术前24h即开始干预,增加预处理的次数,使RIPC产生多个保护时间窗的重叠,从而产生最大的保护效应。
目前国内外研究的都是单次缺血预处理对心肌损伤的影响,且研究结果存有争议,本研究探讨多次肢体RIPC的心肌保护作用。与C组比较,R组术后48h内cTnI的浓度明显降低。肌钙蛋白主要有3种亚型,即肌钙蛋白C(cTnC)、肌钙蛋白T(cTnT)与肌钙蛋白I(cTnI),cTnI主要存在于心肌细胞中,是反映心肌损伤比较特异性和敏感度的指标,心肌损伤后cTnI会明显升高[13]。本研究中R组术后cTnI浓度明显降低,cTnI>20ng/ml与cTnI>30ng/ml的人数较对照组明显减少,表明改良肢体RIPC可以降低心肌损伤的程度从而对心肌产生保护作用。
本研究中R组心肌自动复跳率增高,再灌注心律失常发生率降低,表明改良肢体RIPC能够促进心肌功能的快速恢复,对围术期心肌损伤有一定的保护作用。但患者术后30天的相关并发症差异无统计学意义,可能与样本量不足有关,本研究中样本量主要根据主要观察指标cTnI计算,后期研究会继续增大样本量来观察改良肢体RIPC对心脏手术患者长期预后的影响。
综上所述,改良肢体RIPC对CABG手术患者有一定的心肌保护作用。本研究中采用改良远端缺血预处理的措施,通过增加其预处理的干预次数,充分利用多次预处理所产生的多个保护效应时间窗的衔接,为心脏手术患者围术期重要脏器保护提供一个新的简便易行的方法。



