马明崴 孙 娟 刘 震 康维明
胃肠道间质瘤(gastrointestinal stromal tumor, GIST)是消化道间叶肿瘤的主要组成部分,但仍较为罕见[1]。值得一提的是,近年来GIST的发生率有所增加,这可能与内镜技术的快速发展有关[2]。GIST 可以发生在胃肠道的任何地方,胃和小肠是最常见的部位,其次是结肠、直肠[3]。目前,外科手术仍是局限性或潜在可切除GIST的唯一治愈方法。另外,在基因驱动治疗的时代,伊马替尼等酪氨酸激酶抑制剂 (tyrosine kinase inhibitor, TKI) 药物的应用,使GIST成为实体肿瘤中靶向治疗最为成功的肿瘤类型之一[4]。尽管如此,GIST患者的预后与生活质量仍不容乐观。尤其在2020年CSCO指南及其解读当中,再次强调了GIST患者进行根治手术治疗的必要性[5]。但对于原发性、非转移、已达到R0切除的患者,由于预后较为良好,临床随访过程中容易放松警惕。因此针对此类患者急需一种个性化的随访依据,有指征的增加随访频率,进而改善患者预后。近年来,列线图已在全球范围内进行多方位的报道,通过复杂计算公式生成可视化的预后模型,用于判断临床事件的发生概率[6]。借助列线图,临床医生可以评估例如个体死亡或疾病复发的可能性,然后设计个性化的诊疗计划[7,8]。
本研究基于真实世界数据及笔者医院数据,分析影响行R0术后的原发性,非转移性GIST患者OS的预后因素,构建可视化预后模型,并进行严格的内部及外部验证。另外,本研究撰写过程中严格遵循了个体预后或诊断的多变量预测模型的透明化报告标准声明,以保证该预测模型从构建阶段到应用阶段的严谨性、适用性[9]。
材料与方法
1.数据源及纳入标准:笔者医院机构帐号获得SEER数据库访问许可,以ICD-O-3中8936/3为标准,从SEER*Stat (8.3.9.2)软件中下载了2010~2016年病理组织学诊断为GIST的临床数据,并且纳入以下字段进行研究:Year of diagnosis、 Diagnostic Confirmation、 Sequence number、 Age recode、 Race recode、 Sex、 Site recode ICD-O-3/WHO 2008、 Derived AJCC T/N/M、RX Summ-Surg Prim Site (1998+)、CS tumor size、 CS site-specific factor 6、 Survival months、 Vital status recode。根据数据库中的字段相应解释,纳入标准:①ICD-O-3编码为GIST;②GIST为第一肿瘤且具有阳性病理报告;③完全切除原发灶达到R0;④无淋巴结转移以及远处器官转移。排除标准:①生存时间及生存状态未知;②未行手术治疗;③有一个以上原发肿瘤。另外,按照同样的纳入及排除标准,将2013~2017年于北京协和医院住院,行根治手术且病理诊断为GIST,切缘阴性的141例患者作为外部验证组。本研究经笔者医院医学伦理委员会审批(伦理审批号:001933)。
2.生存预测模型的构建及验证方法:选择年龄、性别、种族、肿瘤位置、肿瘤直径、有丝分裂率、生存状态以及生存时间纳入研究。将符合纳入标准的 GIST 患者以6∶4的比例随机分为建模集和内部验证集。另外,本研究主要终点为根治术后GIST患者的OS,OS定义为从诊断到任何原因导致死亡的总时间。在建模队列中使用COX回归分析来鉴定独立预后因素,并以此构建生存预测模型(列线图),与此同时,对多因素COX回归中有意义的变量,采用Kaplan-Meier方法和Log-rank检验绘制相应的生存曲线,进一步证明其对OS的预测价值。在对生存预测模型的验证中,采用自举法对列线图进行内、外部验证并绘制校准图,这可显示曲校正曲线和理想曲线之间的关联。另外,ROC也被用来估计列线图的区分性能。ROC 曲线下面积越大,列线图对预后识别的准确性越好。
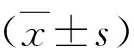
结 果
1.来自SEER数据库GIST患者的临床病理特征:首先,笔者根据上述的纳入和排除标准,自SEER数据库中筛选出685例原发性GIST患者。患者被随机拆分为建模组(n=413)和内部验证组(n=272)。表1展示了总队列,建模队列以及内部验证队列的临床病理特征。两队列的年龄、性别、种族、有丝分裂率等基本特征差异无统计学意义(P>0.05),以此保证后续建模的稳定。

表1 SEER数据库中GIST患者的临床病理特征[n(%),M(Q1,Q3)]
2.建模队列中独立预后因素的鉴定:单因素COX回归分析,结果显示年龄、肿瘤位置、有丝分裂率与患者的OS显着相关,差异有统计学意义(P<0.05)。为进一步确定上述3个因素的独立预后价值,笔者进行了多因素COX回归分析,结果显示,年龄、肿瘤位置以及有丝分裂率对术后GIST患者的OS的生存预测价值(P<0.05,表2),年龄较大(HR=1.062, 95% CI: 1.043~1.081,P<0.001)、有丝分裂率较高(HR=2.722,95% CI: 1.766~4.195,P<0.001)、胃肠道以外位置(HR=3.808, 95% CI: 1.420~10.213,P=0.008)可能对患者的OS产生更大的影响。
表2 鉴定影响GIST患者OS的独立预后因素
3.生存预测模型的构建:使用多因素COX回归的结果来构建GIST患者根治术后的OS生存预测模型(列线图),根据不同年龄,有丝分裂率以及原发肿瘤位置的单项得分,最终计算出总得分以确定1、3、5年生存的概率。年轻患者、胃部位置和较低的有丝分裂率的患者的生存概率很高(图1)。
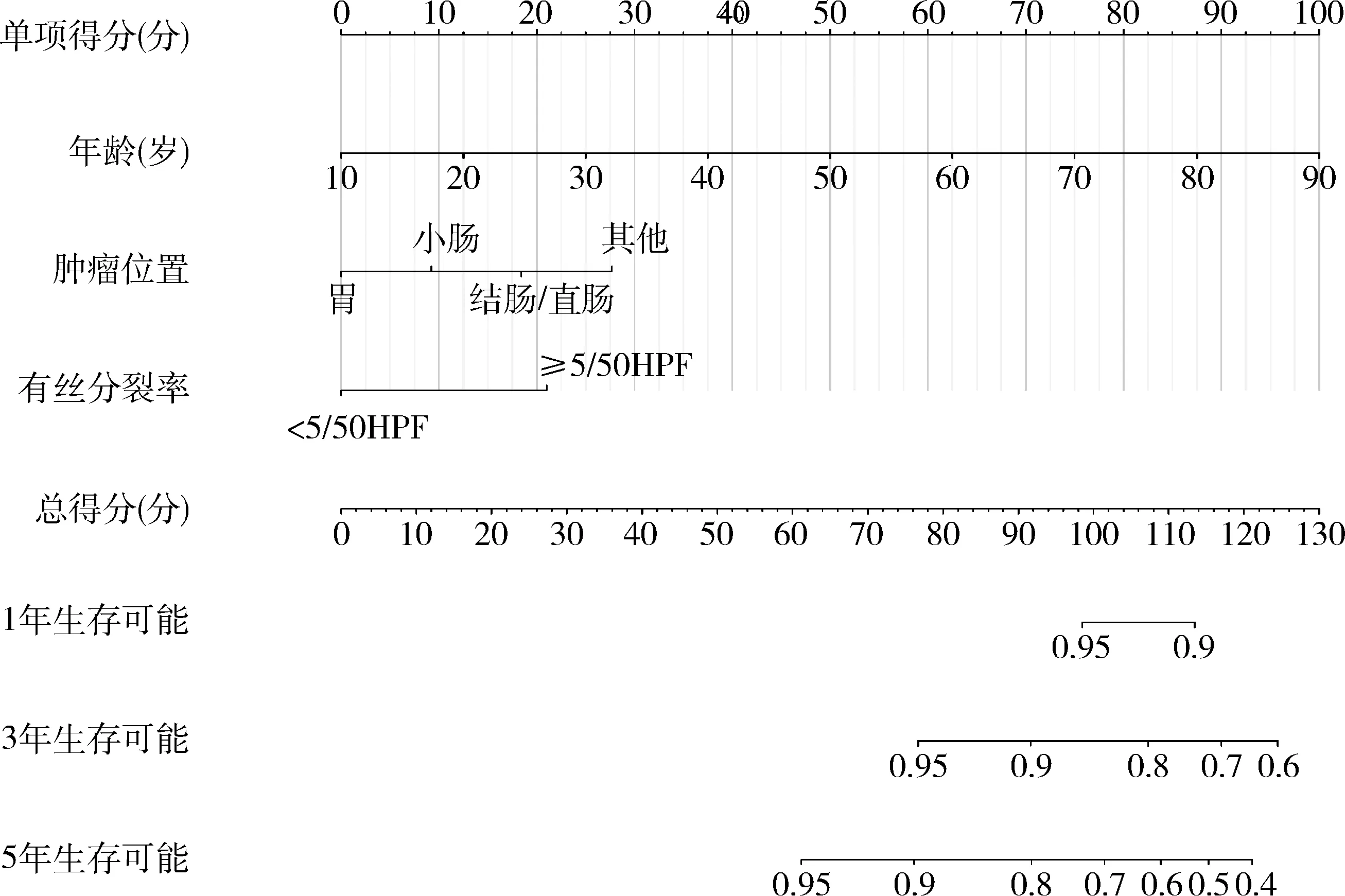
图1 原发性GIST患者根治术后的列线图模型
4.外部验证队列的临床病理特征:为了进一步检测该模型的准确性,基于预测模型所纳入的变量,收集笔者医院141例的术后GIST患者作为外部验证组。在该验证队列当中,所有患者均接受了手术治疗并达到R0,大部分患者肿瘤位置位于胃(52.5%)和小肠(38.3%),49.6%的患者肿瘤直径为5~10cm,详细的临床病理特征见表3。
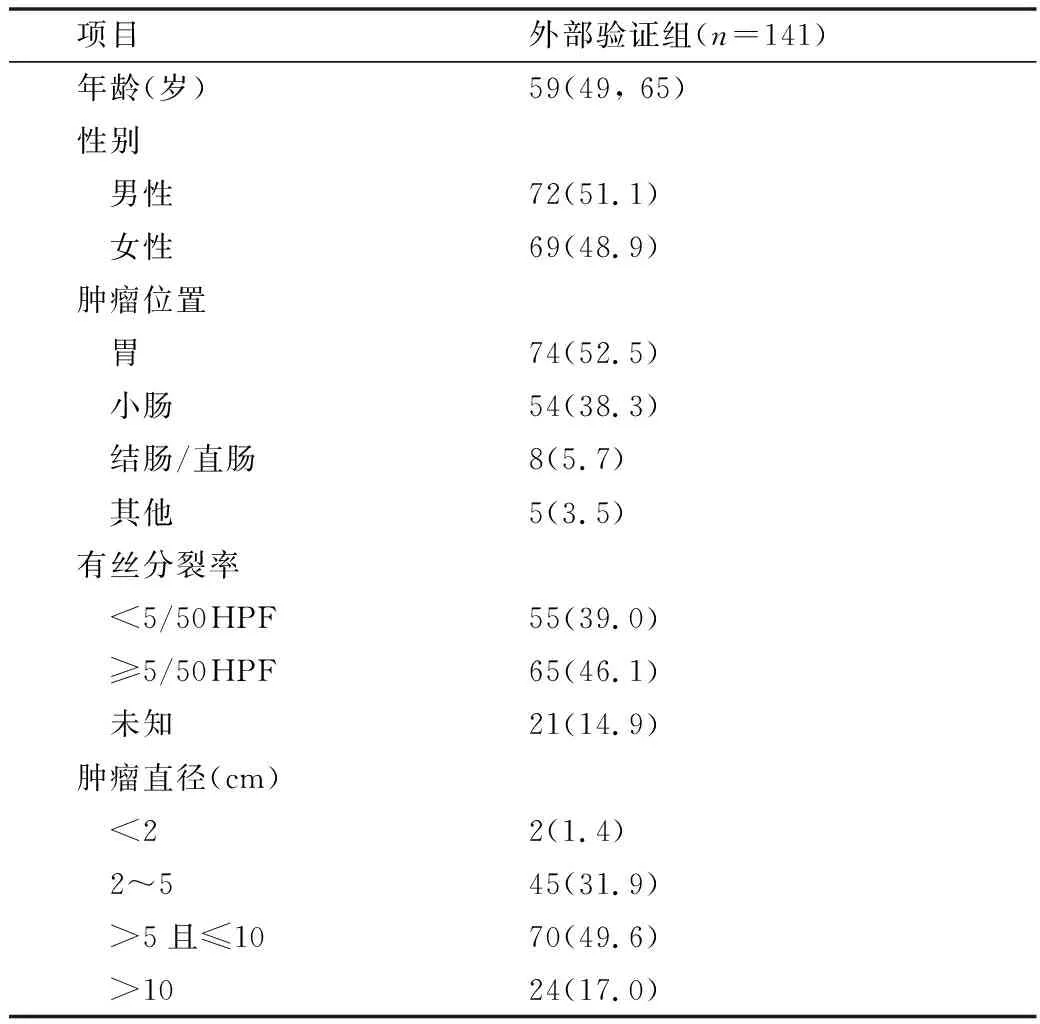
表3 GIST患者的临床病理特征[n(%),M(Q1,Q3)]
5.生存预测模型的校准度验证:对该预测模型进行验证,排除建模样本的人种或地域等差异,笔者使用上述272例内部验证队列(表1),以及141例笔者医院独立外部验证队列(表3),对预测模型的校准度进行了验证。校准图采用 Bootstrap 自由抽样法,结果显示,在建模人群、内部验证人群、以及外部验证人群中,各自1、3、5年生存率预测校准图的校准曲线均与标准曲线接近,该模型具有良好的校准度,详见图2。
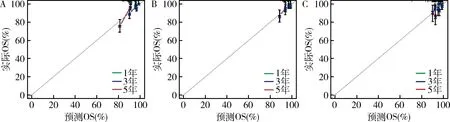
图2 原发性GIST患者根治术后的列线图模型的校准度验证A.建模组;B.内部验证组;C.外部验证组
6.生存预测模型的区分度验证:对预测模型的校准度进行了验证,在各队列中,采用ROC曲线下面积验证模型的区分度。1年总体生存率预测中,建模组的AUC值为0.799(95%CI: 0.723~0.811),内部验证组的AUC值为0.646(95%CI: 0.597~0.731),外部验证组的AUC值为0.742(95%CI: 0.723~0.771)。同样,3年总体生存率预测中,建模组的AUC值为0.726(95%CI: 0.681~0.811),内部验证组的AUC值为0.810(95%CI: 0.734~0.854),外部验证组的AUC值为0.765(95%CI: 0.743~0.801)。最后,5年总体生存率预测中,建模组的AUC值为0.786(95%CI: 0.723~0.814),内部验证组的AUC值为0.768(95%CI: 0.691~0.793),外部验证组的AUC值为0.649(95%CI: 0.610~0.723)。其AUC>0.7,提示该模型在各组中均具有良好的区分度,详见图3。
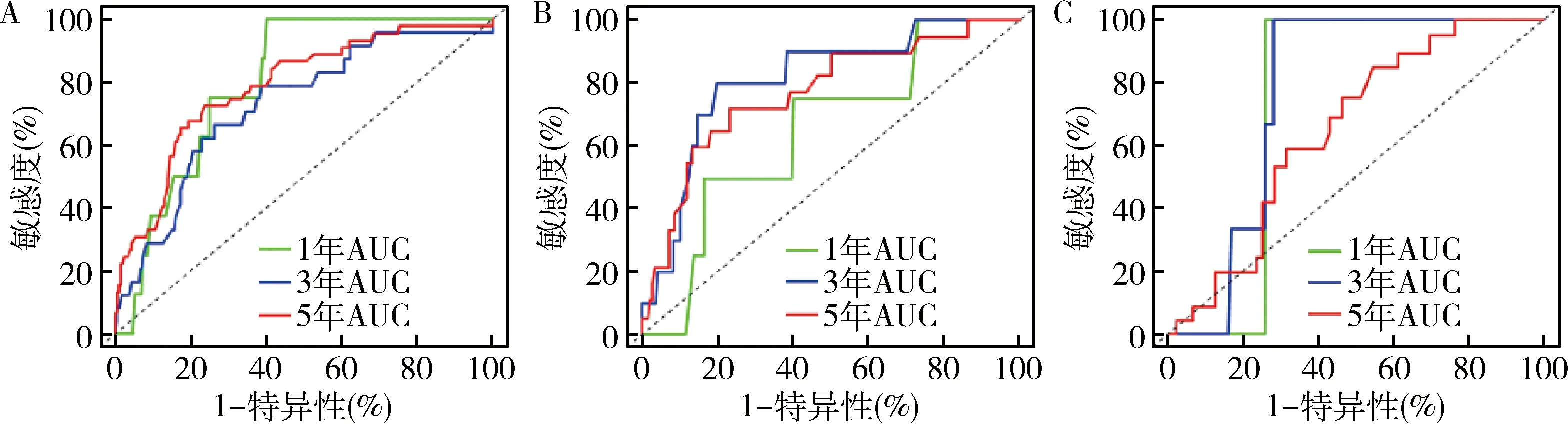
图3 原发性GIST患者根治术后的列线图模型的区分度验证A.建模组;B.内部验证组;C.外部验证组
7.基于预测模型对术后GIST患者的分层分析:在建模组中,将队列中患者根据列线图模型进行风险评分,根据建模组确定的高风险和低风险队列的最佳截断值为73.2分,根据该临界值,将建模组、内部验证组及外部验证组中的患者分为高风险组和低风险组。应用Kaplan-Meier法对高低风险组患者进行生存分析,并采用Log-rank检验,结果显示在各组使用该截断值,能有效地区分出高风险组和低风险组(P<0.05),并且术后高风险组较低风险组具有较短的OS,详见图4。
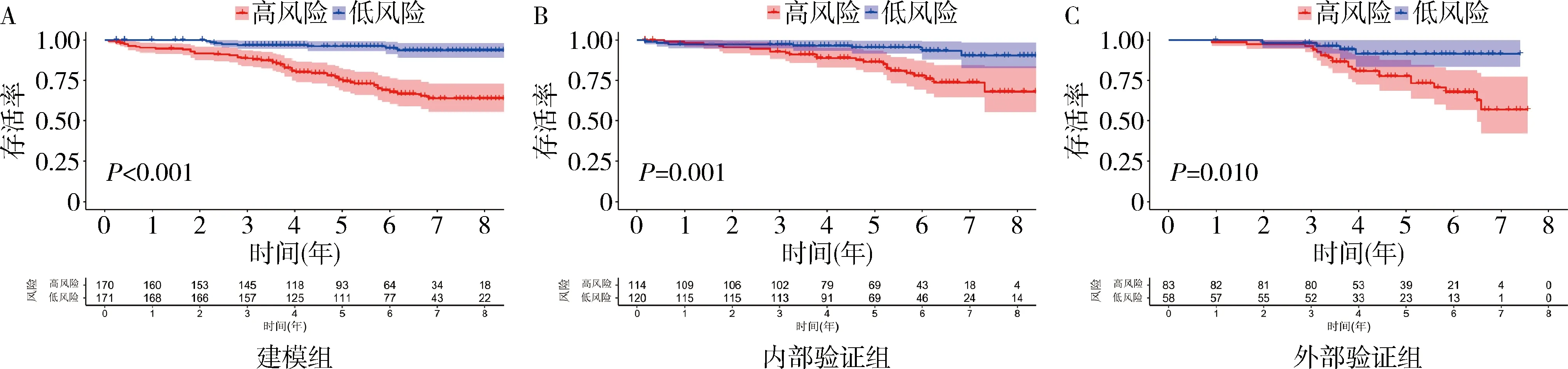
图4 基于列线图模型的原发性GIST根治术后患者的生存分析A.建模组;B.内部验证组;C.外部验证组
讨 论
GIST 的准确风险分层对于治疗选择和预后评估至关重要。目前,已经提出了几种预测 GIST复发危险度的分层方法。两个最广泛接受的分类系统是NIH标准和AFIP标准[10]。最近,某些研究认为肿瘤位置和术中是否肿瘤破裂也是GIST的重要预后因素,因此提出了修改后的标准[11]。虽然复发危险度的分层方法可以较好地去判断术后患者的复发风险,然而,目前尚未建立基于真实世界数据,并仅专注于R0切除术后的风险分层系统。在临床工作中,复发危险度越高,术中情况越差,必然在随访及治疗过程中会给予更多的关注。但是对于术中情况好,术野完全无残留病灶的这部分患者的预后,对其认识仍然不足,更容易放松警惕。因此,笔者借助于列线图这个工具,仅关注于R0术后的原发性、非转移GIST患者,并构建了1个新型的预测模型,并应用完全独立的外部数据集验证了该模型的预测准确性。
本研究的目的是着眼于具体的患者特征,并有效地预测患者的预后,本研究根据3个重要因素(诊断年龄、肿瘤位置以及有丝分裂程度)所建立预测模型,来预测 GIST 患者的 1、3 和 5 年的生存可能。另外,ROC曲线下面积及校准曲线均显示预测模型良好的区分度和校准度。根据既往研究,肿瘤直径和有丝分裂率是被广泛接受的GIST患者的危险因素[12]。但是本研究显示在完全达到R0切除,术后病理切缘阴性的患者而言,肿瘤直径不是影响预后的独立危险因素,这再次说明了R0切除对GIST患者预后的重要意义。对于肿瘤位置而言,GIST可以发生在胃肠道的各个部位,大部分位于胃和小肠,而结直肠和食管仅占一小部分。最近,已发现胃GIST比小肠GIST具有更好的预后结果,因此位置通常被认为是良好的预后因素[13]。本研究结果同样表明,胃 GIST 患者的预后优于其他部位的 GIST。另外,对于年龄而言,老年患者的生存时间要低于年轻患者,这是因为老年人各系统已经发生退行性改变且可能合并多种慢性疾病,对其靶向治疗以及手术的耐受性较年轻患者差[14]。本研究虽然未收集分析患者合并症的数据,但是在美国国家癌症所的数据库中,收录的手术患者均在全美各州癌症中心进行了规范治疗的前提下,术前必然已进行心肺功能的评估,排除了术前有血压、血糖控制不佳或者有相当严重合并症的病例。故在严格把握手术禁忌证的前提下,准确判断患者是否为完全可进行满意减瘤的病例,才可以应用本研究的预测模型。
本研究存在以下不足:(1)作为一项回顾性研究,它存在不可避免的偏倚,虽然本研究已选择笔者医院的病例进行了初步的外部验证,但是为了进一步证实结果,需要再次进行大规模的随机对照研究。(2)在手术后 GIST 患者中使用伊马替尼或其他靶向药物会改变预后情况,然而,SEER 数据库没有提供靶向治疗等重要的药物治疗的数据。(3)许多其他可能影响患者预后的因素,如肿瘤破裂、KIT 基因突变以及PDGRA突变在SEER数据库中也没有进行记录,因此,列线图中不包括这些潜在的预后因素。但是,不管这些限制如何,尽管存在局限性,但本研究率先使用列线图来分析估计R0术后的原发性GIST患者在大型人群中的长期生存,并且较为便捷地通过3种临床信息对生存概率进行简易的判断,其结果可为临床医生制定术后个体化治疗方案和随访提供理论依据。



