张艺凡 苏倍倍 靳 津 应长江 凌宏威
糖尿病肾病(diabetic kidney disease, DKD)是糖尿病的严重并发症,目前已成为终末期肾病(end stage renal disease,ESRD)的主要原因[1]。有文献报道,糖尿病肾病患者生存率明显低于非糖尿病肾病患者[2]。近年来研究认为,肾小管病变的发生可能早于肾小球病变,相较于肾小球病变,肾小管损伤与肾功能恶化更密切相关[3,4]。α1微球蛋白(α1-microglobulin,α1-MG)是一种由肝脏和淋巴组织分泌的小分子糖蛋白,游离型α1-MG可自由通过肾小球滤过膜且绝大多数在近端肾小管中被重吸收,当各种原因导致肾小管损伤时,尿液中α1-MG含量明显升高。近年来,α1-MG被认为是肾小管损伤的敏感指标,在各种肾小管损伤性疾病诊断中发挥重要作用[5,6]。
研究表明,炎症是肾小管损伤的重要一环[7]。单核细胞/淋巴细胞比值(monocyte-to-lymphocyte ratio,MLR)是反映机体炎症的新型指标,既往研究证实,MLR升高与心血管疾病、肿瘤、慢性炎症性疾病相关[8~10]。既往研究表明,糖尿病患者体内血小板呈高反应性,活化的血小板释放大量细胞因子参与炎性反应过程[11]。平均血小板体积(mean platelet volume,MPV)是评估血小板功能及活性的可靠指标,作为常见的炎症标志物与糖尿病并发症及严重程度密切相关[12]。本研究旨在分析MLR、MPV与α1-MG的相关性,评估MLR与MPV在糖尿病患者肾小管损伤中的预测价值。
对象与方法
1.研究对象:选取2020年5月~2021年7月于徐州医科大学附属医院内分泌科住院治疗的2型糖尿病患者278例,其中男性188例,女性 90例,患者平均年龄为53.16±13.16岁。所有患者均符合1999年WHO糖尿病的诊断标准。排除标准:①合并糖尿病急性并发症,如酮症酸中毒等;②合并急性感染性疾病;③近期口服抗血小板药物及输注血制品;④肾小球肾炎、肾盂肾炎、结缔组织病等其他疾病引起的肾脏损害患者;⑤合并严重肝脏、心脏、肺功能不全者;⑥合并肿瘤、血液系统疾病者。
2.方法:收集患者年龄、性别、糖尿病病程、吸烟史、饮酒史、血压、BMI。所有患者禁食8~10h后抽取静脉血,检测单核细胞(M)计数、淋巴细胞(L)计数、平均血小板体积(MPV)等血液学指标,以及空腹血糖(FBG)、糖化血红蛋白(HbA1c)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、总胆固醇(TC)、甘油三酯(TG)、血尿素氮(BUN)、血肌酐(Scr)等生化指标,同时计算MLR,根据 Scr、年龄、性别,采用肾脏病饮食改良(modification of diet in renal disease,MDRD)简化公式计算估算肾小球滤过率(eGFR):eGFR=175×肌酐-1.234×年龄-0.179×性别(男性=1,女性=0.79)。留取清洁中段晨尿,检测尿白蛋白、尿α1微球白蛋白、尿肌酐(Ucr),计算尿白蛋白/肌酐比值(UACR)、尿α1微球白蛋白/肌酐比值(α1CR)。
3.分组:(1)根据UACR水平分为正常白蛋白尿组(UACR<30mg/g,n=74)、微量白蛋白尿组(30mg/g≤UACR<300mg/g,n=136),大量白蛋白尿组(UACR≥300mg/g,n=68)。(2)根据MLR四分位数分为4组(Q1~Q4组)。(3)根据MPV四分位数分为4组(Q1′~Q4′组)。(4)根据α1CR值分为α1CR≤14.21mg/g组和α1CR>14.21mg/g组。
结 果
1.不同白蛋白尿水平患者临床资料与实验室检查结果比较:正常白蛋白尿组、微量白蛋白尿组、大量白蛋白尿组一般资料比较,大量白蛋白尿组年龄、病程、SBP明显高于微量白蛋白尿组、正常白蛋白尿组(P<0.05),微量白蛋白尿组病程明显高于正常白蛋白尿组(P<0.05)。3组间性别构成、BMI、吸烟人数比例、饮酒人数比例、DBP比较,差异均无统计学意义(P>0.05)。3组间实验室检查结果比较,随着UACR水平的增加,各组间BUN、Scr、MLR、MPV、α1CR水平依次升高,eGFR水平依次降低,差异均有统计学意义(P<0.05)。3组间患者HbA1c、FBG、TC、TG、HDL-C、LDL-C比较,差异无统计学意义(P>0.05),详见表1。

表1 不同尿蛋白水平分组的T2DM患者临床资料与实验室检查结果比较
2.根据MLR、MPV四分位数分组各组患者UCAR、α1CR及eGFR的比较:根据MLR四分位数分为4组,Q1组MLR≤0.154(n=70),Q2组MLR为0.155~0.206(n=69),Q3组为MLR 0.207~0.248(n=70),Q4组MLR>0.248(n=69)。根据MPV四分位数分为4组,Q1′组MPV≤9.5fl(n=67),Q2′组MPV为9.6~10.2fl(n=70),Q3′组MPV为10.3~11.1fl(n=68),Q4′组MPV>11.1fl(n=73)。MLR分组中,Q4组UACR、α1CR水平高于其他3组,差异均有统计学意义(P<0.05),Q3、Q4组eGFR明显低于Q1、Q2组,差异有统计学意义(P<0.05,表2)。MPV分组中,Q4′组UACR、α1CR明显高于其他3组,差异均有统计学意义(P<0.05),Q4′组eGFR水平明显低于Q1′、Q2′组,Q2′、Q3′组eGFR水平明显低于Q1′组,差异均有统计学意义(P<0.05,表3)。

表2 不同MLR水平患者一般资料及实验室检查结果比较

表3 不同MPV水平患者一般资料及实验室检查结果比较
3.MLR、MPV与eGFR、UACR、α1CR的相关性分析:Spearman相关性分析结果显示,2型糖尿病患者MLR与UACR、α1CR之间均呈明显正相关(r分别为0.367、0.353,P<0.01),与eGFR均呈明显负相关(r=-0.337,P<0.01)。MPV与UACR、α1CR之间均呈明显正相关(r分别为0.357、0.348,P<0.01),与eGFR均呈明显负相关(r=-0.330,P<0.01,表4)。
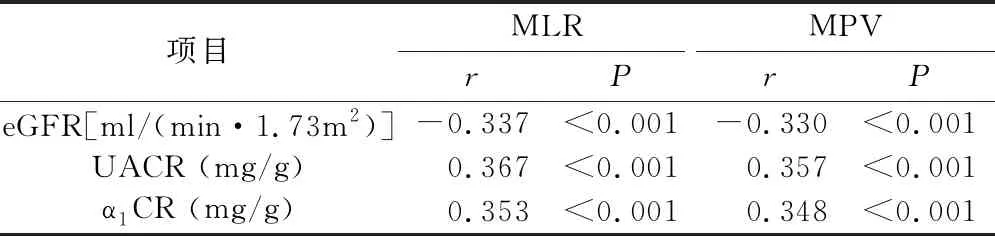
表4 MLR、MPV与eGFR、UACR、α1CR的相关性
4.MLR、MPV、α1CR与eGFR、UACR的ROC曲线分析:以UACR>30mg/g为截点做α1CR、MLR、MPV的ROC曲线。当α1CR取值14.21mg/g时,是诊断T2DM患者出现微量白蛋白尿(UACR>30mg/g)的最佳截点,曲线下面积(area under the curve,AUC)为0.795,特异性为90.8%,敏感度为53.5%。MLR、MPV的AUC分别为0.709、0.651,敏感度和特异性分别为77.2%、55.3%和58.4%、69.7%(表5)。以eGFR<60ml/(min·1.73m2)为截点做α1CR、MLR、MPV的ROC曲线,AUC分别为0.916、0.769、0.697,敏感度和特异性分别为53.5%、90.8%,77.2%、55.3%和58.4%、69.7%(表6)。

表5 MLR、MPV、α1CR预测UACR>30mg/g的ROC曲线

表6 MLR、MPV、α1CR预测eGFR<60ml/(min·1.73m2)的ROC曲线
5.MLR、MPV与α1CR的ROC曲线分析:以α1CR>14.21mg/g为截点做T2DM患者MLR、MPV的ROC曲线,AUC分别为0.706、0.671(P<0.05),当MLR、MPV阈值分别取0.222、10.150时,MLR、MPV诊断α1CR>14.21mg/g的敏感度和特异性分别为62.6%、73.6%和73.0%、58.3%(表7)。

表7 MLR、MPV预测α1CR水平的诊断效能
6.按照α1CR水平分组T2DM患者临床资料和实验室检查结果的比较:按照α1CR值分为α1CR≤14.21mg/g组和α1CR>14.21mg/g组。两组患者性别构成、BMI、吸烟人数比例、饮酒人数比例、DBP、HbA1c、FBG、TG、LDL-C差异均无统计学意义(P>0.05)。α1CR>14.21mg/g组患者年龄、病程、SBP、BUN、Scr、UACR、MLR、MPV水平均明显高于α1CR≤14.21mg/g组,eGFR明显低于α1CR≤14.21mg/g组,差异均有统计学意义(P<0.05,表8)。
表8 按照α1CR水平分组T2DM患者临床资料和实验室检查结果的比较
讨 论
近年来全球糖尿病发生率不断上升,根据IDF数据,至2019年我国糖尿病患者高达1.164亿人[13]。糖尿病肾病作为糖尿病的常见并发症,其现状是患病率高、病死率高,医疗花费大。国内调查研究显示,在糖尿病患者中慢性肾脏病(chronic kidney disease,CKD)的患病率高达35.5%[14]。近年来肾小管损伤在DKD的启动及进展中的作用越来越被重视,早期发现肾小管损伤对DKD的预防和治疗具有重要的临床意义。
国内随访研究表明,尿α1-MG水平与eGFR呈显着负相关,基础尿α1-MG水平升高是DKD患者肾功能进展的独立危险因素[15]。本研究结果显示,大量白蛋白尿组肾小管损伤更严重,α1CR与eGFR呈负相关,且其诊断UACR>30mg/g和eGFR<60ml/(min·1.73m2)均具有较高的特异性,与既往文献报道相符[4]。
大量研究证实DKD患者体内炎性细胞因子表达水平明显升高[16]。MLR是外周血单核细胞计数与淋巴细胞计数之比,是反映机体炎症严重程度的简便、有效的指标。近年来随着对MLR认识的深入,MLR在糖尿病、脑卒中等疾病中的作用也得到重视。有研究发现在高血糖、糖基化终末产物等的刺激下肾脏单核细胞趋化因子(monocyte chemotactic protein-1,MCP-1)表达增加,诱导单核细胞及其衍生的巨噬细胞浸润组织并释放大量炎性细胞因子和趋化因子,诱导肾小球硬化、肾小管萎缩及间质纤维化[16,17]。另外据相关文献报道,糖尿病患者体内T淋巴细胞亚群比例失调,机体处于低度炎症状态,加剧了肾脏损伤的发生[18]。本研究结果显示,大量白蛋白尿组、微量白蛋白尿组MLR明显高于正常白蛋白尿组,相关性分析证实MLR与UACR之间呈明显正相关,与eGFR呈明显负相关,与既往研究结果相符[10]。此外,本研究还发现随着MLR四分位数的增加α1CR逐渐升高,相关性分析显示MLR与α1CR之间呈明显正相关。当以α1CR>14.21mg/g为截点做ROC曲线分析时,其曲线下面积为0.706,表明MLR与T2DM患者肾小管损伤密切相关,对T2DM患者是否并发肾小管损伤较高的预测价值。
血小板是来源于巨核细胞的具有止血功能的血细胞成分,越来越多研究表明,血小板在调控炎性反应中起重要作用。研究表明,T2DM患者血小板活化增加,活化的血小板聚集性更强,更易形成血栓,导致肾脏缺血缺氧,同时还可释放含有多种细胞因子的α颗粒、致密颗粒,加重肾脏炎症及氧化应激损伤[19]。MPV是临床上反映血小板活化及功能的常用指标,同时也是一个良好的炎症标志物,反映不同的炎性状态[20]。有研究表明,T2DM患者MPV水平升高,MPV对T2DM者肾功能下降具有一定预测价值[21]。本研究结果显示,大量白蛋白尿组、微量白蛋白尿组患者MPV水平较正常白蛋白尿组升高,MPV与UACR呈正相关,与eGFR呈负相关,与上述研究结果基本相同。在本研究中,随着MPV四分位数的增加α1CR逐渐升高,相关性分析显示MLR与α1CR之间呈明显正相关。当以α1CR>14.21mg/g为截点做ROC曲线分析时,其曲线下面积为0.671,提示MPV对肾小管损伤的发生具有一定的预测意义。
本研究结果证实,MLR、MPV与T2DM患者肾小管损伤密切相关,可成为预测T2DM患者肾小管损伤的重要指标。MLR、MPV具有简便易测的临床优势,动态监测T2DM患者MLR、MPV水平,有助于早期筛查肾小管损伤,通过及时的诊断和治疗,可延缓DKD的进展,改善预后。



