黄楠芳 宋 扬 郭 娟 张 征 李 晓 许 峰
急性髓性白血病(acute myeloid leukemia,AML)是一种造血干细胞或早期祖细胞的恶性肿瘤,由干扰关键生物学过程的遗传异常积累引起,其特征是分化受损和未成熟血细胞增殖增加[1,2]。标准诱导化疗可以实现疾病缓解,但复发难治性疾病仍然是一个挑战,5年总生存率低于30%[3]。DHX9,也称为RNA解旋酶A(RHA),是DExH-box解旋酶家族的成员,能够解开RNA和DNA双链体及异常多核苷酸结构,在调控基因组稳定性、转录以及DNA复制等过程中发挥重要作用[4,5]。既往研究表明,DHX9与结直肠癌、肝癌、宫颈癌等多种实体肿瘤的发生、发展相关,但目前为止,DHX9在白血病中的表达及发病机制中的作用尚无相关文献报道[4,6~8]。DHX9家族成员DHX15、DDX41已被报道与AML发病机制密切相关,进一步表明RNA解旋酶家族的异常有助于血液系统恶性肿瘤的发展[9,10]。因此,本研究通过GEO数据分析及构建低表达DHX9的白血病细胞系,探讨DHX9在白血病中的表达水平及作用机制。
材料与方法
1.GEO数据库分析:欧洲白血病网络发起的MILE研究纳入542例AML患者、207例骨髓增生异常综合征(myelodysplastic syndrome,MDS)患者、76例慢性髓系白血病(chronic myeloid leukemia,CML)患者及74例非白血病/健康对照的基因表达谱分析。数据分析采用Affymetrix Human Genome U133 Plus 2.0 Array(美国Affymetrix公司)分析。数据处理最终生成每个微阵列的探针集水平相对信号强度,该信号值(202420_s_at)代表了DHX9的相对表达水平。
2.主要试剂和仪器:K562细胞为本实验室保存株。胎牛血清购自美国Hyclone公司,100X青霉素-链霉素双抗购自苏州新赛美生物科技有限公司,IMDM培养基购自美国Gibco公司,慢病毒及促转染试剂购自上海吉凯基因医学科技有限公司,全蛋白提取试剂盒、BCA蛋白浓度定量试剂盒购自美国Thermo Fisher Scientific公司,ECL发光液试剂盒、Annexin V-FITC细胞凋亡检测试剂盒购自上海碧云天生物技术有限公司,RNA提取、反转录和RT-qPCR试剂盒均购自苏州EZB生物有限公司,抗DHX9抗体购自英国Abcam公司,抗caspase-9、Bcl-2抗体购自美国Cell Signalling Technology公司,二抗山羊抗鼠购自武汉三鹰生物技术有限公司,抗β-actin抗体购自上海翌圣生物科技有限公司,引物合成由生工生物工程(上海)股份有限公司完成。流式细胞仪购自美国Beckman公司,蛋白电泳仪购自美国Bio-Rad公司,实时荧光定量PCR仪购自美国Thermo Fisher Scientific公司。
3.细胞培养:K562细胞复苏后接种在含10%胎牛血清、1%100U/ml青霉素和100μg/ml链霉素的IMDM培养基中,置于5%CO2、37℃恒温培养箱,每两天传代或换液1次,取对数生长期细胞进行实验。
4.病毒感染:用完全培养基制备2ml密度为105个/毫升的细胞悬液并接种至6孔板,根据复感染指数(MOI=50)加入慢病毒和促转染试剂,置于5%CO2、37℃恒温培养箱孵育12~16h后,更换为完全培养基继续培养。感染48h后用嘌呤霉素筛选稳定株。
5.细胞总mRNA提取及qPCR检测:细胞总mRNA提取及qPCR检测按照试剂盒说明书步骤进行。提取细胞RNA并通过反转录得到cDNA,以此为模板进行qPCR扩增。扩增体系:1μl cDNA,5μl SYBR Green qPCR Master Mix,0.2μl Primer F/R(10μmol/L),3.6μl ddH2O。扩增程序:95℃5min,95℃10s,60℃30s,循环数40,以GAPDH为内参基因,用2-△△CT计算目的基因相对表达量,扩增引物序列详见表1。

表1 qPCR引物序列
6.Western blot法检测:取电泳凝胶,每孔加入20μg细胞总蛋白,120V恒压电泳,转膜后封闭,切取目的条带,加入1∶1000稀释的抗体4℃摇床孵育过夜,TBST洗涤3次,每次10min,加入1∶5000稀释的二抗,室温摇床孵育1h,TBST洗涤3次,使用ECL发光液检测结果,并用Image J计算灰度值。
7.Annexin V-PI双染法检测细胞凋亡:收集处于对数生长期的细胞,PBS洗涤两遍,1000×g离心5min,弃上清,加入195μl Annexin V-FITC结合液重悬细胞,加入5μl Annexin V-FITC、10μl碘化丙啶染色液,轻轻混匀,室温(20~25℃)避光孵育10~20min,随后置于冰浴,1h内用流式细胞仪检测。
8.CCK-8法检测细胞增殖:将等量对照组和DHX9敲低组K562细胞接种于96孔培养板,置于37℃、5% CO2培养箱培养,并分别于24、48、72和96h加入10μl CCK-8(cell counting kit-8)试剂孵育1.5h,使用酶标仪检测450nm波长处的吸光度。以每孔吸光度为纵坐标绘制增殖曲线。
9.Gene expression microarray(GEM):用GeneChip Scanner 3000 7G(Affymetrix)扫描仪扫描芯片的荧光信号强度,使用Partek基因组学分析软件进行数据分析,采用Robust Multi-Array Average(RMA)算法对数据进行归一化处理,使用Cluster 3.0软件对基因和样本进行分层聚类,在对照(n=3)和DHX9敲低的K562细胞(n=3)之间鉴定差异基因表达谱。
结 果
1.DHX9基因在AML、MDS及CML中的表达:通过分析GEO数据库中542例AML、207例MDS、76例CML患者和74例对照样本(GSE13159)基因芯片中DHX9 表达水平,AML组DHX9基因表达水平较对照组明显增高(P<0.01),较MDS组及CML组也明显增高(P均<0.001);而CML组DHX9表达水平明显低于AML、MDS及对照组(P均<0.001),详见图1。
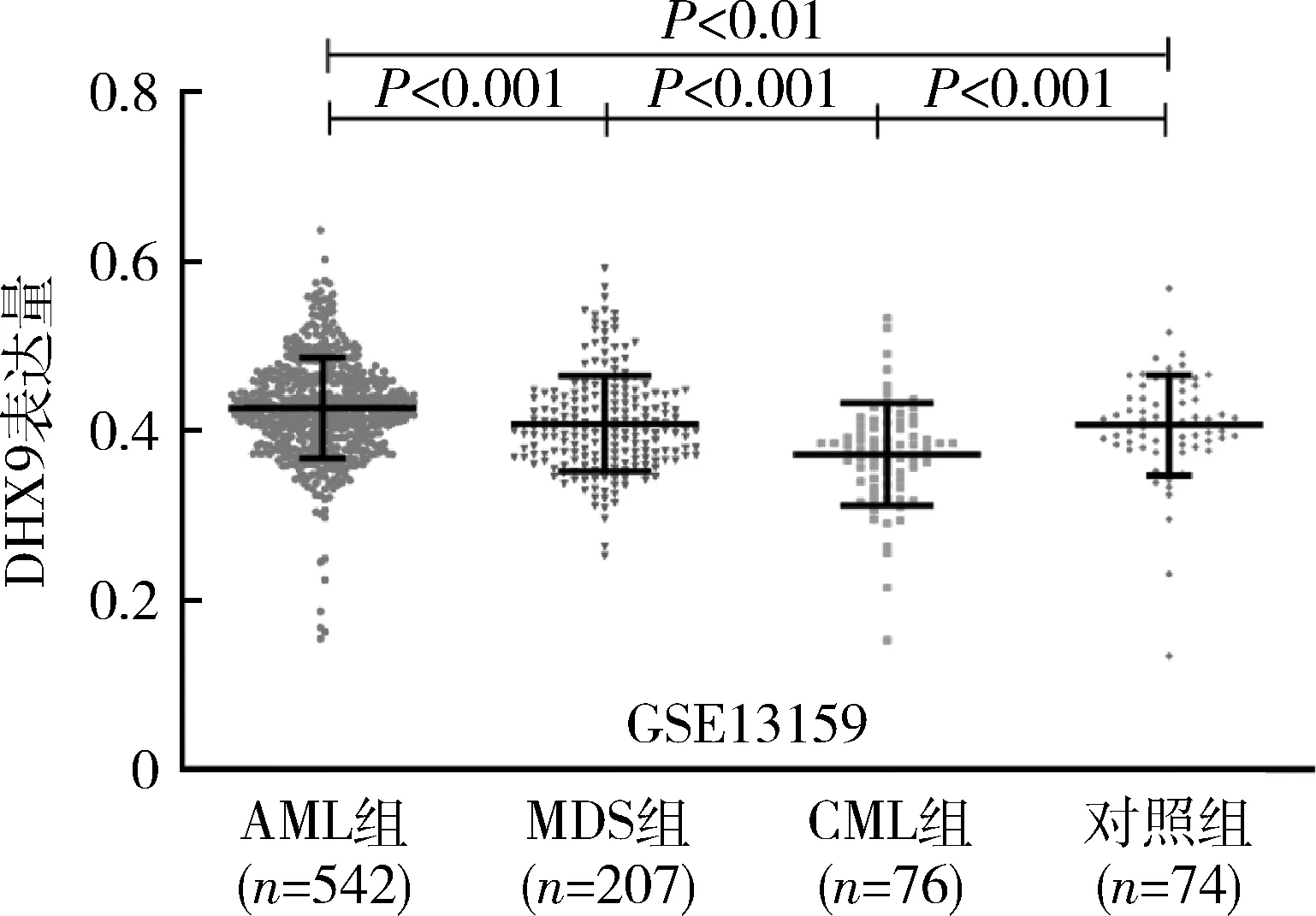
图1 GEO数据集(GSE13159)中DHX9在AML、MDS及CML中的表达
2.慢病毒介导的DHX9敲低体系构建及验证:为了研究DHX9在AML中的作用机制,笔者在AML细胞系K562中构建了慢病毒介导的DHX9敲低体系。病毒转染后的细胞经qPCR检测显示,DHX9表达水平明显下降(0.48±0.06,P<0.01,图2A),进一步的Western blot法验证了DHX9敲低效率(图2B)。

图2 DHX9敲低对K562细胞凋亡及增殖的影响A.转染K562细胞中DHX9mRNA表达水平;B.转染K562细胞中DHX9蛋白质水平;C、D.Annexin V-PI法检测细胞凋亡;E.CCK-8法检测细胞增殖。*P<0.05, **P<0.01,***P<0.001
3.DHX9对K562细胞凋亡的影响:Annexin V-PI实验结果表明,DHX9敲低细胞株呈现增高的细胞自身凋亡率(7.10%±0.26% vs 3.14%±0.42%,P<0.001,图2中C、D)。当加入抗肿瘤药物阿扎胞苷(5-azacytidine,AZA)(4μmol/L)处理48h后,再次检测DHX9敲低和对照细胞株的细胞凋亡,结果显示,DHX9敲低细胞株对阿扎胞苷凋亡敏感度明显高于对照细胞株(11.29%±1.51% vs 8.20%±0.97%,P<0.05,图2中C、D)。DHX9敲低导致K562细胞凋亡增加,并增加其对抗肿瘤药物的凋亡敏感度。
4.DHX9对K562细胞增殖的影响:CCK-8实验结果显示,对照细胞株增殖迅速,而DHX9敲低细胞增殖缓慢,增殖曲线明显低平,差异有统计学意义(P<0.001,图2E)。DHX9敲低明显抑制K562细胞的增殖。
5.GEM和生物信息分析鉴定DHX9调控p53信号通路:针对DHX9敲低的K562细胞和对照细胞进行基因表达谱分析,获得了2264个差异基因(图3A)。生物信息的分析显示,差异表达基因主要富集在癌症通路、凋亡和p53通路(P均<0.001,图3B)。

图3 DHX9调控p53信号通路A.GEM鉴定差异表达基因;B.通路分析差异表达基因主要富集在癌症通路、凋亡、p53信号通路
6.DHX9对p53相关凋亡通路的影响:p53凋亡通路的抑制是急性白血病细胞凋亡抵抗及化疗耐药的重要机制。为进一步研究DHX9调控AML细胞凋亡的机制,通过Western blot法检测p53信号通路相关蛋白,发现凋亡相关蛋白caspase-9表达增加,Bcl-2表达下降。上述结果表明,抑制DHX9表达能够激活p53信号通路介导的细胞凋亡。
讨 论
DHX9是DExH-box解旋酶家族的成员,能够解开RNA和DNA双链体及异常多核苷酸结构,调控基因组稳定性、转录以及DNA复制等过程[4,5]。DHX9与多种基因存在相互作用,TDRD3通过其Tudor结构域直接与DHX9相互作用,协同抑制启动子相关R-Loop的形成[11]。当DNA发生损伤时,DHX9能够促进断裂DNA末端切除,并协同BRCA1驱动同源重组修复,维持基因组稳定性[12]。DHX9还能与SNORA42相互作用并触发 DHX9/p65 轴来促进食管鳞状细胞癌发展[13]。使用Crispr/Cas9敲除多种细胞系DHX9基因均以失败告终,小鼠DHX9的纯合缺失导致胚胎致死效应,表明DHX9的功能是必不可少的[12]。研究表明,DHX9与多种实体肿瘤发生、发展及预后相关,在肝细胞癌(hepatocellular carcinoma,HCC)中,DHX9表达显着上调,并能促进HCC细胞生长和转移[6,14]。

图4 DHX9敲低对caspase-9、Bcl-2蛋白表达的影响A.Western blot法检测凋亡相关蛋白caspase-9、Bcl-2的表达水平,β-actin作为内参基因;B.caspase-9、Bcl-2表达统计结果。*P<0.05, **P<0.01,***P<0.001
DHX9在结直肠癌中过表达,通过刺激NF-κB靶基因转录,促进癌细胞增殖、抗凋亡及侵袭[4]。DHX9表达上调还与前列腺癌患者的不良预后相关[5]。然而,在甲状腺癌中,沉默DHX9增强了癌细胞的增殖和迁移[15]。尽管DHX9在实体肿瘤中研究广泛,但目前尚缺乏在血液恶性肿瘤中的研究报道。DHX9家族成员DHX15、DDX41已被报道与AML发病相关,其中DDX41胚系突变被认为是>5% AML患者的病因,表明RNA解旋酶家族的异常有助于血液系统恶性肿瘤的发展[10,16]。DHX9可能同样在血液恶性肿瘤的发生及疾病进展机制中发挥着调控作用。
p53作为一种转录因子,对参与细胞周期停滞、凋亡及DNA修复等过程的基因进行转录调节,因而在抑制肿瘤发生、发展中发挥重要作用[17,18]。p53是肿瘤发生和治疗过程中的关键基因,肿瘤组织p53水平升高是一些抗肿瘤药物发挥效应所必需的[19]。据报道,p53在肿瘤细胞中表达下调,因此,重新激活p53可能是治疗肿瘤的新策略[20]。铁螯合剂地拉罗司增强线粒体功能障碍,并通过稳定p73来恢复p53信号转导,改善OS并延缓MDS白血病转化[21]。顺铂通过ATR/ATM及其下游靶标信号介导p53信号激活,在白血病中发挥独特的抗癌作用[20]。研究表明,DHX9协同p53调控细胞生命进程。在人原代成纤维细胞中,DHX9缺失以p53依赖的方式阻断DNA复制,导致细胞过早衰老[22]。Dong等[23]在DHX9缺陷小鼠的胸腺上皮细胞中观察到p53信号通路上调。上述研究揭示DHX9对p53存在调控作用。DHX9作为一种依赖于RNA和DNA的解旋酶,与DNA损伤和修复相关;而p53作为一种肿瘤抑制因子,在涉及多种信号通路的DNA损伤反应中发挥核心作用[24]。DNA的损伤修复和细胞凋亡可能是联系DHX9和p53的关键。
本研究结果显示,在AML中,DHX9表达水平显着上调。通过构建稳定低表达DHX9的K562细胞发现,敲低DHX9显着增加细胞凋亡,抑制细胞增殖,并增加细胞对抗肿瘤药物阿扎胞苷的敏感度。进一步研究发现,DHX9缺乏引起的差异表达基因显着富集在p53信号通路,且敲低DHX9后,凋亡相关蛋白caspase-9表达增加,Bcl-2则表达下调。以上实验结果表明,抑制DHX9能够激活p53依赖的细胞凋亡程序,提示DHX9可能作为一种致癌基因,促进AML细胞的增殖。然而,DHX9在其他血液肿瘤或白血病的其他细胞系是否也有同样的调控作用,以及DHX9通过何种机制调控p53信号通路有待于进一步研究。
AML是一种高度异质性的血液系统恶性肿瘤,约占成人白血病的70%[25]。从高剂量阿糖胞苷和柔红霉素的“7+3”疗法,到同种异体干细胞移植,近年来,随着对AML的逐步了解,以靶向药物为代表的新型疗法在抗肿瘤治疗中获得显着疗效[26]。然而,复发难治性白血病仍然是一个挑战。进一步阐明发病机制,寻找早期诊治靶点需求十分迫切。由于DHX9在多种恶性肿瘤中存在过表达,抑制DHX9对大多数肿瘤细胞具有致死性,因此,可能成为恶性肿瘤治疗的新靶点[27]。本研究探讨了DHX9在AML中的生物学功能,揭示了DHX9对p53信号通路的调控作用,并提出DHX9可能作为一种致癌基因促进AML的发生、发展。



