于大海 齐士勇 李 凯 唐迎九 薛钧尘 王克明
肾癌是泌尿系常见的恶性肿瘤之一,发病隐匿。临床上,通常将肿瘤直径>10 cm或侵及全肾者称为巨大肾癌[1]。巨大肾癌往往是局部进展性或转移性肾癌,目前对其治疗方法、时机及治疗是否有临床价值仍存在不同看法。2006年7月—2008年7月,我院对16例诊断为巨大肾癌的患者予以术前肾动脉栓塞、联合经腹入路根治性切除、术后免疫治疗的综合治疗方案,手术效果满意,现报告如下。
1 资料与方法
1.1 一般资料 本组16例,男9例,女7例。年龄56~73岁,平均(61.00±6.23)岁。其中 5例以无痛肉眼血尿,7例以腰部疼痛不适就诊,4例为查体发现。右肾癌8例,左肾癌8例。CT检查发现肿瘤最大直径9~14 cm,平均11.2 cm,3例合并肾静脉瘤栓,1例背部转移,1例肺部单发转移,1例肺部多发转移。根据2002年AJCC肾癌TNM分期,术前分期为:T2N0M02例,T3aN0M08例,T3bN1M03例,T3aN0M12例,T4N0M11例。
1.2 手术方法
1.2.1 肾动脉栓塞 16例均采用Seldinger技术,明确肾肿瘤的部位、大小、供血动脉及有无静脉瘤栓;超选择栓塞肿瘤供血动脉。栓塞剂为碘油、明胶海绵颗粒及弹簧圈。
1.2.2 经腹腹膜后入路肾癌根治术 16例患者在栓塞后48 h行根治性肾切除术。采用患侧肋缘下切口,即切口起自患侧第11肋骨尖沿肋骨缘做一横行切口,切口的终点越过腹直肌的外侧缘。应用圆盘自动拉钩暴露手术野。15例在腋前线与腋中线之间进入腹膜后间隙,1例粘连较重而打开结肠旁沟进入腹膜后间隙。在Gerota筋膜外将腹膜推向对侧,寻至腹主动脉和下腔静脉,解剖肾蒂,先结扎肾动脉、后结扎肾静脉,其中2例右肾肿瘤怀疑肾静脉瘤栓者,采取袖状切开下腔静脉,腔静脉切口5-0血管缝线处理。在肾周筋膜外切除患肾。对肾门、腔静脉、腹主动脉旁淋巴结进行清扫。
1.3 辅助治疗 16例患者均采用小剂量白细胞介素(IL)-2辅助免疫治疗,第1周:2.5×105IU/kg皮下注射连用5 d;第2~6周:1.25×105IU/kg皮下注射每周连用5 d,每8周为1个周期,其中1例肺多发转移患者口服舒尼替尼(Sunitinib)50 mg/d,连用4周停药2周治疗。
1.4 随访 所有患者定期门诊复查随访,监测肝肾功能、胸片、腹部超声和(或)核素骨扫描,必要时复查CT,以监测有无复发或远处转移。
2 结果
2.1 栓塞及手术结果 16例栓塞后均有轻中度腰腹痛,对症处理后缓解;6例患者栓塞后6~12 h开始有不同程度发热,最高达37.5℃~38.0℃;3例出现恶心、呕吐;5例轻微腹胀,1~2 d后均自行缓解;1例栓塞后血压明显升高;无异位栓塞并发症。所有患者栓塞术后48 h行经腹根治性肾切除术。手术时间 2.10~3.25 h,平均(2.50±0.83)h;术中出血 100~500 mL,平均(230±51)mL。术后 7~10 d 出院。
2.2 病理结果 透明细胞癌14例,嗜色细胞癌2例;淋巴结转移3例,1例同侧肾上腺转移,术后经病理证实为肾上腺转移透明细胞癌。合并肾静脉瘤栓的3例,其中左肾肿瘤1例,右肾肿瘤2例;肿瘤静脉瘤栓分期为0级2例,1级1例。
2.3 随访结果 16例患者术后随访6~30个月,平均(18.00±3.24)个月,1例术后6个月死亡,1例术后6个月出现肺内多发转移而进行放疗,1例患者肺转移灶减小,见图1。术后1年15例生存,目前仍在严密随访中。
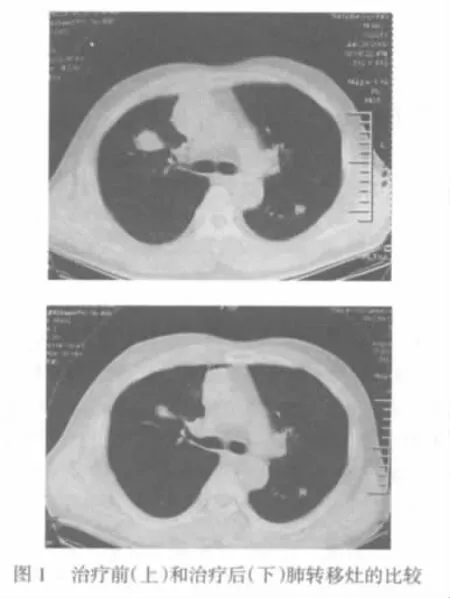
3 讨论
巨大肾癌多为中晚期,对这类患者原发灶病变是否应切除有两种观点:一种认为癌已发生转移,手术切除原发灶已无意义;而多数学者认为对此类患者应将原发灶切除,主要理由有以下两点:(1)文献报道肾癌转移灶可自行消退,且多发生在原发灶手术切除或放疗术后,其中以肺部转移灶消退最多。(2)切除原发病变可减少过剩抗原,改善机体免疫功能,并可解除原发病灶引起的血尿、疼痛等临床症状。在美国切除肾癌原发灶已列为晚期肾癌患者的临床常规治疗方法[2]。而在我国尚处于摸索阶段。
巨大肾癌因局部压迫、浸润严重或合并静脉癌栓、邻近淋巴结转移等因素,手术难度大。在根治术前行介入治疗的优势有:(1)使肿瘤明显缩小,提高手术切除率。(2)肾动脉栓塞使肾静脉压力下降,肾内或肾静脉瘤栓向肾外尤其是向双肺播散机会明显减少。(3)术前肿瘤坏死组织刺激机体免疫系统,提高免疫功能[3]。本组16例手术患者,术中见肿瘤明显缩小,肾表面侧支血供少,术野无明显出血,手术中钳夹肾蒂容易,虽与邻近组织有粘连,但分离容易,手术操作方便,均顺利手术切除原发灶。本组1例肺转移患者,采取手术切除原发灶并配合免疫治疗处理,发现肺内转移灶减小。因此,笔者认为有转移灶的肾癌患者在不能手术切除转移灶的情况下,如条件允许应尽量切除原发灶以消除症状,改善机体免疫功能,术后再配合免疫治疗可取得较好效果。
肾癌的生物学特性使得免疫治疗成为有效方法。目前,IL-2和(或)干扰素(IFN)-α为转移性肾癌治疗的一线治疗方案。本组16例患者均采用低剂量IL-2皮下给药方式治疗,疗效确实且未发现明显的不良反应。近年来,随着对肾癌生物学和分子发病机制理解的加深,相继有多种分子靶向治疗药物问世。酪氨酸激酶抑制剂舒尼替尼(SU11248)是一种主要针对VEGF和PDGF受体的小分子酪氨酸激酶抑制剂[4]。研究表明,采用舒尼替尼一线治疗转移性肾癌不失为大剂量IL-2外另一选择[5]。本组1例肺转移的患者手术切除原发灶后口服舒尼替尼50 mg/d,连用4周停药2周治疗,肺转移灶稳定且随访中见病灶减小。
总之,巨大肾癌的治疗非单一手段能解除患者的痛苦,需要多元化综合治疗。在条件允许的情况下巨大肾癌应采用术前肾动脉栓塞、手术切除原发灶辅以术后免疫治疗和(或)靶向治疗的综合治疗原则。
[1] 潘柏年,徐仁方,郭晓,等.肾癌525例临床分析[J].中华泌尿外科杂志,2000,21(3):135-137.
[2] Garcia JA,Rini BI.Recent progress in the management of advanced renal cell carcinoma[J].Ca Cancer J Clin,2007,57(2):112-125.
[3]Serafin Z,Karolkiewicz M,Strzesniewski P,et al.Palliative percutaneous kidney embolization with enbucrilate in patients with renal cell carcinoma:safety and symptom control[J].Med Sci Monit,2007,13(Suppl 1):98-104.
[4] Merseburger AS,Waalkes S,Kuczyk MA.Current state of systemic therapy of metastatic renal cell carcinoma[J].Urologe A,2009,48(9):983-984,986,988-989.
[5]Reddy K.PhaseⅢstudy of sunitinib malate(SU11248)versus interferon-alfa as first-line treatment in patients with metastatic renal cell carcinoma[J].Clin Genitourin Cancer,2006,5(1):23-25.



