皮淑芳 邸阜生 王怀祯 王 禹 李 鑫
胰岛素抵抗(insulin resistance,IR)是机体组织或靶细胞对胰岛素的作用缺乏正常反应,其敏感性和反应性降低的一种代谢状态[1]。IR能够引起肥胖、高脂血症、高血压、糖尿病等多种疾病。近年研究发现IR可使血小板活化,表现为血小板黏附率、聚集率增加,易于血栓形成。磷脂酰肌醇3-激酶(PI3-K)是血小板活化信号传导通路中的关键酶,本研究旨在探讨IR对血小板内PI3-K活性的影响,进一步明确IR导致血小板活化的机制。
1 材料与方法
1.1 实验动物 德国比格犬24只,雌雄不拘,月龄8~10个月,平均体质量(10.8±1.2)kg,购于军事医学科学院实验动物基地。
1.2 试剂与仪器PI3-K多抗、碱性磷酸酶二抗购自北京中山试剂公司,Satacruz公司生产;血小板激活剂(ADP,20 μmol/L,美国Biopool公司);聚集仪(LBY-NJ2型,北京普利生);黏附仪(中国医学科学院血液学研究所);流式细胞仪(FACSort Calibur型,美国Becton Dickion公司);微量泵(SP-100 s型,JMS公司);蠕动泵(DDB-320型,上海之信仪器有限公司)。
1.3 造模与分组24只动物随机分为2组:对照组12只,普通喂养,于每天08:00、16:00给予常规膨化饲料(购自军事医学科学院实验动物中心)投喂。每100 g饲料含粗蛋白28.2 g,脂肪3.6 g。每只动物每日进食约400 g,摄入总热量65 kcal/kg(1 kcal=4.184 0 kJ),其中蛋白及碳水化合物占81%,脂肪占19%;实验组12只,给予高脂喂养,拟建立IR动物模型[2],每1 000 g常规实验室饲料增加熟牛油150 g,每只动物每天进食约500 g,摄入总热量156 kcal/kg,其中蛋白及碳水化合物占47%,脂肪占53%。2组动物喂养6个月后进行正常血糖-高胰岛素钳夹试验,确认其是否存在IR[3],实验以葡萄糖输注速度(glucose infusion rate,GIR)表示,输注速度慢,说明胰岛素降低血糖的有效性减低,可以认定机体存在IR。
1.4 检测指标2组动物喂养6个月后取清晨空腹静脉血,测定相关指标:体质量(BM)、空腹血糖(FPG)、空腹胰岛素(FINS)、三酰甘油(TG)、总胆固醇(TC)、血小板黏附率(玻球法)、血小板聚集率(比浊法)。以血小板黏附率、聚集率反映血小板活化状态。其中血小板内PI3-K活性测定采用流式细胞仪分析技术,方法为:PI3-K多抗10 μL,加入动物静脉血标本10 μL,37℃温育30 min,加入碱性磷酸酶标记二抗4 μL,温育30 min,流式细胞仪测定结果,PI3-K表达百分率即代表PI3-K活性。
1.5 统计学处理 采用SPSS 12.0进行分析,计量资料以均数±标准差(±s)表示,组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 2组动物相关代谢指标及正常血糖-高胰岛素钳夹试验 实验组动物高脂喂养6个月后,BM、TC、TG、FPG、FINS均明显高于对照组,GIR低于对照组,差异均有统计学意义(P<0.05或P<0.01),实验组动物存在IR,见表1。
表1 2组动物相关代谢指标及正常血糖-高胰岛素钳夹试验结果比较 (n=12±s)
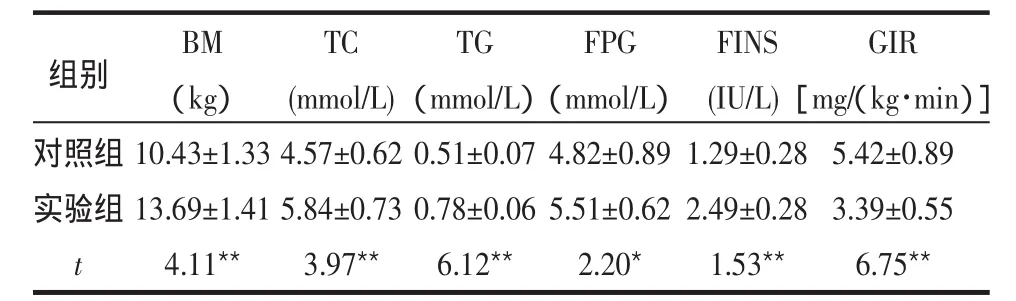
表1 2组动物相关代谢指标及正常血糖-高胰岛素钳夹试验结果比较 (n=12±s)
*P<0.05,**P<0.01
对照组实验组t BM(kg)10.43±1.33 13.69±1.41 4.11**TC(mmol/L)4.57±0.62 5.84±0.73 3.97**TG(mmol/L)0.51±0.07 0.78±0.06 6.12**FPG(mmol/L)4.82±0.89 5.51±0.62 2.20*FINS(IU/L)1.29±0.28 2.49±0.28 1.53**GIR[mg/(kg·min)]5.42±0.89 3.39±0.55 6.75**组别
2.2 2组动物血小板黏附率、聚集率及PI3-K活性结果比较 实验组动物的血小板黏附率、聚集率、PI3-K活性明显高于对照组,差异有统计学意义(P<0.05或P<0.01),见表2。
表2 血小板黏附率、聚集率、PI3-K活性结果比较(%±s)

表2 血小板黏附率、聚集率、PI3-K活性结果比较(%±s)
*P<0.05,**P<0.01
组别对照组实验组t PI3-K 57.19±4.17 61.02±2.67 2.68*黏附率34.83+4.76 48.16+7.63 5.14**聚集率23.83+5.65 33.67+6.53 5.5**
3 讨论
目前建立IR动物模型最常用的方法为高脂喂养,高脂血症造成IR的中心环节是脂肪细胞产生前炎症细胞因子,分泌过量的肿瘤坏死因子α、游离脂肪酸、白介素-6等,这些物质引起机体氧化应激反应,产生活性氧,干扰细胞胰岛素信号传导,导致IR。本研究中,实验组动物高脂喂养半年后经正常葡萄糖-高胰岛素钳夹试验确认存在胰岛素抵抗,证实了高脂喂养方法建立IR动物模型的有效性。
本研究实验组动物血小板黏附率、聚集率高于对照组,提示IR可以引起血小板活化,这与相关研究结果一致[4-5]。目前研究认为血小板的活化是通过磷脂酰肌醇3-激酶-蛋白激酶B-一氧化氮-环一磷酸鸟苷(PI3-K-AKT-NO-cGMP)这一信号途径实现[6-7]。这一理论指出血小板活化过程中PI3-K首先活化Akt,再经过NO-cGMP信号途径调节血小板活化反应。PI3-K的最终作用底物是来自膜磷脂的磷脂酰肌醇(PtdIns),催化其肌醇环上的第3位羟基磷酸化,生成磷脂酰肌醇-3,4-二磷酸[PtdIns(3,4)P2]和磷脂酰肌醇-3,4,5-三磷酸[PtdIns(3,4,5)P3],它们定位于血小板膜骨架蛋白,使血小板膜糖蛋白GPIIb/IIIa形成复合体分布于血小板膜表面,并暴露纤维蛋白原结合位点,使血小板活化,发生黏附、聚集反应。PtdIns(3,4,5)P3还可以调节血小板内激酶活性引起血小板释放反应[6],将贮存在致密体、α-颗粒或溶酶体内的二磷酸腺苷(ADP)、三磷酸腺苷(ATP)、5-羟色胺、Ca2+等许多物质释放,这些物质是强烈的血小板激活剂,使血小板反应迅速放大,引起血小板活化的正反馈。因此PI3-K对于血小板活化具有重要意义。本研究中实验组动物PI3-K表达增加,说明IR可以引起PI3-K活性增强,即在IR状态下血小板内PI3-K-AKT-NO-cGMP信号途径处于活跃状态,引起血小板活化,这与实验得出的存在IR的动物血小板黏附率、聚集率增高的结果相符合。
目前关于IR对PI3-K活性影响的相关研究尚少,对血小板内PI3-K活性有直接影响的是血小板膜流动性的改变。本研究中IR动物存在体质量增加、高血脂、高血糖、高胰岛素血症等多种代谢紊乱,与相关研究结果一致[8]。其中,高血糖可以通过糖基化终产物减弱血小板的膜流动性,这种改变作为一种物理信号引起血小板内非受体性酪氨酸激酶的激活,并进一步激活PI3-K,但在IR引起的其他代谢异常中,还有哪些因素可以引起PI3-K活性改变,尚有待进一步研究。
[1]储毓舜,梁静,张成,等.胰岛素抵抗与冠心病危险因素的相关性分析[J].天津医药,2008,36(6):427-429.
[2]田爱平,郭赛珊,申竹芳.高脂饲料与胰岛素抵抗动物模型[J].中国药理学通报,2006,22(3):267-269.
[3]DeFronzo RA,Tobin JD,Andres R.Glucose clamp technique:a method for the quantifying insulin secretion and resistance[J].Am J Physiol,1979,237(3):214-223.
[4]Stefania B,Giovanni P,Maria TG,et al.Insulin resistanceas a determinant of platelet activation in obese women[J].J Am Coll Cardiol,2006,48(11):2531-2538.
[5]Schneider DJ.Factors contributing to increased platelet reactivity in people with diabetes[J].Diabetes Care,2009,32(4):525-527.
[6]Stojanovic A,Marjanovic JA,Brovkovych VM,et al.A phosphoinositide 3-kinase-AKT-nitric oxide-cGMP signaling pathway in stimulating platelet secretion and aggregation[J].J Biol Chem,2006,281(24):16333-16339.
[7]Randriamboavonjy V,Fleming I.Insulin,insulin resistance,and platelet signaling in diabetes[J].Diabetes Care,2009,32(3):528-530.
[8]Lusha X,Jennifer D,Cory C,et al.Insulin resistance and impaired functional vasodilation in obese Zucker rats[J].Am J Physiol Heart Circ Physiol,2008,294(4):1658-1666.



