曹惠鹃 周 锦 张铁铮 孙莹杰 姚 婧
体外循环(CPB)继发脑损伤的原因包括CPB期间的低温、低灌注状态,非搏动血流,炎性介质及血管内微栓等。这些因素共同作用,促进了CPB期间脑缺氧/缺血和全身炎症反应,导致氧自由基形成过多和抗氧化物质的损耗。N-乙酰半胱氨酸(NAC)是细胞维持正常生理功能的重要化合物——谷胱甘肽(GSH)的前体物质,对氧化应激、缺血-再灌注损伤等有一定的防治作用。本研究通过建立大鼠CPB模型,观察NAC对CPB大鼠血浆脑损伤标志物、炎性因子及海马区神经元超微结构的影响,探讨NAC对CPB致大鼠脑损伤的保护作用。
1 材料与方法
1.1 材料 24只健康雄性清洁级SD大鼠,4~6个月龄,体质量300~400 g,购自沈阳军区总医院实验动物中心。按随机数字表分为假手术组(S组)、CPB组(C组)、CPB+NAC组(N组),每组8只。S组仅置管,不进行CPB;C组和N组进行CPB 1 h,然后观察2 h。N组在预充液中加入NAC(美国Sigma公司,批号A-7250)100 mg/kg,然后以20 mg/(kg·h)速度输注1 h直到停转流,C组输注等容量生理盐水。
1.2 CPB模型建立与标本采集 24只大鼠在实验前禁食水6 h,腹腔内注射10%水合氯醛350 mg/kg麻醉,窥喉后经口气管插管,接TKR200C型呼吸机行机械通气(江西省特力麻醉呼吸设备公司),呼吸频率60次/min,潮气量10 mL/kg,吸入100%氧气。四肢连接心电图导联,接多功能监测仪(美国太空公司)行心电监测,置直肠温探头行深部体温监测。左股静脉建立静脉通道,微量泵泵注乳酸林格氏液2 mL/h。左股动脉置管监测有创动脉压。静脉注射肝素300 IU/kg全身肝素化。采用特制带网状侧孔16 G穿刺导管置入右颈内静脉至右心房水平,引流静脉血至贮血槽;右侧颈动脉置24 G套管针,连接动脉灌注管。CPB环路主要由静脉引流管、贮血槽、大鼠微型膜氧合器(广东科威医疗器械有限公司)、BT00-300M型恒流蠕动泵(保定兰格恒流泵有限公司)及动脉灌注管组成。采用无血预充,预充液总量约16 mL,由乳酸钠林格氏液7 mL、琥珀酰明胶7 mL、20%甘露醇1 mL、5%碳酸氢钠1 mL及肝素钠150 IU/kg组成。CPB管理参照Cai等[1]介绍的方法。S组于穿刺后3 h,其余组于CPB结束后2 h取静脉血3 mL,立即 4 ℃、3 000 r/min、离心5 min,分离血浆,-40℃保存;取大鼠左侧脑组织,-70℃保存;取大鼠左侧半球海马区脑组织,切成1 mm×1 mm×1 mm小块若干,置入2.5%戊二醛保存。
1.3 检测指标 (1)应用双抗体夹心ELISA法检测大鼠血浆神经元特异性烯醇化酶(neuron specific enolase,NSE)、S-100β蛋白水平(试剂盒购自美国Biokey公司,具体操作按说明书进行)。(2)应用放射免疫分析法测定大鼠血浆肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和白细胞介素-6(interleukin-6,IL-6)浓度(试剂盒购自天津九鼎医学生物工程有限公司)。(3)低温下取脑组织,制备10%的脑组织匀浆,根据测定试剂盒(南京建成生物工程研究所)说明书对脑组织匀浆丙二醛(malondialdehyde,MDA)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-px)进行测定。(4)将取出的大鼠左侧海马区脑组织小块,置入1%锇酸固定,乙醇梯度脱水,环氧树脂包埋后切片,铀、铅双染色,置于透射电镜下观察海马区神经元细胞的超微结构。
1.4 统计学处理 应用SPSS 17.0软件进行分析,计量资料以均值±标准差(±s)表示,组间比较采用单因素方差分析,组间两两比较采用SNK-q法,P<0.05为差异有统计学意义。
2 结果
2.1 血浆NSE、S-100β蛋白、TNF-α和IL-6水平的变化 与S组比较,C组血浆NSE水平升高(P<0.01),C组和N组血浆S-100β蛋白、TNF-α和IL-6水平均升高(P<0.01);与C组比较,N组血浆NSE、S-100β蛋白、TNF-α和IL-6水平均降低(P<0.05或P<0.01),见表1。
Table 1 Comparison of plasma levels of NSE,S-100β protein,TNF-α and IL-6 between groups表1 各组血浆NSE、S-100β蛋白、TNF-α和IL-6水平的比较 (n=8,±s)
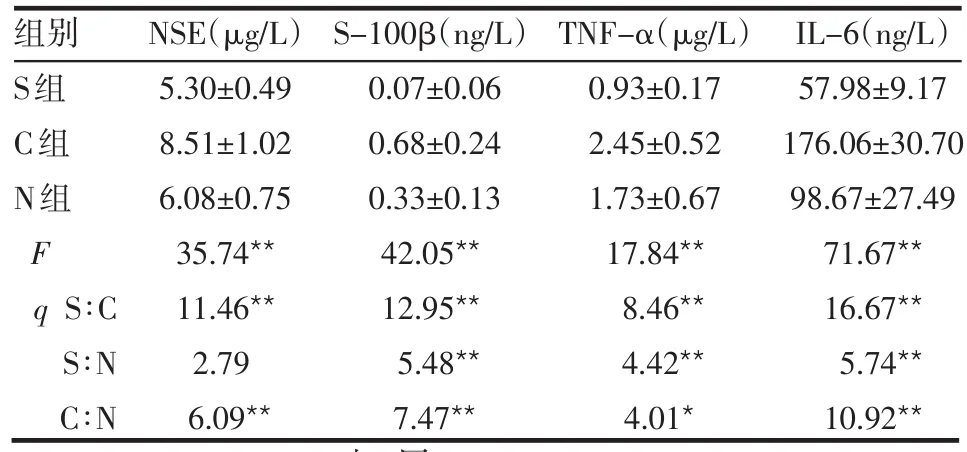
Table 1 Comparison of plasma levels of NSE,S-100β protein,TNF-α and IL-6 between groups表1 各组血浆NSE、S-100β蛋白、TNF-α和IL-6水平的比较 (n=8,±s)
*P<0.05,**P<0.01;表2同
组别S组C组N组F q S∶C S∶N C∶N NSE(μg/L)5.30±0.49 8.51±1.02 6.08±0.75 35.74**11.46**2.79 6.09**S-100β(ng/L)0.07±0.06 0.68±0.24 0.33±0.13 42.05**12.95**5.48**7.47**TNF-α(μg/L)0.93±0.17 2.45±0.52 1.73±0.67 17.84**8.46**4.42**4.01*IL-6(ng/L)57.98±9.17 176.06±30.70 98.67±27.49 71.67**16.67**5.74**10.92**
2.2 脑组织MDA和GSH-px含量的变化 与S组比较,C组、N组脑组织MDA含量升高、GSH-px含量降低(P<0.05或P<0.01);与C组比较,N组脑组织MDA降低、GSH-px含量升高(P<0.01),见表2。
Table 2 Comparison of MDA and GSH-px contents in brain tissue between groups表2 各组脑组织MDA和GSH-px含量的比较 (±s)
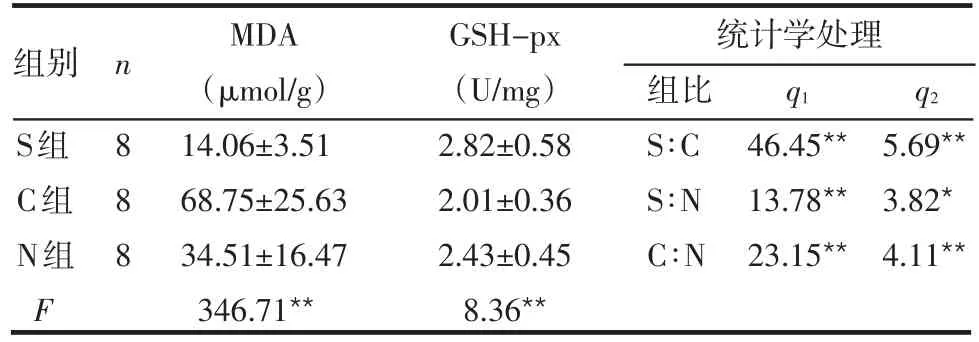
Table 2 Comparison of MDA and GSH-px contents in brain tissue between groups表2 各组脑组织MDA和GSH-px含量的比较 (±s)
q1、q2分别为MDA和GSH-px组间两两比较结果
组别 n q1q2 S组C组N组F 8 8 8 MDA(μmol/g)14.06±3.51 68.75±25.63 34.51±16.47 346.71**GSH-px(U/mg)2.82±0.58 2.01±0.36 2.43±0.45 8.36**统计学处理组比S∶C S∶N C∶N 46.45**13.78**23.15**5.69**3.82*4.11**
2.3 超微结构的改变 S组海马区神经元细胞形态正常,各细胞器未见异常;C组神经元细胞核变性、坏死,线粒体明显肿胀、内有空泡形成;N组神经元内线粒体轻微水肿,电镜结果见图1~3。
3 讨论
CPB心脏手术后约有30%的患者产生一定程度的器质性或功能性脑损伤,包括认知功能障碍,甚至致命性脑中风[2]。因此,有效地减少体外循环后的神经系统并发症是临床工作中急需解决的问题。目前,在围CPB过程中应用药物进行干预以减轻CPB后神经精神并发症是CPB脑保护策略中重要的一部分。
NAC是广泛应用的抗氧化剂,具有潜在的抗氧化和抗炎作用。NAC通过中和氧自由基、保护细胞膜、维持内皮细胞功能发挥保护作用[3]。研究表明,在损伤后静脉应用NAC能显着改善缺氧-复氧新生猪的颈动脉血流和氧供,减少脑皮质Caspase-3和脂质过氧化物含量的增加[4]。在CPB预充液中加入NAC,能够减轻CPB对大鼠的肾损伤,且呈剂量依赖性[5]。而NAC对CPB所诱导的脑损伤是否具有保护作用,国内外罕见报道。心胸手术过程中应用CPB使机体与非生理表面接触,CPB过程的非搏动血流、低灌注状态等可激活氧化应激反应,而氧化应激反应可进一步激活炎性反应[6]。因此,选用具有抗氧化性质的试剂减轻氧化应激和氧化应激引起的炎性反应,以减少CPB后神经系统并发症,为CPB后脑保护提供新思路和实验依据。
NSE主要存在于中枢神经系统的神经元和神经内分泌细胞,S-100β蛋白浓度特异性地存在于中枢神经系统的神经胶质细胞、前部垂体细胞和郎罕细胞。NSE、S-100β蛋白分子质量大,正常情况下不能通过血脑屏障。当神经元、神经胶质细胞损伤或坏死后,NSE和S-100β蛋白迅速从细胞内溢入脑脊液,通过受损的血脑屏障进入血液中,致血浆NSE和S-100β蛋白浓度升高,其含量可反映神经元和神经胶质细胞损伤的程度,对早期直接而准确地了解脑损伤程度及评价患者的预后具有重要的临床意义[7]。本研究表明,CPB使大鼠血浆NSE和S-100β蛋白浓度升高,提示CPB使神经元细胞和神经胶质细胞膜受损,NSE和S-100β蛋白释放至细胞外间隙,通过受损的血脑屏障进入血液。NAC可减少大鼠血浆NSE和S-100β蛋白水平的升高,提示其可以减轻CPB所致的神经元细胞和神经胶质细胞损伤。
TNF-α与IL-6是CPB过程产生的促炎因子。TNF-α是引起炎性级联反应的一个重要而又具有广泛生物学活性的细胞因子,它也是炎性反应释放最早和最重要的内源性介质。TNF-α可激活中性粒细胞释放弹性蛋白酶和氧自由基等,参与中性粒细胞介导的内皮损伤,如果释放到细胞外,可引起自身组织的破坏。有研究表明,TNF-α在CPB过程中持续升高,在CPB结束后2 h达高峰[8]。IL-6是脑损伤炎症反应链中的一种重要炎性细胞因子,主要通过诱导最初的炎性级联反应、诱导血管内皮黏附因子表达、增强兴奋性氨基酸毒性作用、降低脑血流、增加血脑屏障通透性等机制在继发性脑损伤中发挥作用[9]。基于上述原因,以TNF-α和IL-6作为反映CPB中炎性反应的指标。本研究表明,CPB使大鼠脑组织脂质过氧化反应的代谢产物MDA含量升高、氧自由基清除剂GSH-px含量降低,使血浆TNF-α和IL-6水平均升高,提示CPB可诱发氧化应激和炎性反应。NAC可减少CPB诱导的大鼠脑组织MDA含量的升高及GSH-px含量的降低,可降低血浆TNF-α、IL-6水平的升高,提示NAC可降低CPB所诱发的氧化应激和炎性反应程度。
海马区是大脑对缺血缺氧最敏感的部位之一,本研究的电镜结果显示,CPB可致大鼠海马区神经元细胞线粒体水肿、核变性,而在CPB期间应用NAC可以减轻其病理性损伤。
Figure 1 Computed tomography imaging of tumour in right lobe of liver approach medium-sized vein图1 CT影像提示肝右叶肿瘤临近肝中静脉
Figure 2 Three-dimensional computer reconstruction of the relationship between tumour and medium-sized vein of liver图2 计算机三维重建显示肿瘤与肝中静脉的关系
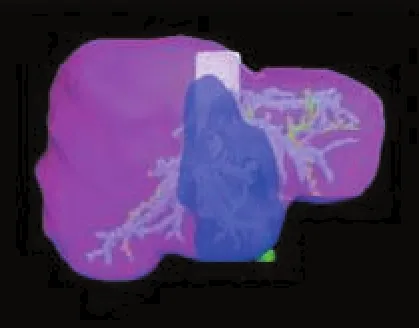
Figure 3 Three-dimensional computer reconstruction of the congestion area(blue color)at the left of internal lobe after resection of medium-sized vein图3 计算机重建切除肝中静脉后左内叶的淤血区域(蓝色)
[1]Cai DS,Jin BB,Pei L,et al.Protective effects of penehyclidine hydrochloride on liver injury in a rat cardiopulmonary bypass model[J].Eur J Anaesthesiol,2010,27(9):824-828.
[2]Biller J,Hocker S,Morales-Vidal S.Neurologic complications of cardiac surgery and interventional cardiac procedures[J].Hosp Pract(Minneap),2010,38(4):83-89.
[3]Bemeur C,Vaquero J,Desjardins P,et al.N-acetylcysteine attenuates cerebral complications of non-acetaminophen-induced acute liver failure in mice:antioxidant and anti-inflammatory mechanisms[J].Metab Brain Dis,2010,25(2):241-249.
[4]Liu JQ,Lee TF,Chen C,et al.N-acetylcysteine improves hemodynamics and reduces oxidative stress in the brains of newborn piglets with hypoxia-reoxygenation injury[J].J Neurotrauma,2010,27(10):1865-1873.
[5]Zhu J,Yin R,Shao H,et al.N-acetylcysteine to ameliorate acute renal injury in a rat cardiopulmonary bypass model[J].Thorac Cardiovasc Surg,2007,133(3):696-703.
[6]Baker WL,Anglade MW,Baker EL,et al.Use of N-acetylcysteine to reduce post-cardiothoracic surgery complications:a meta-analysis[J].Eur J Cardiothorac Surg,2009,35(3):521-527.
[7]Vos PE,Lamers KJ,Hendriks JC,et al.Glial and neuronal proteins in serum predict outcome after severe traumatic brain injury[J].Neurology,2004,62(8):1303-1310.
[8]Goebel U,Siepe M,Mecklenburg A,et al.Reduced pulmonary inflammatory response during cardiopulmonary bypass:effects of combined pulmonary perfusion and carbon monoxide inhalation[J].Eur J Cardiothorac Surg,2008,34(6):1165-1172.
[9]Winter CD,Pringle AK,Clough GF,et al.Raised parenchymal interleukin-6 levels correlate with improved outcome after traumatic brain injury[J].Brain,2004,127(2):315-320.



