王永明 乔佑杰 李家瑞 尚跃丰 尤丕聪
血必净对脓毒症大鼠巨噬细胞移动抑制因子和急性肾损伤的干预效果
王永明1乔佑杰2△李家瑞1尚跃丰1尤丕聪1
目的 观察脓毒症急性肾损伤大鼠肾组织及血清巨噬细胞移动抑制因子(MIF)的表达规律,并探讨血必净注射液对脓毒症大鼠MIF表达的影响及急性肾损伤的防治作用。方法采用盲肠结扎穿孔术(CLP)制备脓毒症模型。健康SD大鼠80只按随机数字表法分为假手术组(n=16)、模型组(n=32)和血必净组(n=32),分别于术后2、8、24和48 h 4个时间点处死取材。采用实时定量PCR检测肾组织MIF mRNA表达,酶联免疫法检测血MIF表达;同时用生化分析仪测定血清肌酐(Cr)水平。结果与假手术组比较,模型组大鼠肾组织MIF mRNA表达于CLP后8、24、48 h显着升高(P<0.05),血清MIF及Cr水平于CLP后24、48 h显着增高(P<0.05);与模型组比较,血必净组大鼠肾组织MIF mRNA于2、8、24、48 h明显下降(P<0.05),血清MIF及Cr水平于24、48 h亦显着下降(P<0.05)。结论MIF可能作为晚期炎症因子参与脓毒症大鼠急性肾损伤的病生理过程。血必净注射液可抑制MIF的表达,对脓毒症大鼠肾损伤具有保护作用。
脓毒症;巨噬细胞移动抑制因子;急性肾损伤;血必净注射液;肌酐
脓毒症是目前急危重症领域最受关注的临床难题之一,是引起重症患者发生急性肾损伤(acute kidney injury,AKI)的最主要原因。50%以上的AKI是由脓毒症所导致的,同时AKI的发生又可进一步加重脓毒症病情[1]。脓毒症导致的AKI如能早期发现并及时干预,可阻止肾脏功能的不可逆损伤,最终可能会降低患者的病死率[2]。研究发现巨噬细胞移动抑制因子(macrophage migration inhibitory factor,MIF)是一种重要的炎症因子,可通过促进多种炎症因子的产生和负向调节糖皮质激素的抗炎作用参与脓毒症的发病[3]。本研究通过建立大鼠脓毒症模型,应用中药血必净注射液(简称血必净)进行干预,观察肾组织及血清中MIF表达的变化规律及其与肾功能指标改变的关系,探讨血必净对脓毒症大鼠血清及肾脏MIF表达的影响及对肾损伤的防治作用。
1 材料与方法
1.1 材料 清洁级雄性SD大鼠80只,8~10周龄,体质量200~220 g,购自北京大学医学部实验动物中心;大鼠MIF酶联免疫吸附试验(ELISA)试剂盒、TRIZOL购自天津灏洋有限公司,实时定量PCR仪购自杭州博日科技有限公司。
1.2 方法
1.2.1 实验动物及分组 SD大鼠适应性饲养1周后随机编号1~80,以编号为依据采用抽签法随机抽取16只作假手术组、32只作模型组,32只作血必净组。每组按照处死动物取标本时间分为2、8、24、48 h 4个亚组,假手术组(每组4只),模型组及血必净组(每组8只),大鼠术后常规饲养。假手术组及模型组于术后开始给予生理盐水4 mL∕kg,血必净组于术后开始给予血必净4 mL∕kg,均为每12 h给药1次直至动物死亡或实验结束。
1.2.2 动物模型制备 参照Chaudry等[4]报道的方法建立盲肠结扎穿孔术诱导的大鼠脓毒症模型。脓毒症组及血必净组以4%水合氯醛,按300 mg∕kg腹腔注射麻醉后固定,75%乙醇腹部消毒。沿腹正中线做2.0 cm切口,找到盲肠,用7号丝线在盲肠根部结扎盲肠。用16号针穿刺盲肠2次,并留置一条宽0.5 cm、长2 cm橡皮引流条贯通盲肠以防针孔闭合,之后将盲肠还纳腹腔,逐层缝合腹壁切口。术毕立即予动物腹腔注射生理盐水20 mL∕kg抗休克。假手术组如同脓毒症造模术麻醉、消毒和开腹,找到盲肠后将其拉出腹外放置1 min之后还纳关腹。
1.2.3 标本的采集与处理 各实验组按照2、8、24、48 h分别处死大鼠,心脏取血,所取血样静置20 min后离心取血清。大鼠处死后开腹留取右侧肾组织100 mg用于制备肾组织匀浆。
1.2.4 指标检测 血清肌酐(Cr)使用 Beckman Coulter Dxc800型自动生化分析仪测定,血清MIF采用ELISA测定。应用实时定量PCR反应(q-PCR)检测肾组织MIF mRNA表达。引物由上海生物工程有限公司合成,MIF引物上游5′-CGCCCAGAACCGCAACTACA-3′,下游5′-GACCACGTGCACTGCGATGT-3′,扩增长度161 bp;β-actin引物上游5′-TCAGGTCATCACTATCGGCAA-3′,下游5′-AGCACTGTGTTGGCATAGAGG-3′,扩增长度169 bp。首先进行肾组织总RNA的制备,然后制备cDNA模板,确定目的基因退火温度,进行实时定量PCR反应,反应条件:95℃预变性10 min;94℃变性20 s,59℃退火20 s,40个循环;57~96℃绘制熔解曲线。按q-PCR说明书将各个标本的实时PCR结果以经β-actin校正后,应用2-ΔΔct计算后的比率值表示基因表达的相对变化。
1.3 统计学方法 数据采用SPSS 17.0软件进行分析,连续型数据服从正态分布者采用均数±标准差表示,3组间总体变化趋势比较采用析因设计方差分析,组内不同时间点比较、同一时间点不同组间比较采用单因素方差分析,多重比较采用LSD检验,P<0.05为差异有统计学意义。
2 结果
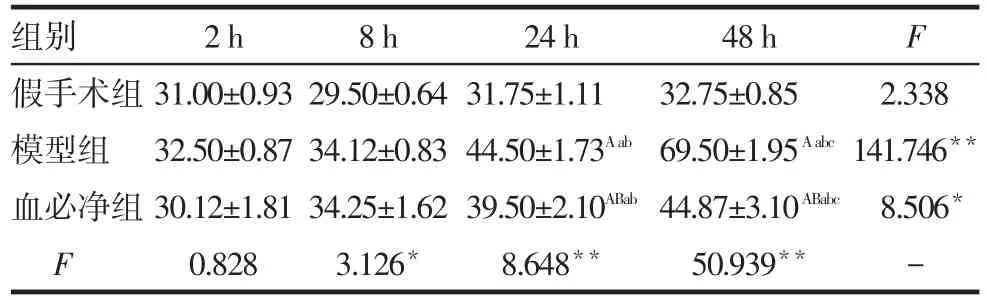
2.1 血清Cr变化 同组动物血清Cr水平在4个时间点的变化趋势不全相同(F=49.022,P<0.01),同一时间点3组动物间不全相同(F=50.968,P<0.01),时间与处理因素有交互作用(F=18.594,P<0.001),即3组动物在4个时间点的变化趋势不全相同。模型组24、48 h均高于血必净组,模型组和血必净组24、48 h均高于假手术组(均P<0.05);3组间2、8 h血清Cr水平差异均无统计学意义,见表1。
Tab.1 Changes of serum creatinine levels in each group表1 各组大鼠血清Cr水平的变化 (μmol∕L,±s)
Tab.1 Changes of serum creatinine levels in each group表1 各组大鼠血清Cr水平的变化 (μmol∕L,±s)
*P<0.05,**P<0.01;组间比较:A与假手术组比较,B与模型组比较,P<0.05;组内比较:a与2 h比较,b与8 h比较,c与24 h比较,P<0.05;假手术组各时间点n=4,模型组、血必净组各时间点n=8,表2、3同
组别假手术组模型组血必净组F 2 h 31.00±0.93 32.50±0.87 30.12±1.81 0.828 8 h 29.50±0.64 34.12±0.83 34.25±1.62 3.126*24 h 31.75±1.11 44.50±1.73Aab39.50±2.10ABab8.648**48 h 32.75±0.85 69.50±1.95Aabc44.87±3.10ABabc50.939**F 2.338 141.746**8.506*-
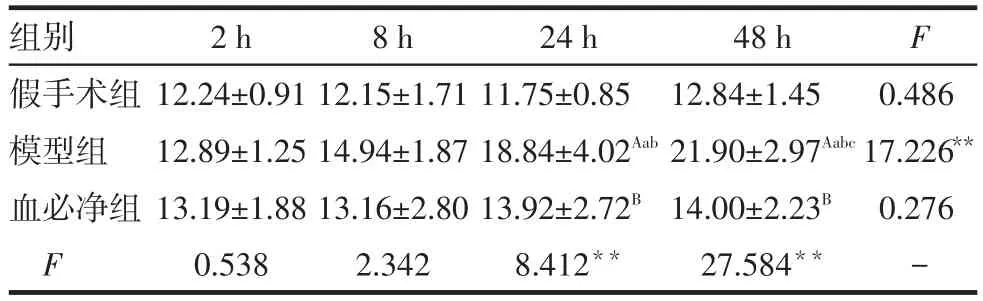
2.2 血清MIF变化 同组动物血清MIF水平在4个时间点的变化趋势不全相同(F=28.205,P<0.001),同一时间点3组间不全相同(F=7.395,P<0.001),时间与处理因素有交互作用(F=5.645,P<0.001),即3组动物血清MIF在4个时间点的变化趋势不全相同。模型组24、48 h均高于假手术组和血必净组(P<0.01);3组间2、8 h血清MIF水平差异无统计学意义,血必净组和假手术组血清MIF水平在24、48 h差异无统计学意义,见表2。
Tab.2 Changes of serum MIF levels in each group表2 各组大鼠血清MIF水平的变化 (μmol∕L,±s)
Tab.2 Changes of serum MIF levels in each group表2 各组大鼠血清MIF水平的变化 (μmol∕L,±s)
组别假手术组模型组血必净组F 2 h 12.24±0.91 12.89±1.25 13.19±1.88 0.538 8 h 12.15±1.71 14.94±1.87 13.16±2.80 2.342 24 h 11.75±0.85 18.84±4.02Aab13.92±2.72B8.412**48 h 12.84±1.45 21.90±2.97Aabc14.00±2.23B27.584**F 0.486 17.226**0.276 -
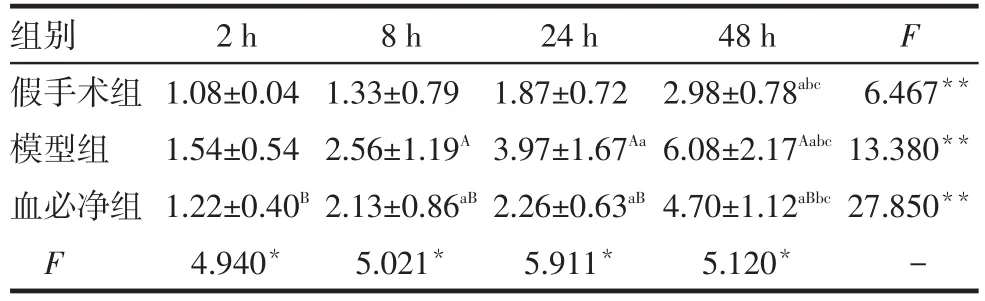
2.3 肾组织MIF mRNA变化 同组动物肾脏MIFmRNA表达水平在4个时间点的变化趋势不全相同(F=28.071,P<0.01),同一时间点3组动物间不全相同(F=13.426,P<0.01),时间与处理因素未见交互作用,即3组动物在4个时间点的变化趋势未见差别(F=1.691,P=0.137)。模型组在8、24、48 h均高于假手术组,血必净组在2、8、24、48 h均低于模型组(均P<0.01),见表3。
Tab.3 Changes of renal MIF mRNA expression in each group表3 各组大鼠肾组织MIF mRNA表达的变化 (±s)
Tab.3 Changes of renal MIF mRNA expression in each group表3 各组大鼠肾组织MIF mRNA表达的变化 (±s)
组别假手术组模型组血必净组F 2 h 1.08±0.04 1.54±0.54 1.22±0.40B4.940*8 h 1.33±0.79 2.56±1.19A2.13±0.86aB5.021*24 h 1.87±0.72 3.97±1.67Aa2.26±0.63aB5.911*48 h 2.98±0.78abc6.08±2.17Aabc4.70±1.12aBbc5.120*F 6.467**13.380**27.850**-
3 讨论
AKI是脓毒症及脓毒症休克患者最常见、最严重的并发症之一,肾脏功能轻度损伤即可造成脓毒症患者病死率的增加,是脓毒症患者死亡的独立危险因素[5]。多项研究表明脓毒症中的炎症因子可直接导致肾脏损伤[6]。既往的研究往往多靶向于脓毒症发病的早期炎症因子,而事实上对脓毒症患者进行治疗时,整个脓毒症过程的级联反应可能已经启动,因此国外一些研究机构开始寻找晚期炎症因子,以期扩大脓毒症治疗的时间窗。
Al-Abed等[7]在针对MIF抑制剂的研究中指出,MIF作为晚期炎症因子参与了脓毒症的发病,应用MIF抑制剂干预后,MIF的表达受到有效抑制,阻断了脓毒症的发生与发展,并不同程度地减轻了器官损害,对预后具有明显的改善作用。目前已有多项研究表明:在脓毒症的急性期,血清MIF水平的高低与脓毒症严重程度呈正相关[8]。另有研究表明:细菌内毒素或肿瘤坏死因子(TNF)均可诱导垂体前叶细胞、T淋巴细胞、巨噬细胞等释放MIF,通过细胞外调节激酶(EPK)途径诱导胞浆磷脂酶A2(cytoplasmic phospholipaseA2,CPLA2)的磷酸化并活化[9],最终导致花生四烯酸释放,花生四烯酸又能激活和促进TNF-α、白细胞介素(IL)-1β、IL-2、IL-6、IL-8等炎症因子表达、一氧化氮释放,造成组织、器官损害[10]。肾脏作为炎症因子攻击的靶器官之一,极易发生损伤。但目前有关脓毒症急性肾损伤过程中MIF表达的变化规律,及其与急性肾损伤的关系和药物有效干预的研究甚少。本研究结果显示:假手术组肾脏组织及血清中MIF有基础水平的表达,模型组大鼠CLP后血清MIF浓度24 h明显升高,48 h仍高于假手术组,具有产生较晚、下降缓慢的“晚期炎症因子”特征。与假手术组相比,模型组肾组织MIF mRNA的表达于CLP后8 h显着增强,提示肾脏功能障碍的血清Cr水平于CLP后24 h显着升高,提示MIF可能在诱导脓毒症大鼠急性肾损伤过程中发挥了重要作用,其致病过程可能与MIF吸引巨噬细胞侵润肾脏组织、诱导其释放大量炎性因子造成组织损伤有关。
血必净注射液是复方中药制剂,由红花、赤芍、川芎、丹参、当归5味中药组成,其主要有效成分包括红花色素、酚酸、黄酮苷和苯乙基苷类等[11]。该药是王今达教授根据“菌、毒、炎”并治理论自主开发用于治疗脓毒症及多器官功能障碍综合征(MODS)的有效药物,目前已广泛应用于急危重症的临床救治。研究表明血必净注射液具有拮抗内毒素、炎症因子以及维持正常抗感染免疫等作用,可通过多途径、多靶点、多环节效应阻止脓毒症发展、达到脏器保护作用,在脓毒症治疗中占有重要的地位。但目前有关血必净注射液对脓毒症性急性肾损伤中MIF表达的影响少见报道。本研究可见:CLP造模后采用血必净注射液干预可有效抑制肾组织MIF mRNA的合成,并下调大鼠血清MIF水平。与模型组相比,血必净组大鼠肾组织MIF mRNA表达在2、8、24、48 h明显下降,血清MIF水平在24、48 h也明显降低,表明血必净对脓毒症晚期炎症因子MIF的异常表达具有下调作用,从而可能有助于防止失控性炎症反应的进一步发展。应用血必净后大鼠血清Cr水平亦明显下降,表明血必净可能通过下调MIF的合成与释放,有效地预防炎症反应的发生、发展,从而达到保护肾脏的作用。
综上,MIF作为新的“晚期”炎症因子参与脓毒症的致病过程,通过吸引巨噬细胞侵润、促进多种炎症因子分泌造成肾脏损伤,因此血清MIF可能成为脓毒症急性肾损伤重要的生物标志物和治疗靶标。同时本课题研究发现血必净注射液可通过抑制晚期炎症因子MIF的合成与释放,进而阻止肾损伤的发生与发展,为临床预防和治疗脓毒症急性肾损伤开辟了新途径。
[1]Dennen P,Douglas IS,Anderson R.Acute kidney injury in the intensive care unit:an update and primer for the intensivist[J].Crit Care Med,2010,38(1):261-275.
[2]Zarjou A,Agarwal A.Sepsis and Acute Kidney Injury[J].J Am Soc Nephrol,2011,22(6):999-1006
[3]Jing L,Bu M.Role of macrophage migration inhibitory factor in glucocorticoid release and glucocorticoid receptor function in rats[J].Ann Clin Lab Sci,2011,41(1):14-19.
[4]Chaudry IH,Wichterman KA,Baue AE.Effect of sepsis on tissue adenine nucleotide levels[J].Surgery,1979,85(2):205-211
[5]Kim WY,Huh JW,Lim CM,et al.A comparison of acute kidney injury classifications in patients with severe sepsis and septic shock[J]. Am J Med Sci,2012,344(5):350-356.
[6]Leelahavanichkul A,Huang Y,Hu X,et al.Chronic kidney disease worsens sepsis and sepsis-induced acute kidney injury by eleasing High MobilityGroup Box Protein-1[J].Kidney Int,2011,80(11): 1198-1211.
[7]Al-Abed Y,Dabideen D,Aljabari B,et al.ISO-1 binding to the tautomerase active site of MIF inhibits its pro-inflammatory activity and increases survival in severe sepsis[J].J Biol Chem,2005,280(44): 36541-36544.
[8]Dirkes S.Sepsis and inflammation:impact on acute kidney injury[J]. Nephrol Nurs J,2013,40(2):125-132.
[9]Bozza MT,Martins YC,Carneiro LA,et al.Macrophage migration inhibitory factor in protozoan infections[J].J Parasitol Res,2012, 2012:413052.
[10]Alam A,Pal C,Goyal M,et al.Synthesis and bio-evaluation of human macrophage migration inhibitory factor to develop anti-inflammatory agent[J].Bioorg Med Chem,2011,19(24):44-47.
[11]Qi F,Liang ZX,She DY,et al.A clinical study on the effects and mechanism of xuebijing injection in severe pneumonia patients[J].J Tradit Chin Med,2011,31(1):46-49.
(2014-03-09收稿 2014-06-17修回)
(本文编辑 李国琪)
Effect of Xuebijing Injection on MIF Expression and Acute Kidney Injury in Rats with Sepsis
WANG Yongming1,QIAO Youjie2△,LI Jiarui1,SHANG Yuefeng1,YOU Picong1
1 Tianjin Hospital,Tianjin 300211,China;2 Tianjin Union Medical Center△
E-mail:Youjieq@Yahoo.com
ObjectiveTo investigate the expression of macrophage migration inhibitory factor(MIF)in serum and renal tissue of septic rats with actue kidney injury(AKI),and to explore the effect of Chinese traditional medicine-Xuebijing injection on MIF expression as well as on acute kidney injury in rats with sepsis.MethodsSepsis model was reproduced in rats with cecal ligation and puncture(CLP).Eighty healthy SD rats were randomly divided into three groups:sham operation group(n=16),CLP model group(n=32),and xuebijing group(n=32).All rats were sacrificed at either 2,or 8,or 24 and or 48 hours after operations.MIF mRNA levels in renal tissues of septic rats were semi-quantified by Real-time PCR.The content of MIF in serum was determined by enzyme linked immunosorbent assay(ELISA).Serum creatinine(Cr)contents were measured by automatic biochemistry analyze.ResultsCompared with sham operation group,transcription of MIF mRNA in renal tissues of model group were significantly enhanced at 8,24 and 48 hours after operations(P<0.01).Both contents of MIF and creatinine level in serum of model group rose obviously at 24 and 48 hours after operation(P<0.01);Compared with model group,the transcription of MIF mRNA in renal tissues of xuebijing group decrease obviously at 2,8, 24 and 48 hours(P<0.01)and both contents of MIF and creatinine in serum of xuebijing group drop remarkably at 24 and 48 hours(P<0.01).ConclusionMIF is a kind of late cytokine which might participate in the pathogenesis of AKI in rats with sepsis.Xuebijing injection can inhibit MIF expression,and possess the protective effects on the kidney in rats with sepsis.
sepsis;macrophage migration inhibitory factor;acute kidney injury;xuebijing injection;creatinine
R631
A
10.3969∕j.issn.0253-9896.2014.10.008
天津市卫生局科技基金项目(2012KY22)
1天津市天津医院ICU科(邮编300211);2天津市人民医院ICU科
△通讯作者 E-mail:Youjieq@Yahoo.com



