方玉莲,马世坤,石鸥燕,张鹏,蔡春泉
循证医学
MTHFR基因C677T多态性与神经管缺陷相关性的Meta分析
方玉莲1,马世坤1,石鸥燕2,张鹏2,蔡春泉3△
目的 探讨母亲5,10-亚甲基四氢叶酸还原酶(MTHFR)基因C677T多态性与子代神经管缺陷(NTDs)发生的相关性。方法 计算机检索中国生物医学文献数据库、重庆维普中文科技期刊全文数据库、清华CNKI数据库、万方科技期刊数据库、PubMed和Web of Science,检索时间均为自建库至2014年3月。按照纳入与排除标准选择母亲MTHFR基因C677T位点多态性与子代NTDs发生相关的病例对照研究。提取相关数据并应用RevMan5.0软件进行Meta分析。结果 25篇文献纳入分析,包括病例组2 282例,对照组3 420例。结果显示,在共显性(TT基因型vs CC基因型;CT基因型vs CC基因型)及等位基因遗传模式下合并OR(95%CI)分别为2.28(1.60~3.24)、1.25 (1.02~1.53)和1.42(1.21~1.67)。亚组分析结果显示,在亚洲人群中母亲MTHFR基因C677T位点多态性与子代NTDs发生间存在显着的相关性。结论 母亲MTHFR基因C677T位点多态性是子代发生NTDs的一个危险因素,尤以亚洲人群较为明显。
神经管缺损;5,10-亚甲基四氢叶酸还原酶(FADH2);多态现象,遗传;Meta分析
神经管缺陷(neural tube defects,NTDs)是指胚胎发育早期神经管闭合不完全而导致的一组先天性发育缺陷,主要包括无脑儿、脊柱裂、脑或脑脊膜膨出等[1]。该病在不同国家、种族人群间发生率存在差异。流行病学调查显示围孕期母体补充叶酸能减少50%~70%NTDs的发生[2]。此外,孕妇高同型半胱氨酸血症和维生素B12缺乏也是NTDs发生的危险因素[3]。这些结论提示叶酸、同型半胱氨酸代谢和转运所涉及的各种酶的基因多态性可能与NTDs的发生有关。5,10-亚甲基四氢叶酸还原酶(5,10-methylene tetrahydrofolate reductase,5,10-MTHFR)是参与体内叶酸代谢的关键酶,可以催化5,10-亚甲基四氢叶酸转变成5-甲基四氢叶酸,在叶酸代谢及DNA甲基化和DNA合成修复过程中起关键作用。有关MTHFR基因C677T位点多态性与NTDs关系的研究较多[4-6],但各研究的结论并不一致。为此,本文通过Meta分析来探讨母亲MTHFR基因C677T位点多态性与子代NTDs发生的相关性。
1 资料与方法
1.1 检索策略 以神经管缺陷、亚甲基四氢叶酸还原酶、基因为检索词,检索中国生物医学文献数据库、重庆维普中文科技期刊全文数据库、清华CNKI数据库、万方科技期刊数据库中自建库至2014年3月期间发表的有关母亲MTHFR基因C677T位点多态性与子代NTDs相关的中文文献,并通过PubMed、Web of Science(检索词为“neural tube defects or NTDs”and“methylene tetrahydrofolate reductase or MTHFR”and“gene”)检索相关英文文献。
1.2 纳入标准 (1)国内外公开发表的关于母亲MTHFR基因C677T位点多态性与子代NTDs发生相关的病例对照研究。(2)文中提供各基因型的频率或直接给出OR值及95% CI。(3)只收录中文或英文文献。(4)当多篇文献数据相同或者重叠时,选取数据量最大或最新发表的文献。
1.3 资料提取 由2位研究者分别提取资料并相互核对,遇到不同意见经讨论解决。提取资料内容包括第一作者、发表时间、国家、种族、对照组来源、各基因型频率等数据。
1.4 统计学方法 根据文献[7]的方法,选择最佳遗传模型,即分别计算合并OR1(AA vs aa)、OR2(Aa vs aa)和OR3(AA vs Aa)的数值(A和a代表SNP等位基因,A为危险等位基因),若OR1=OR3≠1且OR2=1提示隐性模型;OR1=OR2≠1 且OR3=1提示显性模型;OR2=1或OR3≠1且OR1=1提示超显性模型;OR1>OR2>1且OR1>OR3>1或者OR1<OR2<1且OR1<OR3<1提示共显性模型;OR1=OR2=OR3=1提示无遗传效应。母亲MTHFR基因C677T位点多态性对子代NTDs的危险采用OR及95%CI进行描述。运用Q检验及I2值来评估研究之间有无异质性及异质性的大小。以P<0.1为研究间有异质性,采用随机效应模型,否则采用固定效应模型,研究结果用森林图表述,并按照不同的人群进行亚组分析。运用敏感性分析来评估去除对照组中不符合遗传平衡的研究后结果的稳定性。绘制漏斗图对发表偏倚进行评估。以上所有的数据统计均使用RevMan 5.0软件完成。
2 结果
2.1 纳入文献的情况 初检出相关文献192篇,根据以上的纳入标准最终纳入25篇文献进行Meta分析,其中英文文献19篇、中文文献6篇,共累计病例组2 282例,对照组3 420例,其中13篇为高加索人群(印度、西班牙、法国、加拿大、巴西、爱尔兰和英国),8篇为亚洲人群(中国),1篇为非洲人群(非洲),3篇为混血人群(哈萨克斯坦和墨西哥),见表1。
2.2 Meta分析结果
2.2.1 遗传模型的选择 遗传模型分析显示,OR1= 2.28(TT vs CC,95%CI:1.60~3.24),OR2=1.25(CT vs CC,95%CI:1.02~1.53),OR3=1.57(TT vs CT,95%CI:1.30~1.89),OR1>OR2>1且OR1>OR3>1,提示最佳遗传模型为共显性模型(TT vs CC;CT vs CC)。
2.2.2 基因型TT与NTDs的关联性 研究间存在异质性(P=0.000 2),采用随机效应模型。合并OR= 2.28,95%CI为1.60~3.24,病例组与对照组差异有统计学意义(P<0.000 01)。进一步按人群进行亚组分析,在高加索人群、亚洲人群以及混血人群中母亲TT基因型较CC基因子代患NTDs的危险显着增加,OR(95%CI)分别为1.46(1.07~2.00)、4.88(2.13~11.16)和3.62(1.86~7.04),见图1。提示在高加索人群、亚洲人群以及混血人群中母亲携带TT基因型是子代发生NTDs的危险因素。
2.2.3 基因型CT与NTDs的关联性 研究间存在异质性(P=0.002),采用随机效应模型。合并OR= 1.25,95%CI为1.02~1.53,病例组与对照组的差异有统计学意义(P=0.03)。进一步按人群进行亚组分析,亚洲和混血人群中母亲CT基因型较CC基因型子代患NTDs的危险显着增加,OR(95%CI)分别为2.42(1.56~3.73)、1.56(1.04~2.34);高加索人群和非洲人群中未发现显着相关性,OR(95%CI)分别为1.02(0.83~1.26)、1.02(0.40~2.61),见图2。提示在亚洲和混血人群中母亲携带CT基因型是子代发生NTDs的危险因素,但在高加索人群和非洲人群中并未发现这种关联。
2.2.4 等位基因T与NTDs的关联性 研究间存在异质性(P<0.000 01),采用随机效应模型。合并OR=1.42,95%CI为1.21~1.67,病例组与对照组差异有统计学意义(P<0.000 1)。进一步按人群进行亚组分析,亚洲和混血人群中母亲T等位基因较C等位基因子代患NTDs的危险显着增加,OR(95%CI)分别为2.02(1.45~2.82)、1.74(1.34~2.26);高加索人群和非洲人群中未发现显着相关性,OR(95%CI)分别为1.15(0.98~1.36)、1.02(0.42~2.47),见图3。提示在亚洲和混血人群中母亲携带等位基因T是子代发生NTDs的危险因素,但在高加索人群和非洲人群中并未发现这种关联。

Tab.1 Characteristics of studies included in the Meta-analysis表1 纳入文献特征
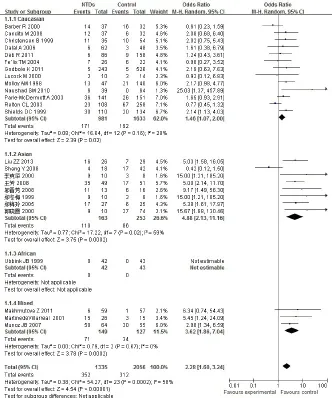
Fig.1 Forest plot for association of maternal MTHFR C677T polymorphism and NTDs from co-dominant genetic model(TT vs CC)图1 母亲MTHFR C677T基因多态性与NTDs相关性共显性模型的森林图(TT vs CC)
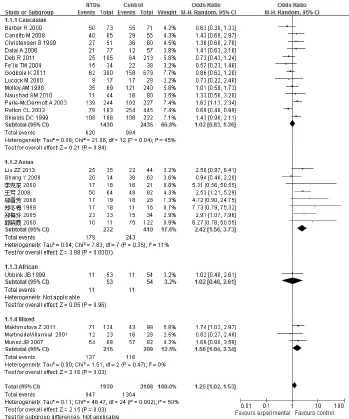
Fig.2 Forest plot for association of maternal MTHFR C677T polymorphism and NTDs from co-dominant genetic model(CT vs CC)图2 母亲MTHFR C677T基因多态性与NTDs相关性共显性模型的森林图(CT vs CC)
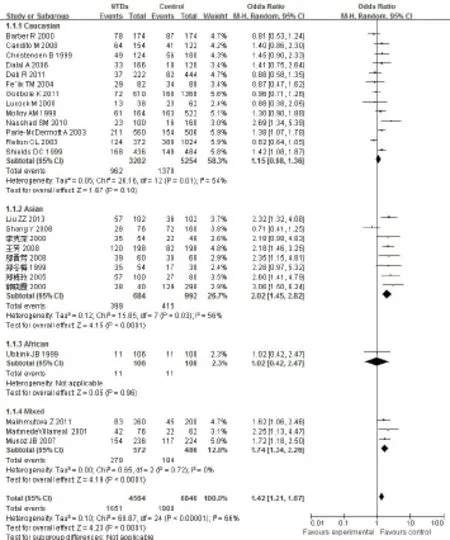
Fig.3 Forest plot for association of maternal MTHFR C677T polymorphism and NTDs from allele genetic model(T vs C)图3 母亲MTHFR C677T基因多态性与NTDs相关性等位基因模型的森林图(T vs C)
2.3 发表偏倚评价 对纳入Meta分析的25篇文献进行发表偏倚评价,倒置漏斗图基本对称,发表偏倚较小,见图4。
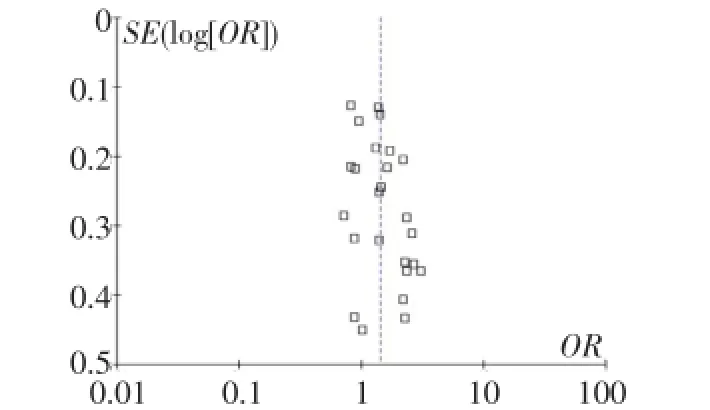
Fig.4 Funnel plot of T allele publication bias图4 T等位基因发表偏倚漏斗图
3 讨论
MTHFR基因定位于染色体1p36.3上,cDNA全长2.2 kb。目前,大多数学者认为MTHFR基因677位点发生C→T突变可导致编码MTHFR酶的丙氨酸被缬氨酸取代,从而影响酶的活性和耐热性,进而致使MTHFR酶活性降低、血浆Hcy水平升高,并发现Hcy水平的升高是NTDs发生的危险因素[4]。
本研究显示,共显性(TT vs CC;CT vs CC)及等位基因遗传模式下,合并OR(95%CI)分别为2.28 (1.60~3.24)、1.25(1.02~1.53)和1.42(1.21~1.67),表明母亲MTHFR基因C677T位点多态性是子代发生NTDs的危险因素。去除Barber等[4]和Makhmutova等[13]这2篇不符合Hardy-Weinberg遗传平衡的研究后,其合并OR(95%CI)分别为2.38(1.66~3.40)、1.26(1.02~1.56)和1.45(1.22~1.72),结果并没有发生明显的改变。
共显性模式下(TT vs CC),虽然高加索人群基因型TT频率在病例组与对照组差异有统计学意义,但只有Naushad等[17]和Shields等[21]这2篇文献结果显示母亲MTHFR基因C677T位点多态性与子代NTDs发生间存在相关性,可能由于文献的选择偏倚较大或样本量小,不能反映出真实情况,因此该结果的可靠性不强。亚洲人群中Meta分析结果显示研究间存在显着的异质性(I2=59%),剔除Shang等[20]文献后,其研究间无异质性(P=0.89,I2=0%),说明该文献是异质性的主要来源。剔除后OR(95%CI)为6.29(3.73~10.62),剔除前后的结果无显着差异,说明本次Meta分析结果在亚洲人群中较为可靠。非洲和混血人群由于文献均过少,尤其非洲人群只有1篇文献,因此需要进一步扩大样本量后明确母亲MTHFR基因C677T位点多态性与子代NTDs发生间有无相关性。由以上分析可以看出,亚洲人群母亲MTHFR基因C677T位点多态性与子代NTDs发生间存在显着的相关性,但高加索人群、非洲人群和混血人群中的这种相关性还有待进一步证实。
本研究采用了文献[7]推荐的方法,对MTHFR基因多态性遗传模型加以探讨。先确定最佳遗传模型再进行Meta分析,弥补了多次两两比较而降低检验效能的缺陷。但本Meta分析仍然存在局限性:(1)研究仅将 MTHFR基因多态性位点中 1个C677T位点进行分析,不能代表整个基因的全貌。(2)有关非洲人群的文献纳入较少,只有1篇,可能存在假阴性,对评价结果产生一定的影响。(3)在筛选文献时只纳入了中英文文献,未涉及其他语种,可能存在发表偏倚和语言偏倚。由于该病的发生是环境和遗传等因素综合作用的结果,因此为了更深入地了解NTDs的病因,有必要进行大规模、多层面的研究。
[1]Wang F,Yang YF,Li PZ.A case-control study on the risk factors of neural tube defects in Shanxi province[J].Chin J Epidemiol,2008,29(8):771-774.[王芳,杨艳芳,李佩珍.山西省神经管畸形影响因素的病例对照研究[J].中华流行病学杂志,2008,29(8): 771-774].
[2]Deb R,Arora J,Meitei SY,et al.Folate supplementation,MTHFR gene polymorphism and neural tube defects:a community based case control study in North India[J].Metab Brain Dis,2011,26(3): 241-246.doi:10.1007/s11011-011-9256-8.
[3]Godbole K,Gayathri P,Ghule S,et al.Maternal one-carbon metabolism,MTHFR and TCN2 genotypes and neural tube defects in India [J].Birth Defects Res A Clin Mol Teratol,2011,91(9):848-856.doi:10.1002/bdra.20841.
[4]Barber R,Shalat S,Hendricks K,et al.Investigation of folate pathway gene polymorphisms and the incidence of neural tube defects in a Texas Hispanic population[J].Mol Genet Metab,2000,70(1): 45-52.doi:10.1006/mgme.2000.2991.
[5]Li KS,Zheng DM,Xue YL,et al.The common C677T polymorphism in the methylenetetrahydrofolate reductase gene is associated with neural tube defects and preeclampsia[J].Chin J Med Genet,2000,17(2):76-78.[李克深,郑冬梅,薛雅丽,等.MTHFR基因C677T多态与神经管缺陷及先兆子痫关系的研究[J].中华医学遗传学杂志,2000,17(2):76-78].
[6]Liu ZZ,Zhang JT,Liu D,et al.Interaction between maternal 5,10-methylenetetrahydrofolate reductase C677T and methionine synthase A2756G gene variants to increase the risk of fetal neural tube defects in a Shanxi Han population[J].Chin Med J(Engl),2013,126 (5):865-869.doi:10.3760/cma.j.issn.0366-6999.20121688.
[7]Thakkinstian A,McElduff P,D'Este C,et al.A method for metaanalysis of molecular association studies[J].Stat Med,2005,24(9): 1291-1306.
[8]Candito M,Rivet R,Herbeth B,et al.Nutritional and genetic determinants of vitamin B and homocysteine metabolisms in neural tube defects:a multicenter case-control study[J].Am J Med Genet A, 2008,146A(9):1128-1133.doi:10.1002/ajmg.a.32199.
[9]Christensen B,Arbour L,Tran P,et al.Genetic polymorphisms in methylenetetrahydrofolate reductase and methionine synthase,folate levels in red blood cells,and risk of neural tube defects[J].Am J Med Genet,1999,84(2):151-157.doi:10.1002/(SICI)1096-8628 (19990521)84:2<151::AID-AJMG12>3.0.CO;2-T.
[10]Dalal A,Pradhan M,Tiwari D,et al.MTHFR 677C→T and 1298A→C polymorphisms:evaluation of maternal genotypic risk and association with level of neural tube defect[J].Gynecol Obstet Invest,2007,63(3):146-150.doi:10.1159/000096735.
[11]Félix TM,Leistner S,Giugliani R.Metabolic effects and the methylenetetrahydrofolate reductase(MTHFR)polymorphism associated with neural tube defects in southern Brazil[J].Birth Defects Res A Clin Mol Teratol,2004,70(7):459-463.doi:10.1002/bdra.20011.
[12]Lucock M,Daskalakis I,Briggs D,et al.Altered folate metabolism and disposition in mothers affected by a spina bifida pregnancy:influence of 677c→ t methylenetetrahydrofolate reductase and 2756a→g methionine synthase genotypes[J].Mol Genet Metab,2000,70(1):27-44.doi:10.1006/mgme.2000.2994.
[13]Makhmutova Z,Svyatova G.Neural tube defects and polymorphism of methylenetetrahydrofolate reductase gene in kazakh population[J].Medical and Health Science Journal,2011,6:7-11.
[14]Martinez de Villarreal LE,Delgado-Enciso I,Valdez-Leal R,et al.Folate levels and N(5),N(10)-methylenetetrahydrofolate reductase genotype(MTHFR)in mothers of offspring with neural tube defects: a case-control study[J].Arch Med Res,2001,32(4):277-282.doi: 10.1016/S0188-4409(01)00292-2.
[15]Molloy AM,Mills JL,Kirke PN,et al.Low blood folates in NTD pregnancies are only partly explained by thermolabile 5,10-methylenetetrahydrofolate reductase:Low folate status alone may be the critical factor[J].Am J Med Genet,1998,78(2):155-159.doi: 10.1002/(SICI)1096-8628(19980630)78:2<155::AID-AJMG11>3.0.CO;2-M.
[16]Muñoz JB,Lacasaña M,Cavazos RG,et al.Methylenetetrahydrofolate reductase gene polymorphisms and the risk of anencephaly in Mexico[J].Mol Hum Reprod,2007,13(6):419-424.doi:10.1093/ molehr/gam017.
[17]Naushad SM,Devi AR.Role of parental folate pathway single nucleotide polymorphisms in altering the susceptibility to neural tube defects in South India[J].J Perinat Med,2010,38(1):63-69.doi: 10.1515/JPM.2009.119.
[18]Parle-McDermott A,Mills JL,Kirke PN,et al.Analysis of the MTHFR 1298A→C and 677C→T polymorphisms as risk factors for neural tube defects[J].J Hum Genet,2003,48(4):190-193.doi: 10.1007/s10038-003-0008-4.
[19]Relton CL,Wilding CS,Jonas PA,et al.Genetic susceptibility to neural tube defect pregnancy varies with offspring phenotype[J].Clin Genet,2003,64(5): 424- 428.doi:10.1034/j.1399-0004.2003.00161.x.
[20]Shang Y,Zhao H,Niu B,et al.Correlation of polymorphism of MTHFRs and RFC-1 genes with neural tube defects in China[J].Birth Defects Res A Clin Mol Teratol,2008,82(1):3-7.doi:10.1002/ bdra.20416.
[21]Shields DC,Kirke PN,Mills JL,et al.The“Thermolabile”Variantof Methylenetetrahydrofolate Reductase and Neural Tube Defects: An evaluation of Genetic Risk and the Relative Importance of the Genotypes of the Embryo and the Mother[J].Am J Hum Genet,1999,64(4):1045-1055.doi:10.1086/302310.
[22]Ubbink JB,Christianson A,Bester MJ,et al.Folate status,homocysteine metabolism,and methylene tetrahydrofolate reductase genotype in rural South African blacks with a history of pregnancy complicated by neural tube defects[J].Metabolism,1999,48(2):269-274.doi:10.1016/S0026-0495(99)90046-X.
[23]Wu JF,Yang H,Zhang X,et al.Determine the methylenetetrahydrofolate reductase gene C677T polymorphism and plasma homocysteine in women with neural tube defects[J].Chinese Journal of Birth Health&Heredity,2008,16(12):15-16.[邬晋芳,杨华,张欣,等.生育过神经管缺陷儿的妇女MTHFR基因C677T多态性与血浆Hcy水平测定[J].中国优生与遗传杂志,2008,16(12):15-16].
[24]Zheng DM,Xue YL,Jin Y,et al.Association between maternal MTHFR gene polymorphism and NTD[J].Chinese Journal of Birth Health&Heredity,1999,7(6):81-82.[郑冬梅,薛雅丽,金焰,等.母亲的MTHFR基因多态性位点与NTD发生的关系[J].中国优生与遗传杂志,1999,7(6):81-82].
[25]Zheng ML,Bi XY.Study on genotypes of MTHFR C677T,MTHFR A1298C,MS A2756G in neural tube defects[J].Chinese Journal of Birth Health&Heredity,2005,13(11):26-28.[郑梅玲,毕星宇.神经管畸形与MTHFR C677T、MTHFR A1298C、MS A2756G基因多态性的相关性研究[J].中国优生与遗传杂志,2005,13(11):26-28].
[26]Guo XX,Gao YY,Zhan SY,et al.A case-control study of MTHFR polymorphism and neural tube defects[J].Chin J Dis Control Prev,2000,4(3):217-219.[郭晓霞,高原原,詹思延,等.5,10-亚甲基四氢叶酸还原酶多态性和神经管畸形的病例对照研究[J].疾病控制杂志,2000,4(3):217-219].
(2014-08-05收稿 2014-12-05修回)
(本文编辑 李鹏)
Association between maternal MTHFR C677T polymorphism and neural tube defects in offsprings:a Meta-analysis
FANG Yulian1,MA Shikun1,SHI Ouyan2,ZHANG Peng2,CAI Chunquan3△
1 College of Pharmacy;2 School of Basic Medical Sciences,Tianjin Medical University,Tianjin 300070,China;3 Department of Neurosurgery,Tianjin Children's Hospital
△Corrsponding Author E-mail:tjpns@126.com
Objective To explore the association between maternal methylene tetrahydrofolate reductase(MTHFR)C677T polymorphism and neural tube defects(NTDs).Methods CBM,VIP,CNKI,Wanfang,PubMed and Web of Science databases from set up to March,2014 were electronically searched to identify case-control studies on the relationship between maternal MTHFR C677T polymorphism and NTDs.The data were quantitatively analyzed by RevMan 5.0 software.Results A total of 25 studies were selected including 2 282 cases and 3 420 controls.Overall,the pooled OR(with 95%CI)under co-dominant model and allele contrast were 2.28(1.60-3.24),1.25(1.02-1.53)and 1.42(1.21-1.67).Subgroup analysis showed significant association between maternal MTHFR C677T polymorphism and NTDs susceptibility in Asian populations.Conclusion The present meta-analysis suggests that MTHFR C677T polymorphism is significantly associated with maternal risk for NTDs,especially in Asian populations.
neural tube defects;5,10-methylenetetrahydrofolate reductase(FADH2);polymorphism,genetic;Meta-analysis
R741.02
A DOI:10.11958/j.issn.0253-9896.2015.05.028
国家重点基础研究发展计划“973计划”(2013CB945404);天津市应用基础与前沿技术研究计划(14JCYBJC25000);天津市卫生行业重点攻关项目(12KG116);天津医科大学科技基金项目(2013kyq12)
1天津医科大学药学院(邮编300070);2天津医科大学基础医学院;3天津市儿童医院神经外科
方玉莲(1988),女,硕士在读,主要从事基因多态性与疾病关联研究
△E-mail:tjpns@126.com



