赵兴福,江山,黄晓晶△,闫福华
细胞与分子生物学
酸性条件下变异链球菌临床株表面相关蛋白表达差异分析
赵兴福1,江山2,黄晓晶2△,闫福华3
目的探讨变异链球菌临床株在pH7.0和pH5.0条件下的表面相关蛋白表达差异,进一步了解龋病发生和发展过程。方法采用Homer法提取593和18号(593号菌株分离于高发龋患者,18号菌株分离自无龋健康人)临床分离株在pH7.0和pH5.0条件下的表面相关蛋白,经十二烷基硫酸钠聚丙烯酰胺凝胶电泳和二维电泳确定蛋白表达的差异条带及位点,差异位点由基质辅助激光解析电离飞行时间质谱分析,并结合数据库进行检索和鉴定蛋白质。结果经过对电泳图谱的分析发现,两菌株在pH7.0条件下存在4个高表达位点和2个特异位点;在pH5.0条件下存在2个高表达位点和2个特异位点。593号菌株蛋白表达又发生了特殊的变化,即在pH5.0条件下,存在3个高表达位点和6个特异位点,其中双组分信号传导系统组氨酸激酶Lyts和3-磷酸甘油醛脱氢酶高表达,NADH氧化酶特异表达。结论两菌株在酸性变化下均出现了某些蛋白的高表达和特异表达,可能两菌株耐酸反应中存在相似之处;两菌株间蛋白表达差异可能是耐酸性存在差异的原因。
链球菌,变异;蛋白质组学;临床分离株;表面相关蛋白;耐酸性
龋病是危害人类口腔健康的主要疾病之一,血清C型变异链球菌(Streptococcus rnutans,简称S. mutans,变链菌)是主要的致龋菌之一,该菌株临床分离株间致龋能力存在明显差异[1-2]。本课题组在前期研究中成功分离高龋患者和无龋健康人血清C型变链菌临床分离株,并证明菌株间与致龋能力密切相关的耐酸能力、胞外多糖合成能力、黏附能力以及产酸能力均存在明显差异[3]。其中,耐酸能力差异是菌株间致龋能力存在差异的重要原因之一[4]。因此,本研究挑选了来自高龋患者和无龋健康人血清C型变链菌临床分离株593号和18号菌株,分析了两菌株分别在pH7.0和pH5.0条件下的表面相关蛋白表达差异,探讨菌株间耐酸能力存在差异的原因。
1 材料与方法
1.1材料与设备
1.1.1主要试剂两性洗涤剂Zwittergent 3-12(Sigma,USA),胰蛋白胨-多价蛋白-酵母提取物培养基(tryptonepdypeptone-yeast extract,TPY),银染试剂盒、低分子质量标准蛋白、pH固相梯度胶条、pH固相梯度干胶条覆盖液和pH3~10NL IPG缓冲液(Amsheram Pharmacia,USA),PMSF(深圳赛泰克生物科技股份有限公司,中国),二硫素糖醇、碘乙酰胺(Promega,USA),蛋白Marker(厦门泰京生物科技股份有限公司,中国),BCA蛋白浓度测定试剂盒(江苏碧云天生物技术研究所,中国),透析袋Mr cut-off of 3.5 ku Snakeskin(Pierce,USA),0.22 μm过滤膜(Acrodisc,Germany)。
1.1.2主要设备YQX-Ⅱ型厌氧培养箱(上海新苗医疗器制造有限公司,中国),320-S型pH计(Mettlertoledo,Switzer⁃land),ND-1000 spectrophoto meter(DanoDrop,Wilmington),酶联免疫测定仪(Human,Germany);等电聚焦仪、垂直板电泳仪、凝胶成像仪和图像分析软件(Amsheram Pharmacia,USA),DYY-6C电泳仪(北京市六一仪器厂,中国),GE50 ul⁃trasonic processor(Deer field,USA)。
1.2方法
1.2.1菌株本课题组在前期研究中已经在四川大学华西口腔医学院龋病研究室分离变链菌临床分离株593号菌株和18号菌株(593号菌株分离于高发龋患者,18号菌株分离自无龋健康人),并鉴定以及保存。
1.2.2测定生长曲线在TPY固体培养基上将-70℃保存的冻干粉菌株在37℃厌氧(80%N2、10%H2、10%CO2)条件下复苏,24 h后传二代,将平板菌落分别收集于相应pH7.0和pH5.0的TPY培养液中,调节菌浓度A630下光密度(OD)值均为1.0,分别以体积分数5%加入相应pH7.0和pH5.0的TPY液体培养液中,混匀后分装于100支小试管中,在37℃厌氧条件下培养,每小时两种pH值各取出2支小试管,各测OD值3次,取平均值,列图表,绘生长曲线,确定生长对数期。
1.2.3Homer法提取表面相关蛋白菌株复苏培养同上,调节菌浓度A630下OD值均为1.0,分别以体积分数5%加入相应pH7.0和pH5.0 TPY液体培养液中,混匀后在37℃厌氧条件下培养,对数生长期时停止。取菌液4 000 r/min离心5 min,去上清,加PBS液,轻轻吹打混匀,4 000 r/min离心5 min,再去上清,加PBS液,轻轻吹打混匀后收集,调整菌浓度A630下OD值均为0.9,取菌液4 000 r/min离心5 min,去上清,加1∶5 PBS液,含0.2%(w/v)Zwittergent 3-12,轻轻吹打混匀,于Ep管中分装,在25℃50 r/min条件下孵育1 h,13 000 r/ min离心10 min,收集上清液,加入4倍体积pH 7.5的50 mmol/LTris-HCl,混匀后0.22 μm滤器过滤,分装于Mr cut-off of 3.5 ku Snakeskin中,在4℃磁力慢速搅拌条件下于新鲜配制pH7.5的50 mmol/L Tris-HCl中透析过夜。4倍体积-70℃预冷的丙酮加入透析液中,-20℃条件下过夜,4℃12 000 r/min离心20 min,干燥,重悬于pH7.5的50 mmol/L Tris-HCl,4倍体积-70℃预冷的丙酮加入重悬液,-20℃条件下过夜,4℃12 000 r/min离心20 min,干燥,保存于-70℃。
1.2.4BCA法蛋白样品定量及SDS-PAGE电泳分析将蛋白样品溶解,用CurveExpert 1.3软件计算蛋白浓度,并调节蛋白样本浓度使其一致,取蛋白样品适量,混匀于1/4体积5×Loading buffer,100℃沸水浴10 min,12 000 r/min离心10 min。配置7 cm×7 cm 12%分离胶和5%积层胶,上等量蛋白样品,在冰浴30 mA条件下采取垂直不连续板状法进行SDS-PAGE电泳约4 h。考马斯亮蓝溶液中染色,10%乙酸-5%乙醇脱色液中脱色,观察电泳结果并照相。
1.2.5Bradford法蛋白样品定量及二维电泳分析将蛋白样品溶解,用Chart Wizard软件计算样品蛋白含量。根据样品具体情况、pH梯度范围和strip长度确定样品量和样品体积,根据pH范围和strip的长度确定电泳的电压和时间,并在电泳中要保证达到要求,结束电泳后取出strip进行平衡,后进行SDS-PAGE电泳,电泳结束取出凝胶,银染,染色后置于1%冰醋酸中,在4℃条件下保存。将染色好的胶图照相并对胶图蛋白表达量差异点用软件Image Master 2D Platinum 5.0进行分析。
1.2.6差异蛋白位点基质辅助激光解吸电离飞行时间质谱(MALDI-TOF)分析选特殊差异蛋白位点,切取并用胰蛋白酶消化,MALDI-TOF法得到各蛋白位点的肽质量指纹谱(peptide mass finger printing,PMF),在NCB Inr数据库中用Mascot(http://www.matrixscience.cn)软件检索相匹配的蛋白。
2 结果
2.1在pH5.0条件下两菌株TPY液体培养基中的生长曲线两菌株在pH5.0 TPY液体培养基中初期接种均无停滞期,而后生长速度缓慢,两菌株均在20 h左右到达生长对数期,但593号菌株稍快于18号菌株。而后593号菌株到22 h左右出现菌间黏附沉积,18号菌株到26 h左右时才出现,见图1。
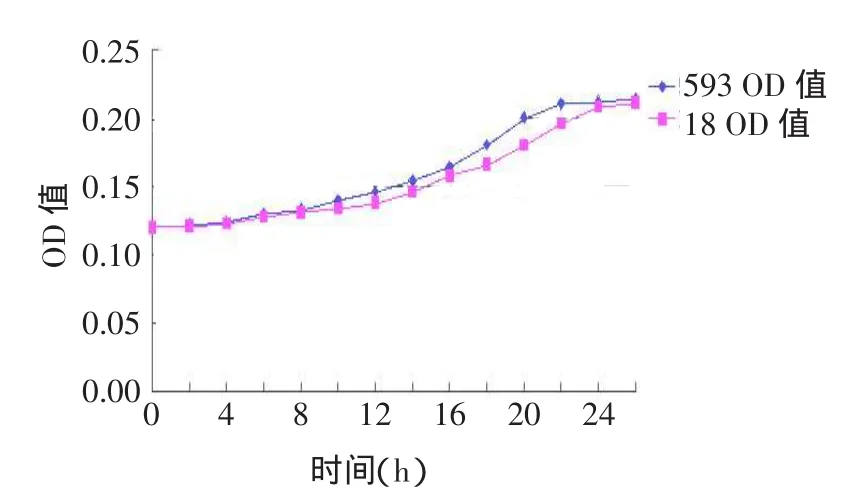
图1 在pH5.0条件下593号和18号菌株TPY液体培养基中的生长曲线Fig.1The growth curve of Sm 593 and Sm18 at pH5.0 in TPY fluid medium
2.2 在pH7.0条件下两菌株TPY液体培养基中的生长曲线两菌株在pH7.0 TPY液体培养基中初期接种均无停滞期,而后生长迅速,两菌株均在4 h左右到达生长对数期,但593号菌株稍快于18号菌株,同时比18号菌株早0.5 h左右出现黏附沉积。
2.3两菌株表面相关蛋白SDS-PAGE电泳结果SDS-PAGE电泳图发现两菌株在pH7.0条件下均在22、24、25 ku左右出现特异蛋白条带,在pH5.0条件下均在100 ku左右出现特异蛋白条带。两菌株在pH7.0到pH5.0条件变化中蛋白表达量均在26、34、40和55 ku左右出现下降,均在95和115 ku左右出现增加。但593号菌株蛋白表达又发生了特异变化。该菌株在pH7.0条件下110 ku左右出现特异蛋白条带,在pH5.0条件下68 ku左右出现特异蛋白条带,在pH7.0到pH5.0条件变化中蛋白表达量在58 ku左右比18号菌株低,在95 ku左右比18号菌株高,见图2。
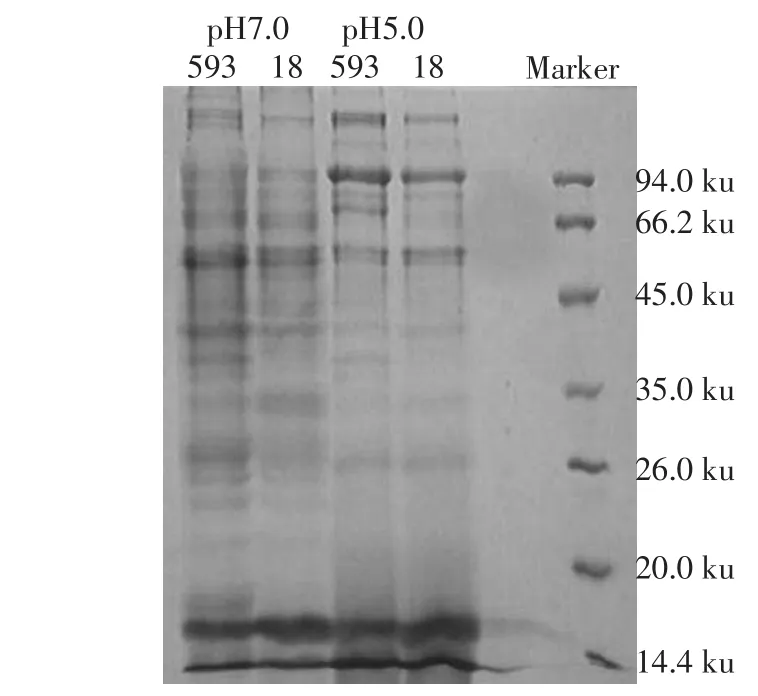
Fig.2The electrophoresis of clinical-isolated stains of surfaceassociated protein Sm593 and Sm18 at pH7.0 and pH5.0 by SDS-PAGE图2 在pH7.0和pH5.0条件下593和18号菌株表面相关蛋白的SDS-PAGE电泳图
2.4两菌株表面相关蛋白二维电泳结果两菌株在pH7.0条件下均出现4个高表达位点和2个特异位点。在22、24、25 ku左右出现1545、1552等高表达位点和1201等特异位点,在26、34、40、55 ku左右出现1526、1399等高表达位点和996等特异位点。两菌株在pH5.0条件下均出现2个高表达位点和2个特异位点,在40 ku左右出现1356等高表达位点,在45 ku左右出现1228等特异位点。593号菌株蛋白表达变化特殊,即在pH5.0条件下该菌株出现特有的5个高表达位点和6个特异位点,95 ku左右出现843、833、832等特异位点,31、54和68 ku左右分别出现964、1220和1441等特异位点,36、38和39 ku左右分别出现1339、1440和1278等高表达位点,以及49和58 ku左右分别出现1144和1045高表达位点,见图3、4。
2.5593号菌株在pH 5.0条件下部分特有蛋白位点质谱分析结果对1144、1287高表达位点和833特异位点进行MALDI-TOF质谱分析后得到肽质量指纹谱(peptide mass finger-printing,PMF),根据所得到的PMF在NCB Inr数据库中用Mascot软件检索到相匹配的蛋白,见表1。

Tab.1The identification result of the surface-associated protein of 593 stain at pH5.0表1 593号菌株在pH5.0条件下部分表面相关蛋白鉴定结果
3 讨论
血清C型变链菌是世界公认的主要致龋菌之一。pH值作为细菌生长和代谢活动的重要影响因素,其降低会对该菌有明显影响。即生长环境酸化会降低该菌细胞内的pH值,胞浆酸化会影响细胞内蛋白质和DNA分子活性,糖酵解途径的酶对酸也敏感,但该菌可通过调节细胞内的酸适应反应而继续生长代谢[4]。可见耐酸能力作为该菌致龋毒力因子中关键因素之一,对龋病的发生和发展起很重要的作用[5]。对耐酸能力的研究发现,培养基的pH值随细菌的生长代谢是不恒定的,都在降低。尽管如此,有研究表明初始pH值决定了变链菌对葡萄糖利用率以及酸性终产物的形成。牙齿硬组织在临界值pH5.2以下才开始脱矿分解。可见,比较该菌株在pH7.0和pH5.0两种情况下的代谢状况对研究耐酸能力有重要意义。
与耐酸能力密切相关的蛋白大多数存在于革兰阳性菌的膜表面[6],于是国内外学者对表面相关蛋白的提取方法进行了探索。Homer法是比较成熟的方法,该法提取的膜表面相关蛋白相对完整,且该法选取的是生长对数期的变链菌,由于该期代谢能力强,死菌含量低,因此纯度不会受细菌裂解的影响[6]。
国内外学者研究发现该菌菌株间致龋能力存在差异,耐酸能力同样也存在差异[4,6]。因此本研究选取了本课题组前期从高龋患者口内分离的593号菌株和从无龋健康人口内分离的18号菌株,并提取和分析了两菌株在pH7.0和pH5.0两种情况下的表面相关蛋白。结果表明,从pH7.0到pH5.0条件变化中,两菌株均存在相同特异条带,且在某些相同蛋白条带区域蛋白表达量均发生了相似的变化,同时发现在这些区域均出现了高表达位点和特异位点,提示两菌株在耐酸反应中存在相似的过程。但593号菌株又出现了特殊的蛋白表达,即该菌株在pH7.0条件和pH5.0条件下均存在特有的特异条带,且在某些特殊条带蛋白表达发生了特有的量变化,同时在相应区域出现了特有的高表达位点和特异位点。其中,在pH5.0条件下,3-磷酸甘油醛脱氢酶表达量增加了40多倍,该酶为变链菌进行糖酵解反应的关键酶,且在乙酸合成中具有重要作用[7],可见在酸性条件下593号菌株的糖代谢能力和产酸能力远强于18号菌株。同时值得关注的是双组分信号传导系统组氨酸激酶Lyts在酸性条件下表达量增加了3倍多。有研究发现双组分信号传导系统通常由二聚体化跨膜感受器,即感受信号输入的组氨酸蛋白激酶(histidine kinase,HK)和调节信号输出的反应调控因子(response regulator,RR)组成。HK定位于质膜,能感应特异性的环境刺激;RR定位于细胞质,可通过调节基因表达对环境刺激作出反应。该系统涉及许多原核生物以及细菌的多种代谢过程、细菌细胞的周期、细菌间的信号交流和细菌毒力因子的表达[8-10],且研究发现它们在变链菌的酸耐受能力、生物膜形成能力、感受态发育能力、应激耐受能力等致病机制中起着重要的作用[11-12]。Kawada-Matsuo等[13]通过构建双组分信号传导系统组氨酸激酶缺陷株并在酸性培养基中培养,进而发现其与变链菌的酸耐受性密切相关。因此,笔者推测593号菌株在酸性条件下的信号传导能力可能强于18号菌株,其原因可能与双组分信号传导系统组氨酸激酶Lyts的高表达相关。另外,NADH氧化酶在酸性条件下特异表达,有研究表明该酶的催化反应作用可能是变链菌产生活性氧的主要来源[14-15],因此该蛋白的特异表达可能导致该菌株氧利用能力强于18号菌株。
由此可见,593号菌株这些高表达和特异表达的蛋白与该菌强耐酸性、强致龋性密切相关。本研究中仅分析了几个特殊蛋白,对于其他更多蛋白情况还有待深入,这样有利于全面系统了解该菌株致龋机制,对龋病发生、发展和预防治疗提供依据。
(图3、4见插页)
[1]Wang CL,Liu JJ,Su DH,et al.Preliminary screen of high carioge⁃nicity Streptococcus mutans strains isolated from clinical specimens[J].West China Journal of Stomatology,2013,319(2):136-140.[王成龙,刘佼佼,苏东华,等.高致龋性变异链球菌临床分离株的初步筛选[J].华西口腔医学杂志,2013,319(2):136-140].doi: 10.7518/hxkq.2013.02.006.
[2]Arezoo T,Abdolreza N,Hannaneh S,et al.Typing of Streptococcus mutans strains isolated from caries free and susceptible subjects by multilocus enzyme electrophoresis[J].Microbiology,2013,44(3): 873-877.doi:10.1590/S1517-83822013000300033.
[3]Zhao XF,Huang XJ,Cai ZY,et al.Proteins differences between streptococcus mutans stains isolated from caries-active and cariesfree individuals by SDS-PAGE[J].Journal of Oral Science Re⁃search,2008,24(2):127-130.[赵兴福,黄晓晶,蔡志宇,等.高龋患者与无龋健康人口内变形链球菌蛋白表达差异的初步分析[J].口腔医学研究,2008,24(2):127-130].
[4]Cao YS,Liu XR.Study on the ability of aciduricity of Streptococcus mutans isolated from children with different caries susceptibility[J]. Chinese Journal of Conservative Dentistry,2011,21(12):691-693.[曹元书,刘兴容.不同龋敏感儿童变异链球菌临床分离株耐酸能力的实验研究[J].牙体牙髓牙周病学杂志,2011,21(12):691-693].
[5]Wang CL,Su DH,Liu JJ,et al.Isolation and identification of Strep⁃tococcus mutans strains with different genotype from clinical sam⁃ples[J].West China Journal of Stomatology,2013(1):80-85.[王成龙,苏东华,刘佼佼,等.不同基因型变异链球菌临床分离株的分离和鉴定[J].华西口腔医学杂志,2013(1):80-85].doi:10.7518/ hxkq.2013.01.020.
[6]Homer KA,Wilkins JC,Beighton D.Effect of acidic pH on the ex⁃pression of surface-associated proteins of Streptococcus oralis[J]. Applied and Enviromental Microbiol,2003,69(9):5290-5296.doi: 10.1128/AEM.69.9.5290-5296.2003.
[7]Centeno-Leija S,Utrilla J,Flores N,et al.Metabolic and transcrip⁃tional response of Escherichia coli with a NADP(+)-dependent glyc⁃eraldehyde 3-phosphate dehydrogenase from Streptococcus mutans[J].Antonie Van Leeuwenhoek,2013,104(6):913-924.doi: 10.1007/s10482-013-0010-6.
[8]Liu Y,Bume RA.Multiple two-component systems modulate auka⁃li generation in Streptococcus gordonii in response to environmental stress[J].Bacteriol,2009,191(23):7353-7362.doi:10.1128/ JB.01053-09.
[9]Gong Y,Tian XL,Sutherland T,et al.Global tnmscriptional analy⁃sis of acid-inducible genes in Streptococcus mutans:Multiple twocomponent systems involved in acid adaptation[J].Microbiology,2009,155(10):3322-3332.doi:10.1099/mic.0.031591-0.
[10]Liu Y,Bume RA.Multiple two-component systems of Streptococ⁃cus mutans regulale agnmtine deimirmse gene expression and stress tolerance[J].Bacteriol,2009,191(23):7363-7366.doi:10.1128/ JB.01054-09.
[11]Tremblay YDN,Lo H,Li YH,et al.Expression of the Streptococ⁃cus mutans essential two-component regulatory system VicRKis pH and growth-phase dependent and controlled by the LiaFSR threecomponent regulatory system[J].Microbiol,2009,155(9):2856-2865.doi:10.1099/mic.0.028456-0.
[12]Stipp RN,Boisvert H,Smith DJ,et al.CovR and VicRK regulate cell surface biogenesis genes required for biofilm formation in Strep⁃tococcus mutans[J].PLoS One,2013,8(3):e58271.doi:10.1371/ journal.pone.0058271.
[13]Kawada-Matsuo M,Shibata Y,Yamashita Y.Role of two compo⁃nent signaling response regulators in acid tolerance of Streptococ⁃cus mutans[J].Oral Microbiol Immunol,2009,24(2):173-176.doi: 10.1111/j.1399-302X.2008.00485.x.
[14]Perry JA,Jones MB,Peterson SN,et al.Peptide alarmone signatiing triggers an auto-active bacterincin neeessary for genetic compe⁃tence[J].Mol Mierebiol,2009,72(4):905-917.dio:10.1111/ j.1365-2958.2009.06693.x.
[15]Baker JL,Derr AM,Karuppaiah K,et al.Streptococcus mutans NADH oxidase lies at the intersection of overlapping regulons con⁃trolled by oxygen and NAD+levels[J].J Bacteriol,2014,196(12): 2166-2177.doi:10.1128/JB.01542-14.
(2014-12-16收稿 2015-03-08修回)
(本文编辑 魏杰)
Differential expressions of surface-associated proteins of streptococcus mutans strains isolated from clinical samples under acid condition
ZAHO Xingfu1,JIANG Shan2,HUANG Xiaojing2△,YAN Fuhua3
1 Department of Endodontology,Tianjin Stomatological Hospital of Nankai University,Tianjin 300041,China;2 Department of Endodontics and Operative Dentistry,School and Hospital of Stomatology,Fujian Medical University;3 Institute and Hospital of Stomatology,Nanjing University Medical School△
ObjectiveTo investigate the changes in the surface-associated protein expression of streptococcus rnutans(Sm)isolated from clinical samples at pH7.0 and pH5.0.MethodsThe proteins were extracted from cells at pH7.0 and pH5.0 by Homer method.The proteins were separated by sodium dodecyl sulfate polyacrylamide gel electrophoresis(SDSPAGE)and two-dimensional gel electrophoresis followed by image analysis.Proteins were identified by matrix-assisted la⁃ser desorption ionization time of flight mass spectrometry and computer-assisted protein sequence analysis.ResultsImage analysis revealed that four high expression levels of protein loci and two specific protein loci were existed in two strains at pH7.0.Two high expression levels of protein loci and two specific protein loci were existed in two strains at pH5.0.Three high expression levels of protein loci and six specific protein loci were existed in Sm593 at pH5.0.Two-component system histidine kinases Lyts and glyceraldehyde-3-phosphate dehydrogenase were highly modulated,and NADH oxidase were modulated specifically.ConclusionThe two clinical isolations in acid have high expression of some special proteins,which are presumed to be the resemblance of acid reaction.The difference of protein expression of two clinical isolations in acid may represent their distinct acid resistance.
streptococcus mutans;proteomics;the clinical isolationns;the surface-associated proteins;acid resistance
R781.1
A
10.11958/j.issn.0253-9896.2015.07.001
国家自然科学基金资助项目(30500564)
1天津市口腔医院牙体牙髓二科(邮编300041);2福建医科大学附属口腔医院牙体牙髓科;3南京大学医学院附属口腔医院
赵兴福(1981),男,硕士,主治医师,主要从事龋病病因学研究
△通讯作者E-mail:hxiaoj@163.com



