张玉琪,邢丽,汪涛
卵巢癌对顺铂类药物耐药性的相关分析
张玉琪,邢丽,汪涛
目的筛选影响卵巢癌顺铂耐药性的靶点基因。方法从GEO数据库中下载对顺铂敏感和产生抗药性的人类卵巢癌细胞基因表达谱和甲基化谱数据(GSE15709),利用R的相关工具包筛选A2780和A2780/DDP(顺铂耐药卵巢癌细胞系)两类卵巢癌细胞之间的差异表达和差异甲基化的基因;使用DAVID数据库对差异表达基因进行功能富集分析;对同时发生了差异甲基化、差异表达且甲基化水平、表达水平的变化趋势相反的基因,进一步利用qRT-PCR技术检测这些基因在两种卵巢癌细胞中的表达值。结果研究发现在两种卵巢癌细胞之间发生了416个差异表达和281个差异甲基化的基因,这些差异表达基因主要富集于细胞周期、核分裂和蛋白修饰负调控等生物过程。此外,细胞周期、DNA复制和p53等通路在这些基因中同样富集。共发现4个发生了差异甲基化、差异表达且甲基化变化水平、表达水平变化趋势相反的基因,qRT-PCR实验验证了这些基因在两种卵巢癌细胞中的表达水平。结论利用生物信息学和分子生物学相结合的方法,可以筛选出部分影响卵巢癌对顺铂抗药性的基因,为进一步揭示其中的分子机制提供实验参考。
顺铂;卵巢肿瘤;计算生物学;逆转录聚合酶链反应;qRT-PCR;A2780;A2780/DDP
卵巢癌是发病率和死亡率较高的恶性肿瘤之一,其发病率在妇科癌症中高居第3位,死亡率居于首位[1]。化疗是卵巢癌重要的治疗手段,以顺铂为代表的铂类是化疗中最常使用的药物。但其耐药性始终是困扰临床的一个重要问题,严重影响着患者的生活质量及生存率。表观遗传学的重要分支DNA甲基化对基因的表达调控起着非常重要的作用[2-3]。研究表明,DNA甲基化与卵巢癌发生发展密切相关[4-6],但关于DNA甲基化和卵巢癌耐药性的关系鲜有报道。本研究从DNA甲基化入手探究卵巢癌患者对顺铂产生耐药性的分子机制,筛选耐药性的分子靶标有助于进一步制定、调整卵巢癌治疗策略。
1 材料与方法
1.1 材料人卵巢癌细胞A2780和A2780/DDP(顺铂耐药卵巢癌细胞系)购自同济医院肿瘤中心。DMEM培养基、胎牛血清(FBS)、抗生素、Trizol均购自Invitrogen公司;M-MLV逆转录酶、SYBR green染料购自Roche公司;顺铂(批号: 091102)购自江苏豪森药业股份有限公司。
1.2 方法
1.2.1 芯片数据所用mRNA表达谱和DNA甲基化数据来自GEO数据库中编号为GSE15709的芯片数据,由Li等[7]提供。细胞类型是A2780卵巢癌细胞,在mRNA表达谱数据中,对照组是对顺铂敏感的A2780细胞样本,实验组是用顺铂处理过5轮的A2780细胞样本,各有5个生物学重复,基于GPL570[HG-U133_Plus_2]Affymetrix Human Genome U133 Plus 2.0 Array平台进行检测;在DNA甲基化数据中,对照组为对顺铂敏感的A2780细胞样本,有3个生物学重复,实验组为用顺铂处理过1轮、3轮和5轮的A2780细胞样本,各有1个,基于GPL8341平台进行检测。
1.2.2 芯片数据预处理对于mRNA表达谱数据,首先得到原始的CEL格式的数据,利用R统计软件的affy[8]包进行背景校准和标准化,并利用芯片平台的注释包把探针符号转化为基因符号;对于多个探针对应一个基因符号的情况,取探针上表达值的平均值作为该基因的表达值。DNA甲基化芯片的预处理主要包括利用背景差分去除背景噪音,利用LOESS标准化方法去除技术误差,对于多个探针对应同一个基因的情况,取这些探针甲基化水平的平均值作为这个基因的甲基化水平。
1.2.3 差异表达和差异甲基化基因的筛选差异表达基因的筛选主要是通过芯片数据线性模型(R的limma)[9]包,对每个基因在实验组和对照组的表达值进行t检验和错误发现率(FDR)校正。选择FDR<0.05并且|log2(fold change)|>1的基因作为对顺铂有耐药性(用顺铂处理了5轮)的卵巢癌细胞相对于对顺铂敏感的卵巢癌细胞的差异表达基因(DEG)。为了与表达谱数据相对应,本研究利用的DNA甲基化数据为用顺铂处理过5轮的卵巢癌细胞与对顺铂敏感的卵巢癌细胞进行对比;当满足|log2(cy5/cy3)|>1(cy5为对顺铂有耐药性的卵巢癌细胞的甲基化水平,cy3为对顺铂敏感的卵巢癌细胞的甲基化水平)时,认为是发生了差异甲基化的基因,则记为差异甲基化基因(DEMethy)。
1.2.4 DEG的功能富集分析利用DAVID[10](http://david. abcc.ncifcrf.gov/)在线工具,对DEG中的基因进行富集分析,选取的背景基因是人类全基因组的基因,物种是人类。最后分别以P<0.05,并且至少富集了10个基因和P<0.05并且至少富集了5个基因为阈值来选取富集的基因本体条目(GO terms)和KEGG通路(KEGG pathways)。
1.2.5 差异表达与差异甲基化基因的综合分析将DEG和DEMethy中的基因进行对比,得到重合的基因。由于DNA的甲基化会抑制基因的表达,研究从重合的基因中选取甲基化和表达值的变化水平呈相反趋势的基因。
1.2.6 细胞培养人卵巢癌细胞A2780和A2780/DDP接种于含10%FBS和1%双抗(青-链霉素)的DMEM培养基中,置于37℃、5%CO2培养箱中常规传代培养,每2~3 d换液1次。
1.2.7 qRT-PCR验证为了进一步验证基因芯片的结果,利用qRT-PCR检测上述实验所得DEG。Trizol法提取细胞总RNA并测定浓度,取2 μg总RNA逆转录为cDNA后进行qRT-PCR反应,以GAPDH作为内参,所需引物见表1。扩增条件:94℃12 min,94℃30 s,58℃30 s,72℃30 s,40个循环;72℃5 min。qRT-PCR结果采用2-ΔΔCT法分析。

Tab.1Primers of G6PD,ISL1,NEFL,PSMA1 and GAPDH for qRT-PCR表1 G6PD、ISL1、NEFL、PSMA1、GAPDH的qRT-PCR引物
1.3 统计学方法采用SPSS 11.5软件进行统计学分析,实验数据均以表示,两组间比较采用独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 差异表达和差异甲基化基因以FDR<0.05和|log2(fold change)|>1为阈值,得到实验组相对于对照组的DEG 416个,包括239个表达下调的基因和177个表达上调的基因。在这些DEG中,KCNJ2是差异最显着同时变化倍数也较大的基因,TSPAN8是实验组相对于对照组表达水平升高得最明显的基因。本研究利用这些DEG,对样本进行了有监督的聚类,见图1。实验组和对照组都分别聚在一起,说明这些DEG在实验组和对照组中的表达值差异是明显的;以|log2(fold change)|>1为阈值,得到了用顺铂处理5轮的卵巢癌细胞相对于对顺铂敏感的卵巢癌细胞的差异甲基化基因有281个,包含198个发生了低甲基化的基因和83个发生了高甲基化的基因。
2.2 DEG的功能富集分析结果通过分析发现细胞周期、蛋白质修饰过程的负调控、DNA复制和细胞增殖的调控DEG的主要富集功能。除此之外,还得到了7条在DEG中富集的KEGG通路,见表2。
2.3 DEG和差异甲基化基因的综合分析通过对
比DEG和差异甲基化基因,得到了4个重合的基因:6-磷酸葡萄糖脱氢酶(G6PD)、胰岛素基因增强蛋白-1(ISL1)、神经微丝蛋白(NEFL)和蛋白酶体α型亚基(PSMA1)。并且,这4个基因的表达值变化水平和甲基化变化水平呈相反的趋势,这也符合DNA甲基化对基因表达的影响。
2.4 qRT-PCR验证基因芯片结果G6PD和NEFL在对顺铂敏感的卵巢癌细胞A2780中表达明显高于卵巢癌耐药细胞A2780/DDP,而ISL1和PSMA1在对顺铂敏感的卵巢癌细胞A2780中表达显着低于卵巢癌耐药细胞A2780/DDP,见表3。
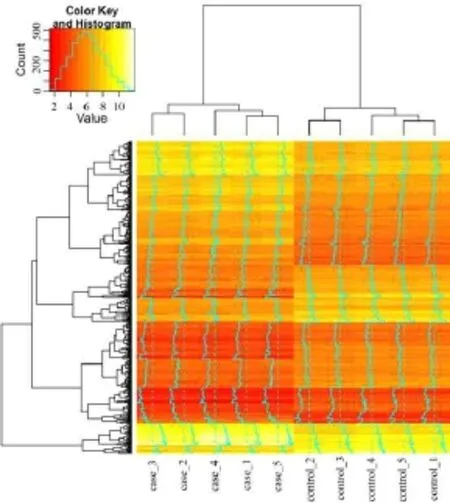
Fig.1The heat map of expression levels of differential expressed genes in each sample图1 差异表达基因在各个样本中表达值热图
Tab.3Comparison of genes expressions between ovarian cancer cells that were sensitive or resistant to Cisplatin表3 qRT-PCR检测各基因在顺铂敏感和耐药的卵巢癌细胞中的表达情况

Tab.3Comparison of genes expressions between ovarian cancer cells that were sensitive or resistant to Cisplatin表3 qRT-PCR检测各基因在顺铂敏感和耐药的卵巢癌细胞中的表达情况
*P<0.05
细胞A2780 A2780/DDP t n33 G6PD 1.02±0.05 0.32±0.01 26.87*ISL1 0.98±0.03 2.41±0.33 10.97*NEFL 0.99±0.16 0.76±0.05 4.67*PSMA1 1.04±0.18 1.68±0.11 5.86*
3 讨论
顺铂是一种广泛应用于肿瘤化疗中的药物,以顺铂为基础的联合化疗方案已在卵巢癌等多种疾病中表现出极为重要的抗肿瘤活性。尽管如此,受细胞获得性及固有的耐药性影响,患者从中获益率还非常有限。目前,顺铂耐药的分子机制还不明确。DNA是顺铂的主要靶点,顺铂结合会导致DNA损伤并诱发细胞凋亡。任何影响顺铂与DNA的结合以及干扰细胞凋亡的因素都可能导致耐药性的产生。
本研究得到了实验组相对于对照组的DEG和差异甲基化基因,这些基因主要富集于细胞周期、DNA复制和p53等信号通路,而得到的4个重合基因——G6PD、ISL1、NEFL和PSMA1,其甲基化水平的变化和表达水平的变化趋势是相反的。进一步通过qRT-PCR实验在RNA水平验证这些基因在对顺铂产生了耐药性的卵巢癌细胞中表达明显增高。G6PD可以编码葡萄糖-6-磷酸脱氢酶,至今已经发现了该基因两种不同的转录本亚型;ISL1能够编码同结构域的转录调控因子,对胰岛素基因的表达起重要的调控作用;NEFL能够编码神经丝蛋白,是一种有抑癌作用的异质多糖;PSMA1可以编码泛蛋白酶体,并且由可变剪接能够转录出多种转录本[11-12]。
NEFL神经丝轻链基因,隶属于驱动蛋白超家族基因,被认为是一种抑癌基因。有研究报道NEFL基因微卫星的杂合性缺失与多种肿瘤的发生和进展相关。G6PD是戊糖磷酸途径所需限速酶。戊糖磷酸途径5磷酸核糖及还原型辅酶Ⅱ都是肿瘤细胞增殖分裂的重要原料。前者是DNA、RNA合成的基础物质,后者维持着谷胱甘肽的还原状态。研究证实此两者均与顺铂耐药相关,与既往报道一致[13]。
ISL1属于LIM同源框基因,其编码的蛋白具有
促进细胞增殖分化、血管形成等多种生物活性。其不仅与正常的生长相关,而且是肿瘤的自分泌和旁分泌的生长因子,与肿瘤关系密切:负调控凋亡,促进细胞增殖、血管增生、细胞浸润。PSMA1是蛋白酶体的一个亚结构,编码高度有序,具有环形结构20 S核心α亚基[14]。蛋白酶体是真核细胞依赖泛素化对蛋白降解的重要结构。对细胞内许多功能蛋白的降解起着重要的作用,广泛影响着多条信号通路,与多种肿瘤的发生发展密切相关。据报道,靶向药硼替佐米就是通过抑制PSMA1而发挥抗肿瘤活性作用的[15]。但目前对PSMA1研究仍较少,特别是与顺铂耐药性的关系少见报道。本研究筛选结果发现ISL1和PSMA1可能与卵巢癌对顺铂耐药有关,有待于后续实验在蛋白水平进一步验证。
本研究通过生物信息学和分子生物学实验相结合的手段,发现了一些可能影响卵巢癌细胞对顺铂产生耐药性的分子靶标,有助于加深研究者关于卵巢癌对顺铂耐药的认识,为新药的研发提供新的思路。
[1]Jiang J,Xie WY.Current Situation of the therapies of middle-ad⁃vanced ovarian cancer[J].Anti-tumor Pharmacy,2013,3(6):416-421.[蒋静,谢宛玉.中晚期卵巢癌的治疗现状[J].肿瘤药学, 2013.3(6):416-421].doi:10.3969/j.issn.2095-1264.2013.103.
[2]Wang HX,Zhai JJ,Wang L,et al.The differential expression of 14-3-3 protein in the cisplatin resistant of ovarian cancer[J].Journal of Obstetrics and Gynecology in China,2011,27(7):538-540.[王慧香,翟建军,王蕾,等.卵巢癌顺铂耐药细胞模型中14-3-3蛋白的差异表达[J].中国实用妇科与产科杂志,2011,27(7):538-540].doi:1005-2216(2011)07-0538-03.
[3]Wang RX,Xu JH.Genome DNA methylation and histone methyla⁃tion[J].Hereditas,2014,36(3):191-199.[王瑞娴,徐建红.基因组DNA甲基化及组蛋白甲基化[J].遗传,2014,36(3):191-199]. doi:10.3724/SP.J.1005.2014.0191.
[4]Ding Y,Gong XM.Progress of DNA methylation changes in ovarian cancer[J].J Int Obstet Gynecol,2014,41(3):236-239.[丁一,龚晓明.卵巢癌的DNA甲基化研究进展[J].国际妇产科学杂志,2014, 41(3):236-239].
[5]Jacob F,Hitchins MP,Fedier A,et al.Expression of GBGT1 is epi⁃ genetically regulated by DNA methylation in ovarian cancer cells[J].BMC Mol Biol,2014,15:24.doi:10.1186/1471-2199-15-24.
[6]Wittenberger T,Sleigh S,Reisel D,et al.DNA methylation markers for early detection of women's cancer:promise and challenges[J]. Epigenomics,2014,6(3):311-327.doi:10.2217/epi.14.20.
[7]Li M,Balch C,Montgomery JS,et al.Integrated analysis of DNA methylation and gene expression reveals specific signaling path⁃ways associated with platinum resistance in ovarian cancer[J]. BMC Med Genomics,2009,2:34.doi:10.1186/1755-8794-2-34.
[8]Gautier L,Cope L,Bolstad BM,et al.affy--analysis of Affymetrix GeneChip data at the probe level[J].Bioinformatics,2004,20(3): 307-315.doi:10.1093/bioinformatics/btg405.
[9]Diboun I,Wernisch L,Orengo CA,et al.Microarray analysis after RNA amplification can detect pronounced differences in gene ex⁃pression using limma[J].BMC Genomics,2006,7:252.doi: 10.1186/1471-2164-7-252.
[10]Sherman BT,Huang DW,Tanet Q,et al.DAVID Knowledgebase:a gene-centered database integrating heterogeneous gene annotation resources to facilitate high-throughput gene functional analysis[J]. BMC Bioinformatics,2007,8:426.doi:10.1186/1471-2105-8-426.
[11]Lee EL,Hasegawa Y,Shimizu T,et al.IK1 channel activity contrib⁃utes to cisplatin sensitivity of human epidermoid cancer cells[J]. Am J Physiol Cell Physiol,2008,294(6):1398-1406.doi:10.1152/ ajpcell.00428.2007.
[12]Xu FQ,Yang Y,Zhang XD,et al.Effect of oncoprotein HBXIP on the proliferation of ovarian cancer cells[J].Med J Chin PLA,2013,38(9):725-728.[徐福强,杨莹,张晓东,等.癌蛋白HBXIP对卵巢癌细胞增殖功能的影响[J].解放军医学杂志,2013,38(9):725-728].
[13]Liang XJ,Taylor B,Cardarelli C,et al.Different roles for K+chanels in cisplatin-resistant cell lines argue against a critical role for these channels in cisplatin resistance[J].Anticancer Res,2005,25(6B): 4113-4122.
[14]Gaiteri C,Ding Y,French B,et al.Beyond modules and hubs:the potential of gene coexpression networks for investigating molecular mechanisms of complex brain disorders[J].Genes Brain Behav, 2014,13(1):13-24.doi:10.1111/gbb.12106.
[15]Vangipurapu J,Stančáková A,Pihlajamäki J,et al.Association of indices of liver and adipocyte insulin resistance with 19 confirmed susceptibility loci for type 2 diabetes in 6,733 non-diabetic Finnish men[J].Diabetologia,2011,54(3):563-571.doi:10.1007/s00125-010-1977-4.
(2014-12-16收稿 2015-04-16修回)
(本文编辑 魏杰)
The analysis of cisplatin resistance in ovarian cancer treatment
ZHANG Yuqi,XING Li,WANG Tao
Tianjin Central Hospital of Gynecology Obstetrics,Tianjin 300100,China
ObjectiveTo screen the target genes that contribute to cisplatin resistance in ovarian cancer treatment. MethodsGene expression and methylation profiles of ovarian cancer cells that were sensitive or resistant to cisplatin with accession number GSE15709 were downloaded from GEO database.Differential expressed and methylated genes were identi⁃fied through associating packages in R.DAVID database to screen the enriched GO terms and pathways of the different ex⁃pressed genes between A2780 and A2780/DDP.Gene Set Enrichment Analysis(GSEA)of different gene was performed against DAVID database.Genes that exhibited difference in both expression and methylation profiles between the two types of ovarian cancer cells as well as genes that present contradictory profile between expression and methylation were verified via qRT-PCR.ResultsWe found 416 different expressed genes and 281 methylated genes between the two types of ovari⁃an cancer cells respectively.These differential genes were rich in pathways of cell cycle,DNA replication,nucleus division,p53 signaling,and negative regulation of protein modification process etc.Four genes demonstrated contradictory profile be⁃tween expression and methylation in the two types of ovarian cancer cells and were verified by qRT-PCR.Conclusion Combination of bioinformatics and molecular biology is useful in the identification of target genes that contribute to resis⁃tance of cisplatin in ovarian cancer treatment and further reveal molecular mechanism behind it.
cisplatin;ovarian neoplasms;computational biology;reverse transcriptase polymerase chain reaction;qRTPCR;A2780;A2780/DDP
R737.31
A
10.11958/j.issn.0253-9896.2015.10.006
天津市中心妇产科医院药剂科(邮编300100)
张玉琪(1971),女,主管药师,本科,主要从事临床药学方面研究



