付颖,董庆文,王稚英
富血小板纤维蛋白对牵引成骨区BMP-6表达的影响
付颖,董庆文,王稚英
摘要:目的探讨应用富血小板纤维蛋白(PRF)对牵引成骨区骨形态发生蛋白-6(BMP-6)表达的影响。方法25只大耳白兔随机分5组,分别行双侧下颌骨皮质骨切开术,一侧下颌骨牵引间隙放置PRF膜,作为实验组,对侧作为对照组,分别于稳定期第1、3、7、14、28天处死1组动物,切取牵引间隙处骨痂行HE染色和BMP-6免疫组织化学染色,细胞图像分析仪测量牵引间隙处骨痂BMP-6表达情况。结果下颌牵引延长后牵引间隙均有新骨形成,免疫组化染色显示BMP-6主要定位于成骨细胞的胞浆中。实验组在稳定期第1、3、7天BMP-6表达的阳性细胞率和阳性面积百分比均高于对照组(P<0.05),稳定期第14、28天BMP-6表达的阳性细胞率和阳性面积百分比均与对照组比较差异无统计学意义。结论PRF能促进兔下颌骨牵引成骨区新骨的生成,BMP-6可能在牵引成骨过程的早期调控组织细胞应力信号传递,发挥成骨作用。
关键词:骨形态发生蛋白质类;骨生成,牵张;兔;富血小板纤维蛋白;骨形态发生蛋白-6
作者单位:辽宁医学院附属第二医院口腔内科(邮编121000)
骨组织的修复与周围力学环境关系密切,牵张成骨技术(distraction osteogenesis,DO)正是利用骨的这一特性,给予一定牵引力,通过复杂的机械-细胞信号传导机制激发细胞增殖,促进新骨生成。在骨修复过程中骨形态发生蛋白-6(bone morphogenetic protein-6,BMP-6)作为一种信使,参与了细胞间的信号传导。在DO较长的疗程中存在许多并发症如伤口感染,骨不连、松脱等,因此,缩短疗程、减少并发症的相关研究越来越受到重视,其中,局部应用富血小板纤维蛋白(platelet-rich fibrin,PRF)促进牵引区新骨生成的研究已成为热点。PRF是一种自体静脉血经离心后的血小板纤维蛋白凝块,富含多种生长因子,这些因子可以有效地调控与骨组织修复相关的细胞增殖、分化以及凋亡[1]。因此推测PRF可能促进DO牵引区新骨的生成,有利于缩短疗程、减少并发症。本研究拟通过对兔下颌骨牵引过程中局部给予PRF膜后,检测牵引区的关键骨生长因子BMP-6表达的变化规律,探讨PRF膜对下颌骨DO牵引区新骨生成的影响机制,从而为缩短下颌骨DO疗程、减少并发症的临床治疗提供线索与依据。
1 材料与方法
1.1材料日本大耳白兔25只,体质量2.0~2.5 kg,普通级[(生产许可证号SCXK(辽)2014-0004)],购自辽宁医学院实验动物中心。北京大学王兴教授设计的外置式下颌骨纯钛牵引器由西安中邦公司制作。牵引杆每旋转1周,牵引器两固定臂间增大0.4 mm间隙。离心机、齿科低速手机、操作台、器械及麻醉药均由辽宁医学院科学实验中心提供。BMP-6的SABC免疫组化试剂盒(北京中杉金桥)。
1.2方法
1.2.1 PRF膜的制备在无菌条件下,每只大耳白兔抽取静脉血5 mL,经2次离心,2 400 r/min,10 min,3 600 r/min,15 min,从离心后的采血管中取出纤维蛋白凝胶,用纱布将PRF凝胶中的液体挤出,使其形成PRF膜[2],放入-70℃冰箱标号备用。
1.2.2实验动物饲养和分组大耳白兔在安静、温暖、避强光的环境中适应性圈养1周,每天均给予相同进食量(200 g)和足量饮用水,并保持环境清洁与卫生。采用抽签法将动物随机均分为5组,每组各5只。建立双侧下颌骨牵引成骨动物模型,一侧牵引间隙处放置PRF膜,作为实验组,对侧为对照组,分别于牵引稳定期第1、3、7、14、28天处死1组动物取材。本研究对动物的处理方法符合动物伦理学要求。
1.2.3下颌骨牵引成骨动物模型的建立实验动物按2.5 mg/kg经耳缘静脉注射10%平衡液全身麻醉后,在每只动物一侧下颌骨磨牙前部行骨切开术,安放牵引器,并于间隙处放置PRF膜,另一侧下颌骨磨牙前部行骨切开术并安放牵引器作为对照组,骨膜复位缝合,分层缝合肌肉、皮肤,牵引器加力杆端暴露于口外,间歇期5 d后,用牵引器按0.8 mm/d,2次/d,0.4 mm/次,每次间隔12 h的速率缓慢延长下颌骨。连续牵引5 d,共延长下颌骨4 mm后进入牵引稳定期[3]。
1.2.4光镜标本的制备与染色分别于稳定期第1、3、7、14、28天处死1组动物,将下颌骨修剪成以牵引区为中心的12 mm长组织块,放入4%中性甲醛溶液中固定,4℃,24 h。0.5 mol/L EDTA脱钙,乙醇梯度脱水,透明,包埋,切5 μm厚的切片,做苏木精-伊红(HE)染色,光镜观察。
1.2.5免疫组织化学法检测与分析取上述石蜡标本制备5 μm防脱切片,采用SABC法进行免疫组化染色。切片常规脱蜡至水后,采用pH 6.0枸橼酸钠缓冲液微波修复抗原活性,滴加1∶100稀释的一抗BMP-6抗体,4℃孵育过夜;滴加生物素化二抗,37℃水浴30 min;DAB显色,苏木素复染,脱水、透明、封片。阴性对照采用PBS替代一抗。光镜下观察,
BMP-6阳性表达部位定位于细胞胞浆。选择牵引成骨稳定期第1、3、7、14、28天不同时期切片,采用CIAS-1000细胞图像分析系统400倍视野观察下颌牵引成骨区不同时期BMP-6的表达。在免疫组织染色切片的牵引区的中心处随机读取5个视野,测每野细胞数及阳性细胞数;在同批未复染的免疫组织染色切片的牵引区的中心处随机读取5个视野,测阳性面积百分比。
1.3统计学方法应用Excel软件及SPSS 13.0统计分析软件处理,计量数据以x ±s表示,采用配对t检验,P<0.05为差异有统计学意义。
2 结果
实验动物全部存活到预定时间,伤口无感染,术后7 d内咀嚼功能稍有障碍,不影响健康和基本活动。牵引器固定稳定,周围无严重并发感染。取材时发现实验动物中切牙明显偏斜。
2.1 HE染色结果稳定期第1天,对照组和实验组牵引区均见无序排列的纤维结缔组织。稳定期第3天,对照组与实验组牵引区见纤维结缔组织沿牵引方向呈条束样,实验组更密集、粗大,见图1。稳定期第7天,对照组牵引区见沿牵引力方向的密集胶原纤维束;实验组在密集的胶原纤维内可见部分骨基质形成和矿化,近截骨线处见少量不规则的骨小梁。稳定期第14天,对照组牵引区有少量幼稚的骨小梁;实验组骨小梁数量增多。稳定期第28天,对照组牵引区骨小梁比较纤细、幼稚,近断端处较成熟,与牵引方向平行排列;实验组牵引区可见大量沿牵张力方向的骨小梁,表面规则地排列大量增生活跃的成骨细胞,见图2。
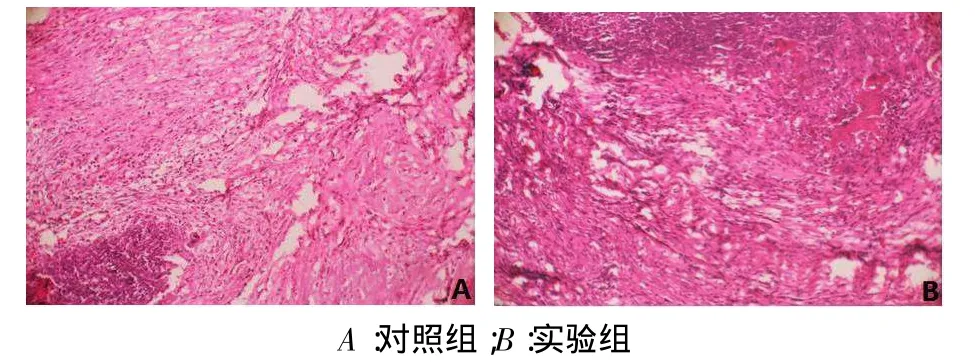
Fig.1 The arrangementof fibrous connective tissue onthe thirddayafter the end of distraction(HE,×100)图1稳定期第3天纤维结缔组织排列情况(HE,×100)

Fig.2 The formation of bone trabeculae on the twenty-eighth day after the end of distraction(HE,×100)图2稳定期第28天骨小梁的形成情况(HE,×100)
2.2免疫组织化学结果稳定期第1天,牵引区新骨BMP-6阳性表达,主要集中在间充质细胞的胞浆中,见图3。稳定期第3天,牵引区新骨BMP-6在大量增殖的间充质细胞、成纤维细胞和成骨细胞中呈强阳性染色,见图4。稳定期第7天,牵引骨痂处的骨髓衬里细胞BMP-6表达仍呈强阳性。稳定期第14天,牵引区新骨BMP-6在新生骨小梁表面的成骨细胞胞浆内呈阳性染色。稳定期第28天,牵引骨痂处的骨髓衬里细胞BMP-6表达呈弱阳性,见图5。
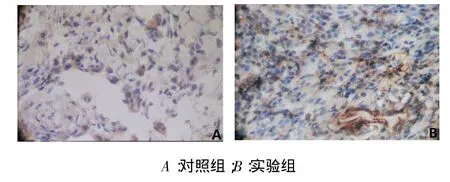
Fig.3 BMP-6 was localized in cytoplasm of large proliferation of osteoblast-like cells of the control group and experiment group on the 1st day after the end of distraction(DAB,×400)图3稳定期第1天对照组与实验组BMP-6在间充质细胞的胞浆中呈阳性染色(DAB,×400)
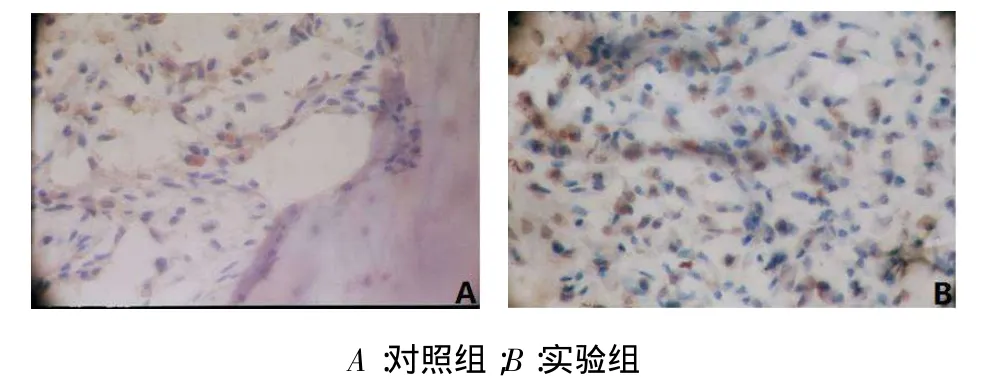
Fig.4 BMP-6 was localized in cytoplasm of large proliferation of osteoblast-like cells of the control group and experiment group on the third day after the end of distraction(DAB,×400)图4稳定期第3天对照组与实验组BMP-6在增殖的成骨细胞的胞浆中呈强阳性染色(DAB,×400)
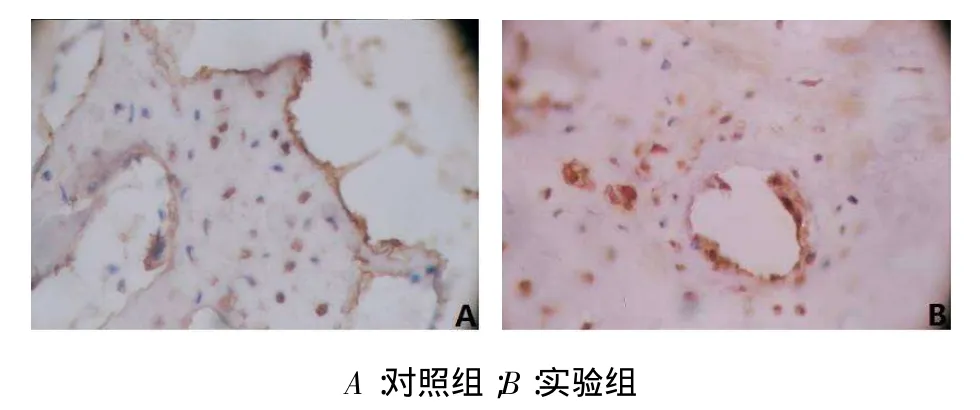
Fig.5 BMP-6 was localized in cytoplasm of osteoblast cells of naive trabecular bone of the control group and experiment group on the twentyeighth day after the end of distraction(DAB,×400)图5稳定期第28天对照组和实验组BMP-6在骨小梁表面的成骨细胞可见阳性着色(DAB,×400)
稳定期第1、3、7天实验组BMP-6表达的阳性细胞率和阳性面积百分比均高于对照组(P<0.05 或P<0.01);稳定期第14、28天2组BMP-6表达的阳性细胞率和阳性面积百分比差异无统计学意义,见表1、2。

Tab. 1 Comparation of BMP-6-positive cell rates in distracted calluses between two groups表1稳定期2组BMP-6表达的阳性细胞率比较(n=5,%, x ±s)
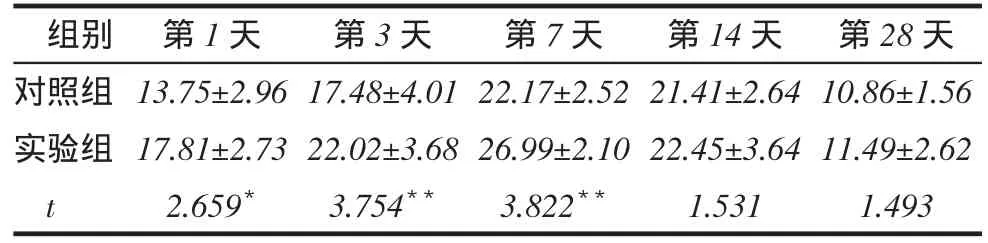
Tab. 2 Comparation of BMP-6-positive area percentage in distracted calluses between two groups表2稳定期2组BMP-6表达的阳性面积百分比比较(n=5,%, x ±s)
3 讨论
DO通过缓慢且稳定地牵引骨组织,促进骨愈合,无需植骨,手术简单。但治疗周期较长,有时出现骨不连、纤维性骨愈合并发症。因此,寻找一种既安全又有良好成骨能力的材料,对于促进骨的愈合至关重要,PRF因富含各种生长因子和纤维支架能加速成骨而备受关注。由于其取于自体血,制备过程简单,不需要添加抗凝剂及凝血酶,避免了交叉感染。Pripatnanont等[4]通过新西兰白兔动物实验,对比应用PRF膜的骨形成效果,发现放置PRF膜组成功地促进了骨缺损的修复,效果明显。Gassling等[5]首次将PRF作为支架材料和胶原膜比较,发现人来源的成骨细胞在PRF的作用下可以更好地增殖、迁移和分化。Hauser等[6]在临床拔除后牙的牙槽窝中应用PRF膜对比研究发现,应用PRF膜后能明显改善拔牙牙槽窝内的微体系结构,提高骨形成的质量,加快拔牙窝骨的愈合速度。
以上许多研究结果都表明PRF能明显提高骨的愈合和修复,但PRF如何通过影响细胞因子来加速骨痂的愈合,它与在成骨过程中起着重要作用的骨形成蛋白(BMPs)有何关系仍不清楚。具有成骨作用的细胞因子很多,比较重要而且研究较多的是BMP-2、BMP-4和BMP-6,而BMP-6是一种具有巨大潜力的成骨促进因子,骨组织的修复需要成骨细胞和破骨细胞的共同作用,BMP-6主要促进成骨细胞的分化。在裸鼠的实验中BMP-6诱导骨形成能力大于BMP-2和BMP-4,大量实验研究表明BMP-6能促进骨髓间充质干细胞(BMSCs)分化为成骨细胞、成软骨细胞等[7]。Mizrahi等[8]用BMP-2、BMP-6诱导小鼠骨髓基质细胞分化成骨,比较两者的成骨速度和数量,发现BMP-6明显优于BMP-2。Li等[9]和Fischerauer等[10]研究骨折的成骨过程中发现BMP-6在骨折的骨痂愈合中有重要作用。Lammens 等[11]通过动物实验证实BMP-6能明显促进牵引成骨区骨痂断端愈合,且在早期的牵引成骨过程中发挥重要作用。本实验中,稳定期第1、3、7天,兔下颌牵引成骨区覆盖PRF膜后,形成了合适的三维纤维蛋白网状支架,并提供大量自体细胞因子,牵引成骨区局部较高浓度BMP-6的释放与表达,成骨细胞增殖分化,从而加快牵引区新生骨痂的愈合,通过对牵引成骨区免疫组化分析发现,应用PRF组在稳定期第1、3、7天BMP-6在增殖活跃的间充质细胞和成骨细胞呈阳性表达也证实了这一点,而稳定期第14、28天,牵引成骨区组织细胞不再以增殖为主,主要表现为骨的改建,而在这一时期,HE染色发现骨小梁周围出现细胞核较大、胞浆少的大量成骨细胞,成行或复层排列,与李绍兰[12]的研究一致。免疫组化分析发现BMP-6仅有微弱表达,以上实验结果说明在DO早期,PRF能通过促进牵引区局部成骨细胞表达BMP-6,成骨作用明显,在骨改建的后期作用逐渐减弱。
本实验通过兔下颌DO动物模型研究,结果显示局部应用PRF膜能促进牵引间隙局部生长因子BMP-6的高表达,在局部发挥作用,刺激牵引区骨基质合成和诱导间充质细胞、成骨细胞、骨细胞的增殖分化等活性功能,从而更有效地促进牵引区新骨的生成和修复,加快钙化,为PRF膜能加快牵引区骨痂的愈合、缩短DO的治疗时间奠定了理论基础,为骨科疾病提供新的、比较简单、安全和廉价的治疗方法。
参考文献
[1] Zheng YL, Zhang GZ. The application of plateletirich fibin in oral medicine[J]. Chin J Stomatol Res(Electronic Edition), 2013, 7(2): 161-163.[郑友丽,张国志.富血小板蛋白在口腔医学中的应用[J].中华口腔医学研究杂志·电子版, 2013, 7(2):161-163].
[2] Hatakeyama I, Marukawa E, Takahashi Y, et al. Effects of platelet-poor plasma, platelet-rich plasma, and platelet-rich fibrin on healing of extraction sockets with buccal dehiscence in dogs [J]. Tissue Eng Part A,2014,20(3-4):874-882. doi: 10.1089/ten.TEA.2013.0058.
[3] Fu Y, Wang ZY, Li X. The changes of expressions of OPG and OP⁃GL in mandibular distraction osteogenesis in rabbit[J]. Jiangsu Med⁃ical Journal, 2013, 39(8):882-884. [付颖,王稚英,李新.骨保护素及其配体在兔下颌骨牵引成骨过程中表达水平的变化[J].江苏医药, 2013, 39(8):882-884].
[4] Pripatnanont P, Balabid F, Pongpanich S, et al. Effect of osteogenic periosteal distraction by a modified Hyrax device with and with⁃out platelet-rich fibrin on bone formation in a rabbit model:a pilot study [J]. Lnt J Oral Maxillofac Surg, 2015, 44(5):656- 663. doi: 10.1016/j.ijom.2014.12.004.
[5] Gassling V, Hedderich J, Acil Y, et al. Comparison of platelet rich fibrin and collagen as osteoblast-seeded scaffolds for bone tissue engineering application[J]. Clin Oral Implants Res, 2013, 24(3): 320-328. doi: 10.1111/j.1600-0501.2011.02333.x.
[6] Hauser F, Gaydarov N, Badoud I, et al. Clinical and histological evaluation of postextraction platelet-rich fibrin socket filling: a pro⁃spective randomized controlled study[J]. Implant Dent, 2013, 22(3): 295-303. doi: 10.1097/ID.0b013e3182906eb3.
[7] Xu G, Zhang CC, Zhou JS, et al.Advances in osteogenic mecha⁃nism and osteogenic effects of bone morphogenetic protein 6[J]. Chinese Jounal of Reparative and Reconstructive Surgery, 2013, 27(9):1144-1147. [许刚,张长春,周建生,等.BMP-6成骨机制和成骨效应的研究进展[J].中国修复重建外科杂志, 2013, 27(9):1144-1147].
[8] Mizrahi O, Sheyn D, Tawackoli W, et al. BMP-6 is more efficient in bone formation than BMP-2 when overexpressed in mesenchymal stem cells[J].Gene Ther, 2013, 20(4):370-377. doi: 10.1038/gt.2012.45.
[9] Li CJ, Madhu V, Balian G, et al. Cross- talk between VEGF and BMP-6 pathways accelerates osteogenic differentiation of hu⁃man adipose-derived stem cells[J]. J Cell Physiol, 2015, 230(11): 2671-2682. doi: 10.1002/jcp.24983.
[10] Fischerauer EE, Manninger M, Seles M, et al.BMP-6 and BMPR-1a are up-regulateded in the growth plate of the fractured tibia[J]. J Orthop Res, 2013, 31(3):357-363. doi: 10.1002/jor.22238.
[11] Lammens J, Liu Z, Luyten F.Bone morphogenetic protein signaling in the murine distraction osteogenesis model[J].Acta Orthop Belg, 2009, 75(1):94-102.
[12] Li SL. Effects of gege transfection on the expression of celluer growth factor in mandible distraction area(Master′s Degree Disserta⁃tion)[D]. Sichuan: Luzhou Medical College, 2011.[李绍兰.基因转染对下颌骨牵引区细胞生长因子表达的影响(硕士学位论文)[D].四川:泸州医学院, 2011].
(2015-07-09收稿2015-09-18修回)
(本文编辑李国琪)
Effects of platelet-rich fibrin on expression of BMP-6 during mandibular distraction osteogenesis
FU Ying, DONG Qingwen, WANG Zhiying
Department of Oral Medicine, Second Affiliated Hospital of Liaoning Medical University, Jinzhou 121000, China
Abstract:Objective To investigate the effects of platelet-rich fibrin (PRF) on BMP-6 expression during mandibular distraction osteogenesis. Methods Twenty-five mature rabbits were randomly divided into five groups. Mandibular osteoto⁃mies were performed corticectomy in bilateral mandibles of rabbits. PRF was implanted in the one side of mandibles, which was used as experimental group. Another side of madibular was used as control group. Rabbits were sacrificed and the dis⁃tracted calluses were harvested and processed for HE and BMP-6 immunohistochemistry staining at 1, 3, 7, 14 and 28 days after the end of distraction, respectively. The expressions of BMP-6 in the distracted calluses were analyzed by cell digital imaging software. Results The regenerated bone was found in the distraction gap after mandibular lengthening. Expres⁃sions of BMP-6 were co-localized in cytoplasm of osteoblasts and newly embedded osteocytes. Compared with control group, the positive cell rate and positive area percentage of BMP-6 were significantly higher on the 1st, 3th and 7th day after the distraction in experimental group (P<0.05). There were no significant differences in positive cell rate and positive area per⁃centage of BMP-6 at 14-day and 28-day after the distraction between experimental group and control group. Conclusion PRF can accelerate bone formation of mandibular distraction osteogenesis in rabbits. BMP-6 may play important role at the early stage of mandibular distraction.
Key words:bone morphogenetic proteins; osteogenesis, distraction; rabbits; platelet-rich fibrin; bone morphogenetic protein 6
中图分类号:R782.2
文献标志码:A
DOI:10.11958/20150028
基金项目:辽宁省自然科学基金项目(2015020352);辽宁省教育厅科学研究一般项目(L2013322)
作者简介:付颖(1977),女,副教授,硕士,主要从事口腔医学研究



