金涛,王兴强,刘超
肝脏缺血再灌注损伤中线粒体膜氧化应激和电生理功能障碍的分子机制研究
金涛1,王兴强2,刘超3△
目的探讨肝脏缺血再灌注损伤中线粒体膜氧化应激和电生理功能障碍的分子机制。方法建立SD大鼠肝移植(冷缺血再灌注组,n=20)和肝脏肝门部分阻断(热缺血再灌注组,n=20)的缺血再灌注损伤模型。以大鼠仅作肝十二指肠韧带分离,但不阻断肝脏肝门血液供应的10只大鼠为假手术组,采集各组血标本测定丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、肿瘤坏死因子-α(TNF-α)及白细胞介素-1β(IL-1β)水平;采集胆汁标本用于测定胆汁内葡萄糖的含量及γ-谷氨酰转移酶(GGT)水平;采集肝组织标本用于测定丙二醛(MDA)及超氧化物歧化酶(SOD),流式细胞仪测定肝细胞线粒体膜电位,采用酶联免疫吸附试验(ELISA)检测肝细胞内线粒体呼吸链复合体活性。结果冷、热缺血再灌注组大鼠的ALT、AST、胆汁葡萄糖、GGT、TNF-α、IL-1β及MDA水平均高于假手术组(P<0.01),且冷缺血再灌注组大鼠各项指标均高于热缺血再灌注组(P<0.05)。热缺血再灌注组和冷缺血再灌注组大鼠肝脏SOD水平均明显低于假手术组,并且热缺血再灌注组的SOD水平高于冷缺血再灌注组(P<0.01)。与假手术组相比,热、冷缺血再灌注损伤组再灌注0 h(缺血1 h)、1 h、12 h线粒体膜电位细胞的比例均降低(P<0.01);热、冷缺血再灌注损伤组组内随时间延长其线粒体膜电位活性有逐渐恢复的趋势(P<0.01)。假手术组0、72 h的线粒体呼吸链复合体Ⅲ、Ⅳ差异均无统计学意义;热、冷缺血再灌注组72 h较0 h线粒体呼吸链复合体活性均增高(P<0.01);0、72 h时,假手术组,热、冷缺血再灌注损伤组线粒体呼吸链复合体Ⅲ呈依次降低,而线粒体呼吸链复合体Ⅳ呈依次增高(P<0.01)。结论缺血再灌注损伤的强应激刺激可导致肝细胞线粒体膜氧化应激,进而导致肝细胞受到损害,线粒体内相关酶系统活性受损,最终导致线粒体内呼吸链酶复合体活性受损伤,这可能是氧化应激导致肝细胞线粒体膜氧化应激和电生理功能障碍,继而肝细胞损伤和能量代谢障碍发生的分子机制。
肝移植;再灌注损伤;疾病模型,动物;氧化应激;线粒体跨膜电位;肝脏损伤
肝脏缺血再灌注损伤是肝脏疾病外科治疗过程中常见的病理变化[1]。在肝脏移植手术、肝切除手术、肝脏血流阻断手术等肝脏外科技术操作中不可避免地会造成肝脏的冷/热缺血再灌注损伤。目前,有关肝脏缺血再灌注损伤的发病机制尚不完全清楚,但研究发现缺血再灌注过程所诱发的肝细胞能量代谢障碍与随之发生的肝细胞坏死及凋亡有着密切的关联[2]。因此,本研究选用大鼠冷/热缺血再灌注损伤模型,探讨肝脏缺血再灌注损伤中线粒体膜氧化应激和电生理功能障碍的分子机制。
1 材料与方法
1.1 大鼠肝脏缺血再灌注损伤模型的建立和分组(1)大鼠肝移植冷缺血再灌注损伤模型(冷缺血再灌注组,冷缺血组)。成年、清洁级SD大鼠40只,体质量200~300 g,平均(265±18)g,雌雄不限,均分为供体组和受体组。所有大鼠术前12 h禁食、不限水。参照文献[1]方法采取大鼠原位肝移植手术建立大鼠肝脏冷缺血再灌注损伤动物模型,改良处为:术中将供体肝胆总管与受体大鼠胆总管套管相吻合并肝脏冷缺血时长为2 h;术后继续灯照加温复苏;48 h内喂10%葡萄糖水,单笼喂养,其后正常进食。(2)大鼠肝脏肝门部分阻断热缺血再灌注损伤模型(热缺血再灌注组,热缺血组)和假手术组。成年、清洁级SD大鼠30只,体质量200~300 g,平均(260±19)g,雌雄不限。术前12 h禁食、不限水。取20只大鼠通过部分阻断肝脏肝门来建立肝脏热缺血再灌注损伤模型[1],改良处为:热缺血时长为30 min。另取10只为假手术组,大鼠开腹后找到并分离大鼠肝十二指肠韧带,但不阻断肝脏肝门血液供应;余步骤同热缺血再灌注组。
1.2 标本采集及指标检测方法模型大鼠造模成功后,每组大鼠分别在0 h(缺血1 h)、1 h、12 h、72 h活体取材。大鼠经乙醚麻醉满意后,切开腹壁,选择肝上、下腔静脉穿刺取血,收集大鼠胆汁,并收取肝脏左、中叶肝组织待检测,取材完毕后关腹,复苏,其后正常进食。血标本经离心后,收集部分上清液体用于测定反映肝脏细胞功能指标的丙氨酸转氨酶(ALT)和天冬氨酸转氨酶(AST),其余上清液体置于-70℃留存用于测定反映出肝脏胆管上皮细胞发生缺血再灌注损伤程度的肿瘤坏死因子-α(TNF-α)及白细胞介素-1β(IL-1β)水平。胆汁标本用于测定胆汁葡萄糖的含量及γ-谷氨酰转移酶(GGT)水平。选取部分肝组织标本研磨成10%的肝组织匀浆,测定间接反映膜系统受损程度的丙二醛(MDA)和体现机体清除活性氧能力的超氧化物歧化酶(SOD)水平;部分肝组织标本经0.9%生理盐水洗净后制备肝细胞悬液,利用荧光探针对肝细胞内线粒体行JC-1荧光染色,用流式细胞仪绘制反映JC-1荧光染色强度变化的流式图,计算各组于再灌注0 h(缺血1 h)、1 h、12 h、72 h时线粒体膜电位下降细胞的比例。采用酶联免疫吸附试验(ELISA)分别测定模型组于再灌注0 h(缺血1 h)、72 h经前述方法分离提纯的肝细胞内线粒体呼吸链复合体活性的光密度(OD)值,并与标准曲线进行比较,计算模型组肝细胞中线粒体呼吸链复合体Ⅲ、Ⅳ的浓度,并与假手术组结果相比较,以分析模型组线粒体功能。
1.3 统计学方法采用SPSS 20.0统计学软件进行统计学分析。符合正态分布的计量资料采用均数±标准差表示,治疗前后均数比较用配对t检验;多组间均数比较采用单因素方差分析,组间多重比较用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠肝脏ALT、AST及胆汁葡萄糖等水平变化情况比较假手术组、热缺血再灌注组、冷缺血再灌注组ALT、AST、胆汁葡萄糖、GGT、TNF-α及IL-1β水平均依次升高,组间多重比较差异均有统计学意义(均P<0.05),见表1。
2.2 各组大鼠SOD和MDA水平变化情况的比较热、冷缺血再灌注组大鼠肝脏SOD水平均低于假手术组。热缺血再灌注组SOD水平高于冷缺血再灌注组;而热、冷缺血再灌注组大鼠肝脏MDA水平均高于假手术组,并且热缺血再灌注组的MDA水平低于冷缺血再灌注组(P<0.05),见表2。
2.3 各组大鼠肝细胞线粒体膜电位变化情况与假手术组相比,热、冷缺血再灌注损伤组再灌注0 h(缺血1 h)、1 h、12 h及72 h线粒体膜电位下降细胞的比例均降低(P<0.05);热、冷缺血再灌注损伤组组内随时间延长其线粒体膜电位活性有逐渐恢复的趋势(P<0.05),见表3。
Tab.1Comparison of the levels of ALT,AST and bile glucose in liver of rats between three groups表1 各组大鼠肝脏ALT、AST及胆汁葡萄糖等水平变化情况比较
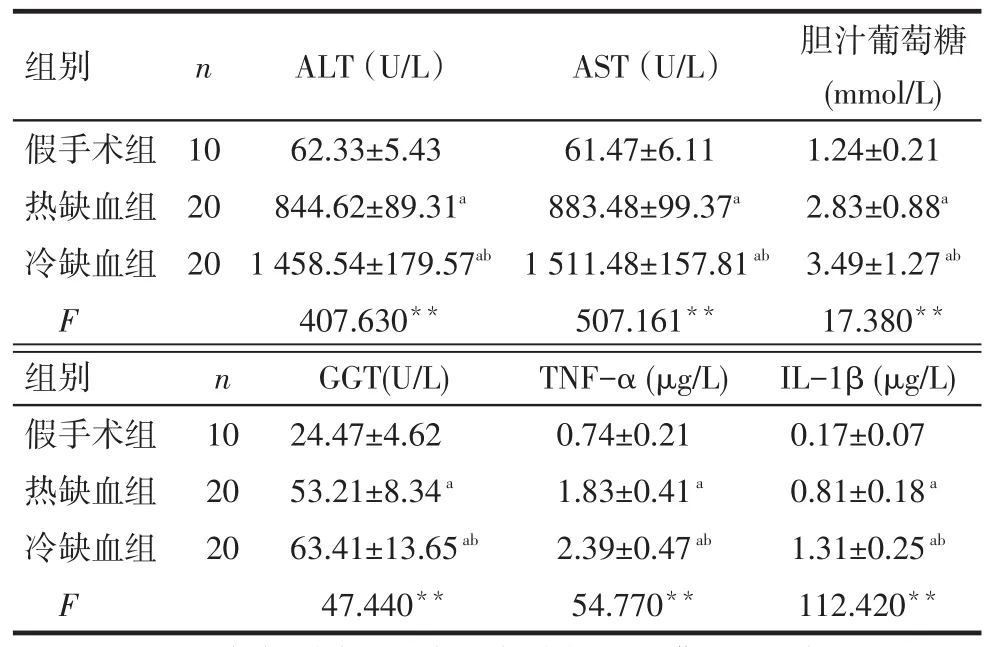
Tab.1Comparison of the levels of ALT,AST and bile glucose in liver of rats between three groups表1 各组大鼠肝脏ALT、AST及胆汁葡萄糖等水平变化情况比较
**P<0.01;a与假手术组比较,b与热缺血再灌注组比较,P<0.05;表2~4同
组别假手术组热缺血组冷缺血组F n 10 20 20 ALT(U/L)62.33±5.43 844.62±89.31a 1 458.54±179.57ab 407.630**AST(U/L)61.47±6.11 883.48±99.37a 1 511.48±157.81ab 507.161**胆汁葡萄糖(mmol/L) 1.24±0.21 2.83±0.88a 3.49±1.27ab 17.380**组别假手术组热缺血组冷缺血组F n 10 20 20 GGT(U/L) 24.47±4.62 53.21±8.34a 63.41±13.65ab 47.440**TNF-α(μg/L) 0.74±0.21 1.83±0.41a 2.39±0.47ab 54.770**IL-1β(μg/L) 0.17±0.07 0.81±0.18a 1.31±0.25ab 112.420**
Tab.2Comparison of SOD and MDA levels between three groups表2 各组SOD和MDA水平比较
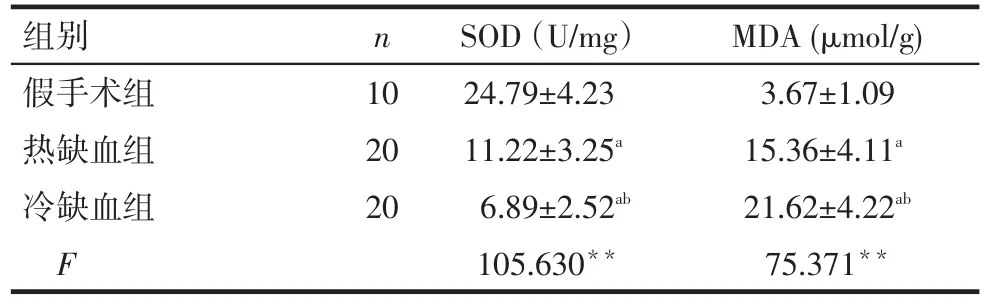
Tab.2Comparison of SOD and MDA levels between three groups表2 各组SOD和MDA水平比较
组别假手术组热缺血组冷缺血组F n 10 20 20 SOD(U/mg)24.79±4.23 11.22±3.25a 6.89±2.52ab 105.630**MDA(μmol/g) 3.67±1.09 15.36±4.11a 21.62±4.22ab 75.371**
2.4 各组大鼠线粒体呼吸链复合体活性变化情况比较组内比较:假手术组0、72 h的线粒体呼吸链复合体Ⅲ、Ⅳ差异均无统计学意义;热、冷缺血再灌注组72 h较0 h线粒体呼吸链复合体活性均增高(P<0.01)。组间比较:0、72 h时,假手术组,热、冷缺血再灌注损伤组线粒体呼吸链复合体Ⅲ呈依次降低,而线粒体呼吸链复合体Ⅳ呈依次增高,组间多重比较差异均有统计学意义(均P<0.05),见表4。
Tab.3Comparison of mitochondrial membrane potential at different time points before and after treatment between three groups表3 各组治疗前后不同时间段线粒体膜电位比较
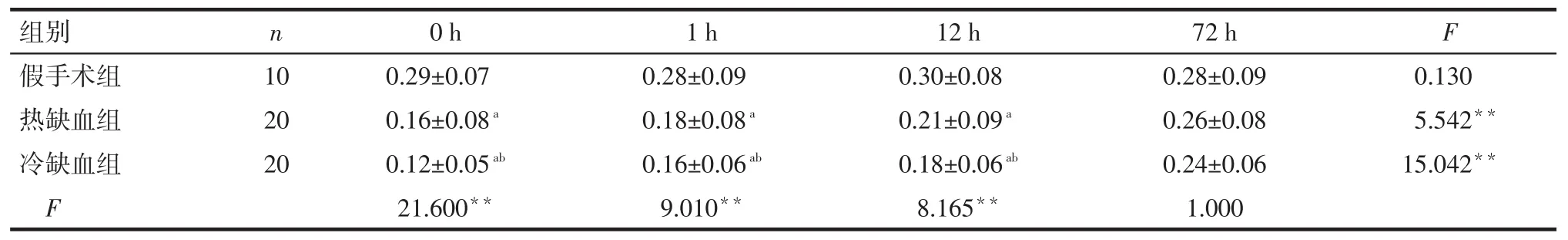
Tab.3Comparison of mitochondrial membrane potential at different time points before and after treatment between three groups表3 各组治疗前后不同时间段线粒体膜电位比较
组别假手术组热缺血组冷缺血组F n F 10 20 20 0 h 0.29±0.07 0.16±0.08a 0.12±0.05ab 21.600**1 h 0.28±0.09 0.18±0.08a 0.16±0.06ab 9.010**12 h 0.30±0.08 0.21±0.09a 0.18±0.06ab 8.165**72 h 0.28±0.09 0.26±0.08 0.24±0.06 1.000 0.130 5.542**15.042**
Tab.4Comparison of the activities of respiratory chain complexes in different time points between three groups表4 各组不同时间段线粒体呼吸链复合体活性比较[μmol/(min·mg),]
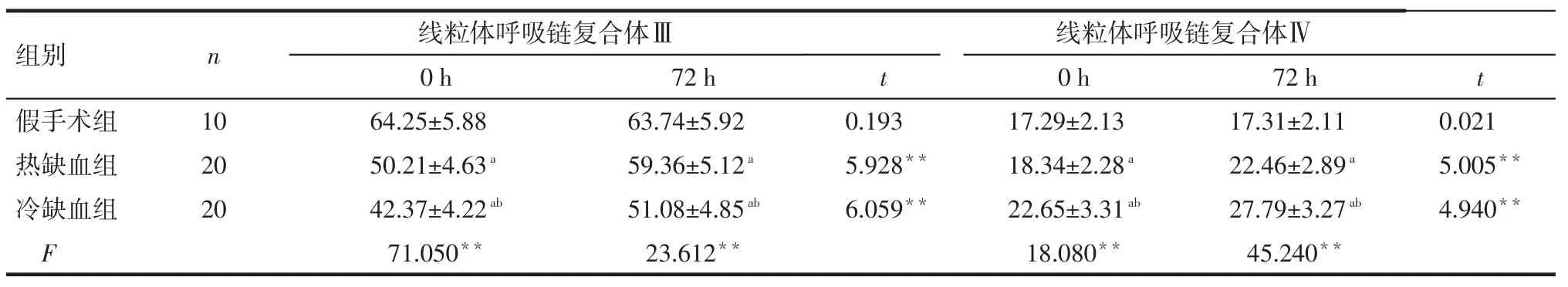
Tab.4Comparison of the activities of respiratory chain complexes in different time points between three groups表4 各组不同时间段线粒体呼吸链复合体活性比较[μmol/(min·mg),]
组别假手术组热缺血组冷缺血组F n 线粒体呼吸链复合体Ⅲ0 h 64.25±5.88 50.21±4.63a 42.37±4.22ab 71.050**72 h 63.74±5.92 59.36±5.12a 51.08±4.85ab 23.612**t t 10 20 20 0.193 5.928**6.059**线粒体呼吸链复合体Ⅳ0 h 17.29±2.13 18.34±2.28a 22.65±3.31ab 18.080**72 h 17.31±2.11 22.46±2.89a 27.79±3.27ab 45.240**0.021 5.005**4.940**
3 讨论
缺血再灌注损伤是肝脏外科疾病中常见的病理进程。进行肝脏切除的过程中需要对肝脏血液流入通道以及血液流出通道进行阻断,或进行选择性半肝血流阻断等多种外科措施来减少或避免术中出血、保证手术的顺利进行,但对肝脏血流进行阻断与恢复最终必然会导致肝脏发生热缺血再灌注损伤[3]。同时,随着肝脏移植手术逐渐成为各种终末期肝脏疾病的最佳治疗方式,供体肝脏在术前均需要进行冷灌注和保存,这势必又导致肝脏冷缺血再灌注损伤的增加。研究认为,肝脏的冷、热缺血再灌注损伤是导致患者在手术后发生肝脏功能减退、肝脏淤血甚至移植物无功能等严重并发症的重要原因[4]。
目前,有关肝细胞发生损伤的机制尚未完全明确,但近年来研究表明在缺血再灌注初期由于循环障碍,易造成血管内皮细胞肿胀,进而可造成血管管腔狭窄,血液中体积较大的白细胞发生嵌顿,诱发血小板凝聚,形成局部微循环损害,又造成局部组织缺乏能量供应,致细胞毒性水肿,最终进一步加剧血管内皮细胞以及枯否细胞的肿胀和血管收缩[5]。缺血再灌注损伤后,随着局部缺血时间的延长,可引发枯否细胞、中性粒细胞的活化,释放炎性因子及氧自由基,通过一系列氧化应激过程最终导致肝细胞损伤加剧[6]。因此,肝细胞能量状态是肝细胞发生缺血再灌注损伤关键因素。
在生理状态下,机体内不断生成氧自由基,同时又不断将氧自由基清除以保持动态平衡。肝脏发生缺血再灌注损伤致使肝细胞出现缺血缺氧,促使ATP分解代谢加剧,其代谢产物次黄嘌呤在肝细胞内大量积聚。氧化应激过程加剧,可致机体内源性抗氧化剂消耗殆尽,最终导致细胞产生大量的氧自由基[7]。此外,激活的肝巨噬细胞、中性粒细胞、单核吞噬细胞等在缺氧状态下细胞膜的烟酰胺腺嘌呤二核苷磷酸(NADPH)氧化酶受到刺激,这进一步加剧了氧自由基的聚集。氧自由基的另一个重要来源是线粒体,肝细胞缺血再灌注损伤过程可导致线粒体膜电位丧失,进而导致呼吸链功能障碍[8]。血清ALT和AST是反映肝脏细胞功能最常用的指标。大鼠胆汁葡萄糖GGT水平能够反映出肝脏胆管上皮细胞发生缺血再灌注损伤的程度[9]。本研究结果显示,热、冷缺血再灌注组大鼠ALT、AST及胆汁葡萄糖等水平均明显高于假手术组,表明在缺血再灌注过程中,大鼠肝细胞及胆管上皮细胞均存在明显的损伤。TNF-α和IL-1β是在肝细胞发生缺血再灌注损伤过程中发挥主要作用的两个细胞因子。SOD能够拮抗缺血再灌注损伤所导致的氧化应激过程,保护肝细胞免于受到氧自由基的攻击,且SOD活性的高低间接体现了机体清除活性氧的能力。本研究结果显示,与假手术组相比,冷、热缺血再灌注损伤组TNF-α和IL-1β升高,SOD和再灌注0 h(即缺血1 h)、1 h、12 h、72 h线粒体膜电位下降细胞的比例均降低;冷、热缺血再灌注损伤组组内随时间延长其线粒体膜电位活性有逐渐恢复的趋势,提示缺血再灌注后TNF-α和IL-1β均参与了肝细胞损伤的过程,但损伤发生后肝脏迅速开启了自我修复过程。
肝脏细胞缺血再灌注损伤发生后最终会造成肝脏细胞的死亡。肝细胞死亡方式主要包括肝细胞凋亡、肝细胞膨胀性坏死以及肝细胞自噬性死亡[10]。这些死亡方式往往是同时交错存在于肝脏缺血再灌注损伤中。肝细胞膨胀性坏死往往是由于肝脏细胞能量耗尽,从而导致细胞发生崩解,细胞出现水肿、胞内出现空泡、细胞核溶解碎裂,这种死亡过程不可逆。线粒体内含有众多与凋亡发生有关的促凋亡蛋白,细胞色素C是其中最具代表性的分子,从线粒体中释放出的细胞色素C有诱导细胞凋亡的作用,在胞浆内与凋亡酶激活因子连接,并与脱氧腺苷三磷酸(dATP)合二为一,形成一寡聚凋亡体[11]。该凋亡体通过对细胞凋亡蛋白酶9-前原蛋白进行结合或裂解,以体现其成熟的活化性。激活的凋亡蛋白酶9刺激后续凋亡蛋白酶,以控导细胞凋亡。本研究结果显示,与假手术组相比,冷、热缺血再灌注损伤组再灌注0 h(缺血1 h)、72 h线粒体呼吸链复合体Ⅲ、Ⅳ活性差异有统计学意义;且相同时间点热缺血再灌注组的呼吸链复合体Ⅲ活性高于冷缺血再灌注组,线粒体呼吸链复合体Ⅳ活性低于冷缺血再灌注组,而72 h较0 h活性均增高,表明冷、热缺血再灌注损伤组组内随时间延长其线粒体呼吸链复合体活性有逐渐恢复的可能。
综上所述,缺血再灌注损伤的强应激刺激可导致肝细胞线粒体膜氧化应激,线粒体内相关酶系统活性受损,最终损伤线粒体内呼吸链酶复合体活性,这可能是肝细胞缺血再灌注损伤发生的分子机制。
[1]CettaF,FusaiG,MalagòM.LiverPathophysiology:Liver Regeneration,Vascular alterations,and Ischemia/Reperfusion[M]. In:Luca Aldrighetti,Francesco Cetta,Gianfranco Ferla ed.Benign Tumors of the Liver.Switzerland:Springer International Publishing,2015:35-45.doi:10.1007/978-3-319-12985-3_4.
[2]Nace GW,Huang H,Klune JR,et al.Cellular-specific role of tolllike receptor 4 in hepatic ischemia-reperfusion injury in mice[J]. Hepatology,2013,58(1):374-387.doi:10.1002/hep.26346.
[3]Yang M,Antoine DJ,Weemhoff JL,et al.Biomarkers distinguish apoptoticandnecroticcelldeathduringhepaticischemia/ reperfusion injury in mice[J].Liver Transpl,2014,20(11):1372-1382.doi:10.1002/lt.23958.
[4]Attila S.Free radicals and hepatic ischemia-reperfusion[J].Orv Hetil,2015,156(47):1904-1907.
[5]Suyavaran A,Ramamurthy C,Mareeswaran R,et al.TNF-α suppression by glutathione preconditioning attenuates hepatic ischemia reperfusion injury in young and aged rats[J].Inflamm Res,2015,64(1):71-81.doi:10.1007/s00011-014-0785-6.
[6]Joe Y,Zheng M,Kim HJ,et al.Cilostazol attenuates murine hepatic ischemia and reperfusion injury via heme oxygenase-dependent activationofmitochondrialbiogenesis[J].AmJPhysiol Gastrointest Liver Physiol,2015,309(1):G21-G29.doi:10.1152/ ajpgi.00307.2014.
[7]Chouchani ET,Pell VR,James AM,et al.A unifying mechanism for mitochondrial superoxide production during ischemia-reperfusion injury[J].Cell metabolism,2016,23(2):254-263.doi:10.1016/j. cmet2015.12.009.
[8]Brandlhuber M,Armbruster M,Zupanc B,et al.A Novel and SensitiveApproachfortheEvaluationofLiverIschemia-Reperfusion Injury After Liver Transplantation[J].Invest Radiol,2016,51(3):170-176.doi:10.1097/RLI.0000000000000220.
[9]Yeh DY,Yang YC,Wang JJ.Hepatic warm ischemia-reperfusion–induced increase in pulmonary capillary filtration is ameliorated by administration of a multidrug resistance-associated protein 1 inhibitor and leukotriene D4 antagonist(MK-571)through reducing neutrophil infiltration and pulmonary inflammation and oxidative stress in rats[J].Transplant Proc,2015,47(4):1087-1091.doi: 10.1016/j.transproceed.2014.10.061.
[10]Gracia-Sancho J,Casillas-Ramírez A,Peralta C.Molecular pathways in protecting the liver from ischaemia reperfusion injury: a 2015 update[J].Clin Sci(Lond),2015,129(4):345-362.doi: 10.1042/CS20150223.
[11]Hu Q,Wood CR,Cimen S,et al.Mitochondrial damage-associated molecular patterns(MTDs)are released during hepatic ischemia reperfusion and induce inflammatory responses[J].PLoS One,2015,10(10):e0140105.doi:10.1371/journal.pone.0140105.
(2016-06-03收稿2016-07-29修回)
(本文编辑陆荣展)
The pathogenesis of oxidative stress damage to mitochondrial membrane and electrophysiological dysfunction of ischemia reperfusion injury of hepatocytes in rats
JIN Tao1,WANG Xingqiang2,LIU Chao3△
1 Department of ICU,Tianjin Nankai Hospital,Tianjin 300100,China;2 Department of ICU,Tianjin 1st Central Hospital; 3 Department of Cardiology,Tianjin Chest Hospital△
ObjectiveTo explore the pathogenesis of oxidative stress damage to mitochondrial membrane and electrophysiological dysfunction of ischemia reperfusion injury of hepatocytes in rats.MethodsSeventy rats were randomly divided into three experimental groups:sham operation(SHAM)group,warm hepatic ischemia/reperfusion(wI/R)group and cold hepatic ischemia/reperfusion(cI/R)group.Blood samples were collected for the detection of alanine aminotransferase (ALT),aspartate aminotransferase(AST),tumor necrosis factor-α(TNF-α)and interleukin(IL)-1 β levels.Bile samples were collected for the detection of glucose and γ-glutamyl transferase(GGT)levels.And liver samples were collected for the detection of malondialdehyde(MDA)and superoxide dismutase(SOD).Flow cytometry was used to detect mitochondrial membrane potential.The mitochondrial respiratory chain complex was examined using ELISA to assess ischemia reperfusion injury of hepatocytes in rats.ResultsThe results indicated that ALT,AST,GLU,GGT,TNF-α,IL-1β and MDA levels were increased significantly in the wI/R group and cI/R group than those in SHAM group(P<0.01),and those indexes were significantly higher in cI/R group than those of wI/R group(P<0.05).The SOD level was significantly lower in wI/R group and cI/R group than that in SHAM group,which was significantly higher in wI/R group than that of cI/R group(P<0.01).Compared with SHAM group,ratios of mitochondrial membrane potential were significantly decreased at 0,1 and 12 h I/R in wI/R group and cI/R group(P<0.01).The activity of mitochondrial membrane potential was gradually recovered with time in wI/R group and cI/R group(P<0.01).There were no significant differences in mitochondrial respiratory chain complexesⅢandⅣbetween 0 h and 72 h in SHAM group.The activity of mitochondrial respiratory chain complexes was increased at 72 h than that of 0 h in wI/R group and cI/R group(P<0.01).The activity of mitochondrial respiratory chain complexesⅢwas decreased ordinally at 0 h and 72 h,and the activity of mitochondrial respiratory chain complexesⅣwas increased ordinally in SHAM group,wI/R group and cI/R group(P<0.01).ConclusionMitochondrial membrane potential is significantly decreased after ischemia reperfusion injury,and the activity of mitochondrial respiratory chain complexes is significantly decreased as well,which might be the pathogenesis of oxidative stress damage to mitochondrial membrane and electrophysiological dysfunction of ischemia reperfusion injury of hepatocytes in rats.
liver transplantation;reperfusion injury;disease models,animal;oxidative stress;mitochondrial transmembrane potential;liver damage
R657.3,R364.12
A
10.11958/20160500
2013年中国博士后科学基金资助项目(2013M530880);2015年中国博士后科学基金资助项目(2015M581308)
1天津市南开医院重症医学科(邮编300100);2天津市第一中心医院移植ICU;3天津市胸科医院心内科
金涛(1973),男,副主任医师,学士,主要从事危重症医学方面研究
△通讯作者E-mail:liuchao74001@126.com



