姚健 ,朱健华 ,盛红专 △
心肌肥厚作为心脏对多种刺激的适应性反应,早期可减轻室壁压,维持心功能;但长期的心肌肥厚可导致心肌缺血、心律失常、心衰甚至猝死,逆转心肌肥厚可改善预后。研究显示,β受体阻滞剂可预防或逆转心肌肥厚[1-2]。钙调神经磷酸酶(calcineurin,CaN)是迄今发现的唯一受钙/钙调素活化的蛋白磷酸酶,其通过介导底物——核转录因子3的去磷酸化实现核转移,从而在多种原因所致的心肌肥厚中发挥重要作用,抑制CaN信号通路可预防和逆转心肌肥厚[3]。钙蛋白酶Ⅰ(CalpainⅠ)是一种Ca2+依赖性的半胱氨酸蛋白激酶,活化的CalpainⅠ在体外可剪切上百种蛋白。Burkard等[4]利用培养心肌细胞的方法已证实,血管紧张素Ⅱ可诱导CalpainⅠ活化后CaN羧基端的蛋白水解活化,推测存在CalpainⅠ作为上游信号因子调控CaN活性的信号通路。本实验采用腹主动脉缩窄致压力超负荷的大鼠心肌肥厚模型,以β受体阻滞剂美托洛尔干预,观察大鼠心肌肥厚程度及心肌中CalpainⅠ和CaN的变化,探讨CalpainⅠ、CaN信号通路在美托洛尔预防压力超负荷所致心肌肥厚中的作用。
1 材料与方法
1.1 大鼠心肌肥厚模型的制备与分组 清洁级健康、雄性SD 大鼠 30只,7~8周龄,体质量(200±20)g,购自上海西普尔必凯实验动物有限公司。参考文献[5]将大鼠麻醉后制备腹主动脉缩窄的压力超负荷模型。大鼠随机均分为假手术组(不缩窄腹主动脉,其余步骤同手术组)、手术组(单纯行腹主动脉缩窄术)、美托洛尔组(在腹主动脉缩窄基础上予美托洛尔每天灌胃),每组10只。美托洛尔组在手术当日始予美托洛尔(由阿斯利康公司提供)30 mg/(kg·d)灌胃,假手术组和手术组喂以等量生理盐水,共4周。其中手术组和美托洛尔组在术后1周内各死亡1只。
1.2 大鼠血压、心肌标本采集与质量测定 术后4周,各组大鼠称体质量(body weight,BW)后以2%戊巴比妥钠2 mL/kg腹腔注射麻醉后分离左侧颈总动脉,插入内充有肝素及生理盐水的导管,记录动脉血压[收缩压(SBP)/舒张压(DBP)],随后处死大鼠,取出心脏,用冰生理盐水冲去余血,滤纸吸干水分,电子天平称取左心室质量(left ventricular weight,LVW),以左心室质量/体质量(LVW/BW,单位:mg/g)作为判断大鼠心肌肥厚程度的指标[5]。
1.3 逆转录PCR(RT-PCR)法检测CaN mRNA表达 取大鼠左室心肌组织50~100 mg,用TRIzol法提取总RNA,逆转录后进行PCR扩增。PCR反应条件、引物序列等参考本研究组前期研究[6]进行,并对PCR产物行直接测序证实准确性。
1.4 Western blot法检测CaN和CalpainⅠ蛋白质表达 取大鼠左室心肌组织100 mg,提取心肌胞浆蛋白,BCA法测定蛋白浓度,参照文献[6]以GAPDH为内参进行目的蛋白CaN和CalpainⅠ蛋白表达量测定,结果以目的蛋白CaN或CalpainⅠ与GAPDH蛋白条带的光密度比值表示。
1.5 CaN活性测定 采用酶联免疫吸附试验(ELISA)试剂盒(Calcineurin Cellular Activity Assay Kit,Colorimetric Merck公司)检测。在酶标仪A620处读取吸光度(A)值,用试剂盒中的CaN标准品制备关于CaN活性与吸光度的标准曲线,根据各个样本测定的A值和标准曲线计算CaN酶活性[6]。
1.6 统计学方法 采用SPSS 17.0统计软件进行统计分析。符合正态分布的计量数据以均数±标准差(±s)表示,多组间均数比较用单因素方差分析,组间多重比较用q检验,P<0.05为差异有统计学意义。
2 结果
2.1 大鼠心肌肥厚程度及血压的变化 腹主动脉缩窄术后4周,手术组大鼠SBP、DBP、LVW/BW均较假手术组增高(P<0.05);美托洛尔组大鼠SBP、DBP虽较手术组略下降,但差异无统计学意义(P>0.05),且仍高于假手术组(P<0.05)。与手术组相比,美托洛尔组大鼠LVW/BW下降(P<0.05),与假手术组差异无统计学意义,见表1。
Tab.1 The changes of cardiac hypertrophy and blood pressure in three groups of rats表1 各组大鼠左心室心肌肥厚程度与血压变化(±s)
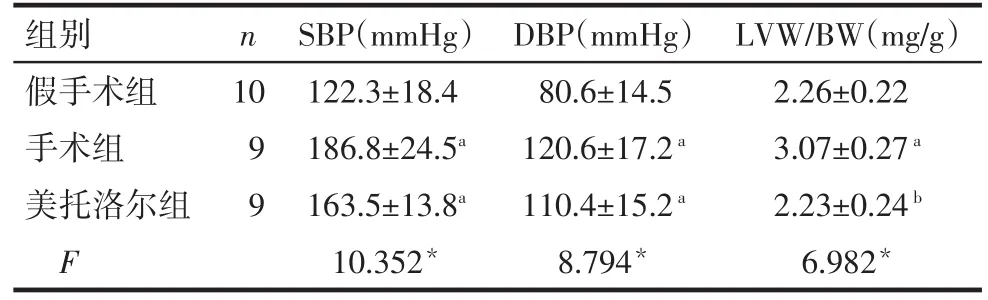
Tab.1 The changes of cardiac hypertrophy and blood pressure in three groups of rats表1 各组大鼠左心室心肌肥厚程度与血压变化(±s)
*P<0.05;a与假手术组比较,b与手术组比较,P<0.05;表2同;1 mmHg=0.133 kPa
2.2 CaN mRNA、蛋白表达和活性变化 手术组心肌CaN mRNA、CaN蛋白及活性较假手术组均升高(P<0.05)。美托洛尔组3个指标较手术组下降(P<0.05),但与假手术组差异均无统计学意义,见表2、图 2。
Tab.2 The changes of protein expression and activity of CaN mRNA in three groups表2 各组大鼠心肌中CaN mRNA、蛋白表达和活性变化(±s)
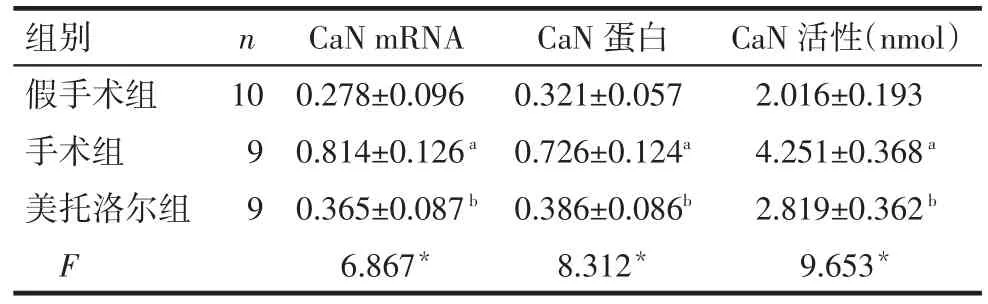
Tab.2 The changes of protein expression and activity of CaN mRNA in three groups表2 各组大鼠心肌中CaN mRNA、蛋白表达和活性变化(±s)
2.3 CalpainⅠ蛋白表达的变化 假手术组、手术组及美托洛尔组心肌CalpainⅠ蛋白表达量分别为0.233±0.018、0.613±0.086 和 0.326±0.102(F=10.286,P<0.05),其中手术组为假手术组 2.63倍(P<0.05);美托洛尔组较手术组下降(P<0.05),见图2。
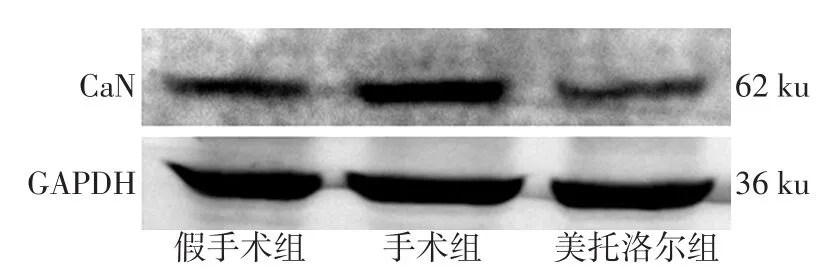
Fig.1 The changes of CaN protein expression in three groups of rat heart tissues图1 大鼠心肌CaN蛋白表达变化
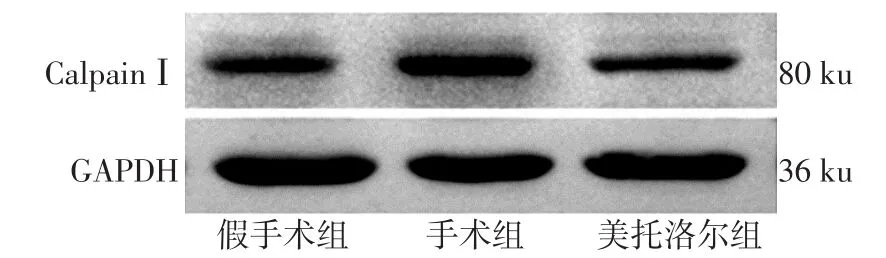
Fig.2 The changes of protein expression of CalpainⅠin three groups of rat heart tissues图2 大鼠心肌CalpainⅠ蛋白表达的变化
3 讨论
心肌肥厚早期可维持心功能,但长期的心肌肥厚可导致心脏多种并发症发生,β受体阻滞剂可预防或逆转心肌肥厚。本研究结果显示,腹主动脉缩窄术后4周,手术组大鼠SBP、DBP及LVW/BW较假手术组显着升高,提示模型制备成功,大鼠发生了血压升高、心肌肥厚。CaN是一种受钙和钙调素活化的蛋白磷酸酶,当胞内钙离子浓度升高时,CaN与钙、钙调素结合,CaN自主抑制区发生变构、移位,对催化区的抑制消失,CaN活化;活化的CaN可导致底物——核转录因子3的去磷酸化并核转移,从而介导多种胚心基因表达、心肌肥厚。本实验中手术组在发生心肌肥厚同时,心肌中CaN活性高于假手术组,同时还存在CaN mRNA和蛋白表达水平较假手术组升高,提示CaN参与了压力负荷增加所致的大鼠心肌肥厚过程;且CaN在此过程不仅存在活性水平改变,还存在基因和蛋白水平的调节[6]。CalpainⅠ作为一种Ca2+依赖性的半胱氨酸蛋白激酶,通过对多种底物酶的剪切活化,从而在心肌细胞凋亡、心肌肥厚中发挥作用[7]。本实验发现,手术组肥厚心肌中CalpainⅠ蛋白表达水平显着高于假手术组;美托洛尔组大鼠LVW/BW较手术组显着下降的同时,CalpainⅠ蛋白表达下降,提示CalpainⅠ也参与了腹主动脉缩窄、压力负荷增高所致的大鼠心肌肥厚过程。
本实验中美托洛尔组大鼠LVW/BW低于手术组,提示美托洛尔可预防腹主动脉缩窄、压力超负荷所致心肌肥厚。与手术组相比,美托洛尔在预防心肌肥厚的同时,不仅存在心肌CaN mRNA、蛋白质表达下调和CaN活性下降,还存在CalpainⅠ蛋白质表达下调,提示美托洛尔通过调控CalpainⅠ、CaN信号通路预防压力超负荷心肌肥厚的发生。
在培养的心肌细胞中发现,血管紧张素Ⅱ的刺激可诱导CalpainⅠ活化后CaN含自主抑制区的羧基端蛋白水解,致CaN的持续活化[4]。另有对人类心脏的研究发现,两种类型的Calpain(CalpainⅠ和CalpainⅡ)均可以导致CaN含自主抑制区的羧基端降解,致CaN持续活化,提示在心脏中存在Calpain致CaN水解活化的信号通路[8];且该通路参与了心脏瓣膜病合并糖尿病患者心律失常——房颤的发生过程[9];Calpain内源性抑制剂 Calpastatin过表达可通过降低Calpain和CaN活性,达到预防氧化应激所致的线粒体损伤和人神经母细胞死亡的作用[10]。
本研究中,手术组肥厚心肌中CalpainⅠ表达上调的同时存在CaN活性增加,美托洛尔组大鼠在心肌肥厚受抑的同时存在CalpainⅠ表达下调,并CaN活性下降,提示美托洛尔可通过抑制CalpainⅠ调控的CaN信号通路预防腹主动脉缩窄大鼠的心肌肥厚。
[1]Xing F,Chen J,Zhao B,et al.Real role of β-blockers in regression of left ventricular mass in hypertension patients:Bayesian network meta-analysis[J].Medicine(Baltimore),2017,96(10):e6290.doi:10.1097/MD.0000000000006290.
[2]Rizzi E,Guimaraes DA,Ceron CS,et al.β1-Adrenergic blockers exert antioxidant effects,reduce matrix metalloproteinase activity,and improve renovascular hypertension-induced cardiac hypertrophy[J].Free Radic Biol Med,2014,73:308-317.doi:10.1016/j.freeradbiomed.2014.05.024.
[3]Dierck F,Kuhn C,Rohr C,et al.The novel cardiac z-disc protein CEFIP regulates cardiomyocyte hypertrophy by modulating calcineurin signaling[J].J Biol Chem,2017,292(37):15180-15191.doi:10.1074/jbc.M117.786764.
[4]Burkard N,Becher J,Heindl C,et al.Targeted proteolysis sustains calcineurin activation[J].Circulation,2005,111(18):1045-1053.doi:10.1161/01.CIR.0000156458.80515.F7.
[5]姚健,盛红专,陆晓晨,等.美托洛尔对腹主动脉缩窄大鼠心肌双特异性酪氨酸磷酸化调节激酶1A-可变剪接因子-钙/钙调素依赖蛋白激酶Ⅱδ信号通路的影响[J].中华心血管病杂志,2013,41(12):1029-1033.Yao J,Sheng HZ,Lu XC,et al.Metoprolol attenuates pressure overload-induced myocardial hypertrophy through modulating Dryk1A-ASF-CaMKIIδ signaling pathways[J].Chin J Cardiol,2013,41(12):1029-1033.doi:10.3760/cma.j.issn.0253-3758.2013.12.009.
[6]陆尽亚,朱健华,秦小同,等.缬沙坦对肾血管性高血压大鼠心肌钙蛋白酶I、钙调神经磷酸酶和钙/钙调素依赖蛋白激酶IIδ的影响[J].中华心血管病杂志,2012,40(6):511-515.Lu JY,Zhu JH,Qin XT,et al.Role of valsartan on myocardial Calpain I,calcineurin and Ca/calmodulin-dependent protein kinase IIδ expression of renovascular hypertensive rats[J].Chin J Cardiol,2012,40(6):511-515.doi:10.3760/cma.j.issn.0253-3758.2012.06.012.
[7]Ye T,Wang Q,Zhang Y,et al.Over-expression of calpastatin inhibits calpain activation and attenuates post-infarction myocardial remodeling[J].PLoS One,2015,10(3):e0120178.doi:10.1371/journal.pone.0120178.
[8]Wang JC,Zhao Y,Li XD,et al.Proteolysis by endogenous calpain I leads to the activation of calcineurin in human heart[J].Clin Lab,2012,58(11/12):1145-1152.doi:10.1371/journal.pone.0120178.
[9]Zhao Y,Cui GM,Zhou NN,et al.Calpain-calcineurin-nuclear factor signaling and the development of atrial fibrillation in patients with valvular heart disease and diabetes[J].J Diabetes Res,2016,2016:4639654.doi:10.1155/2016/4639654.
[10]Tangmansakulchai K,Abubakar Z,Kitiyanant N,et al.Calpastatin overexpression reduces oxidative stress-induced mitochondrial impairment and cell death in human neuroblastoma SH-SY5Y cells by decreasing calpain and calcineurin activation,induction of mitochondrial fission and destruction of mitochondrial fusion[J].Mitochondrion,2016,30:151-161.doi:10.1016/j.mito.2016.07.009.



