李强,郑方遒,郭伟红△
女性体内的雄激素有硫酸脱氢表雄酮(DHEAS)、脱氢表雄酮(DHEA)、雄烯二酮(AD)、睾酮(T)和双氢睾酮(DHT)。这些雄激素在女性体内具有重要作用,是雌激素合成的前体,在女性青春期发育、早期性腺分化及发育过程中起关键作用,对靶器官(肌肉、骨骼等)有不可替代的作用。女性体内雄激素过多可出现月经紊乱或闭经、多毛、雄激素脱发、痤疮、阴蒂肥大等多种女性男性化表现[1],严重影响女性正常生活及生育。本文报告3例不同病因导致的女性高雄激素血症病例。
1 病例报告
例1 女,33岁。因原发性不孕并发现血清T升高2年,于2016年8月17日在天津医科大学总医院内分泌代谢科入院。患者入院前2年因不孕就诊时发现血T升高为4.0 nmol/L(正常参考值范围为 0.49~2.64 nmol/L,下同),无多毛、脱发、月经紊乱。予炔雌醇环丙孕酮(达英)治疗3个月后复查T 4.2 nmol/L。入院前1年半,自行应用中药治疗(具体不详)约半年,复查T 3.9 nmol/L,未予进一步诊治。入院前1年,再次就诊后予达英治疗5个月,复查血T 6.7 nmol/L,遂就诊于我院门诊,查17-羟孕酮(17-OHP)升高,为求进一步诊治收入院。平素月经周期规律,经量正常,无痛经。1个月前发现高胰岛素血症。查体:体质量指数(BMI)22.3 kg/m2,双上肢及下肢体毛略增多,下颌、乳房区、脐周未见明显体毛。第二性征发育Tanner分期B5P5,无阴蒂肥大。辅助检查:肝肾功能均正常。血K+4.04 mmol/L,Na+139 mmol/L。甲状腺功能正常。肾上腺皮质功能:促肾上腺皮质激素(ACTH)13.16 pmol/L(0~10.12 pmol/L),皮质醇 629.28 nmol/L(138~690 nmol/L),尿皮质醇 67.9 nmol/24 h(82.8~303.6 nmol/24 h);(卧位)肾素活性(PRA)1.01µg/(L·h)[0.05~0.79µg/(L·h)],醛固酮(ALD)321.32 pmol/L(138.5~484.75 pmol/L)。性激素:卵泡刺激素(FSH)6.49 IU/L(2.5~10.2 IU/L),黄体生成激素(LH)4.8 IU/L(1.9~12.5 IU/L),雌二醇(E2)370.76 pmol/L(69.54~527.04 pmol/L),孕酮(P)7.23 nmol/L(0.48~4.44 nmol/L),T 5.96 nmol/L,AD 13.57 nmol/L(1.04~11.45 nmol/L),17-OHP两次分别为31.18 nmol/L和74.87 nmol/L(0.15~3.64 nmol/L)。胰岛功能:血糖:0 min 5.02 mmol/L,30 min 6.18 mmol/L,60 min 7.83 mmol/L,120 min 7.25 mmol/L,180 min 5.93 mmol/L;胰岛素:0 min 10.6 mU/L,30 min 109.6 mU/L,60 min 154.5 mU/L,120 min 178.8 mU/L,180 min 78.08 mU/L。妇科超声:子宫及双侧卵巢未见明显异常。肾上腺增强CT:双侧肾上腺未见明显异常(图1)。中剂量地塞米松抑制试验:第1天T 5.96 nmol/L,17-OHP 74.87 nmol/L;给药后第 2 天 T 0.86 nmol/L,17-OHP 26.33 nmol/L。初步诊断:(1)先天性肾上腺皮质增生症(CAH)?(2)21-羟化酶缺陷症(非经典型)?建议进一步行基因检查,患者拒绝,要求先改善胰岛素水平后观察T变化。故予二甲双胍联合吡格列酮治疗3个月后复查T 3.98 nmol/L,未见明显下降。患者同意行基因检测,结果提示患者21羟化酶存在2个突变位点:CYP21A2 c.293-13C>G p?,剪接突变,引起剪接信号改变;CYP21A2 c518T>A p.(IIe173Asn),错义突变(异亮氨酸变为天冬氨酸),其致病性均被反复报道;患者父亲和母亲21羟化酶相同位点分别存在突变(图2)。予地塞米松0.375 mg每晚睡前口服治疗,3周后复查T 1.19 nmol/L。最后诊断:CAH,21-羟化酶缺陷症(非经典型)。
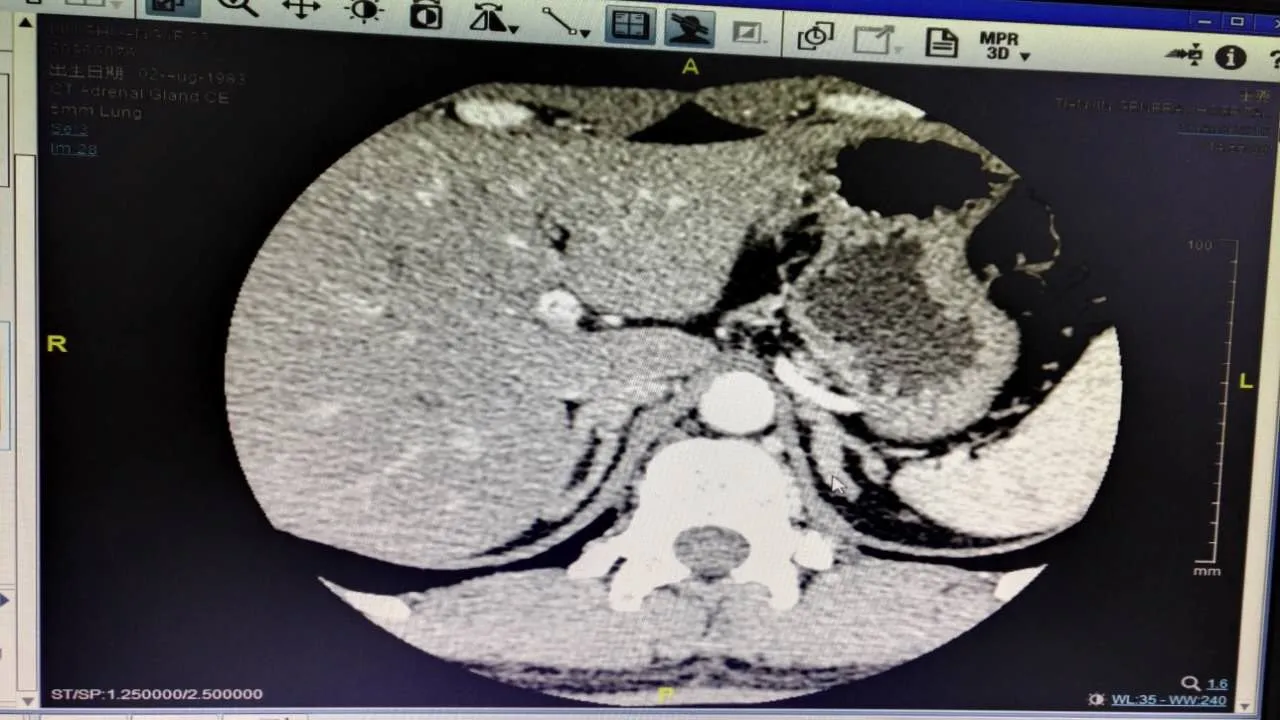
Fig.1 Image showing enhanced CT of adrenal gland图1 例1肾上腺增强CT
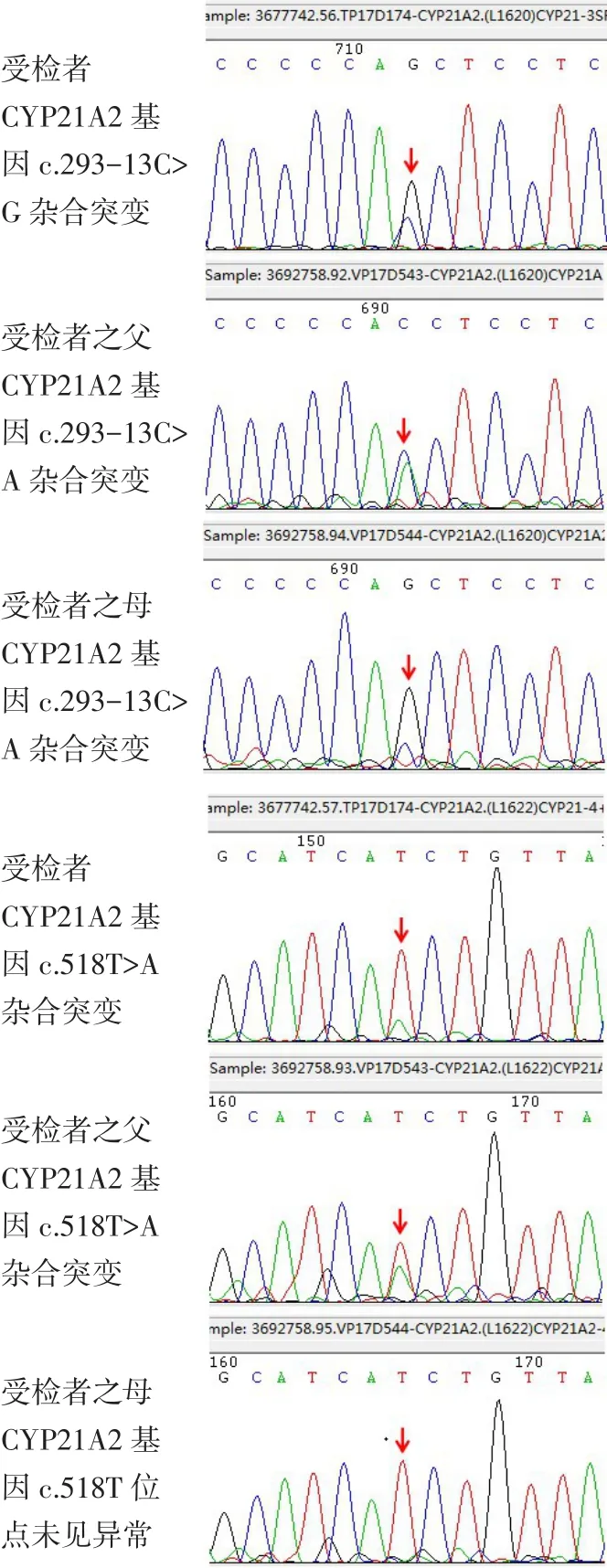
Fig.2 Gene test results of the case 1图2 例1基因检测结果
例2 女,26岁。因发现雄激素升高4个月,于2017年1月3日在天津医科大学总医院内分泌代谢科入院。患者4个月前备孕体检时发现血T 5.08 nmol/L,AD 27.17 nmol/L,且腋毛、阴毛增多,予达英治疗3个月后复查T 12.63 nmol/L,AD>27.76 nmol/L;为求进一步诊治收入院。平素月经周期规律。查体:BMI 22.6 kg/m2,脐周毳毛、腋毛、阴毛较多,第二性征发育Tanner分期B5P5,无阴蒂肥大。辅助检查:血K+4.21 mmol/L,Na+143 mmol/L。甲状腺功能、肾上腺皮质功能均正常。性激素:FSH 6.11 IU/L,LH 4.8 IU/L,E2296.09 pmol/L,P 1.84 nmol/L,T 6.03 nmol/L;AD 21.06 nmol/L;DHEA 10.2 nmol/L(2.78~36.44 nmol/L);(卧位)PRA 0.41µg/(L·h),ALD 476.44 pmol/L;妇科超声:子宫和双侧卵巢未见异常,宫颈多发囊肿。肾上腺增强CT:左侧肾上腺肿块,考虑腺瘤可能性大(图3)。中剂量地塞米松抑制试验:第1天T 8.92 nmol/L,17-OHP 24.79 nmol/L;给药后第 2 天 T 8.36 nmol/L,17-OHP 21.94 nmol/L。初步诊断:肾上腺肿物。行腹腔镜肾上腺肿物切除后第2天查T 1.83 nmol/L,17-OHP 1.18 nmol/L。术后病理:肾上腺腺瘤(图4)。最后诊断:肾上腺腺瘤。
例3 女,47岁。因毛发增多20年,闭经6年,于2016年7月23日在天津医科大学总医院内分泌代谢科入院。患者入院前20年口服避孕药后出现毛发增多,月经稀发,未诊治。6年前出现闭经,伴毛发增多加重,主要为体毛、阴毛、腋毛增多;1年前上述症状加重,伴胡须增多、阴蒂增大、头发脱落;半年前就诊于我院查T 5.0 nmol/L,肾上腺CT平扫示左侧肾上腺增粗,边缘呈结节状。为求进一步诊治收入院。既往银屑病病史20余年,糖尿病病史5个月。查体:BMI 32.6 kg/m2,头发稀疏,头顶部明显,可见胡须,体毛、腋毛、阴毛增多(图5),双肘关节、双下肢散在银屑病样皮疹,第二性征发育Tanner分期B5P5,可见阴蒂肥大。辅助检查:血K+3.74 mmol/L,Na+137 mmol/L。甲状腺功能正常。肾上腺皮质功能:ACTH 17.9 pmol/L,血皮质醇894.24 nmol/L,尿皮质醇109.02 nmol/24 h;性激素:FSH 6.62 IU/L,LH 3.46 IU/L,E2180.0 pmol/L,P 1.68 nmol/L,T 9.73 nmol/L;17-OHP 2.82 nmol/L;DHEA 8.64 nmol/L。肿瘤标志物均阴性。全腹CT增强:双侧肾上腺未见确切结节及肿块影;双侧附件区结节。妇科超声:子宫增大,右侧卵巢回声异常(囊实性肿物)?左侧卵巢回声不均。盆腔MRI增强:左侧附件区结节,不除外卵巢性索-间质来源肿瘤,双侧卵巢间质较厚,亦不除外多囊卵巢综合征(PCOS),见图6。中剂量地塞米松抑制试验:第1天T 9.0 nmol/L,17-OHP 2.95 nmol/L;给药后第2天T 8.72 nmol/L,17-OHP 2.48 nmol/L。初步诊断:卵巢肿物。转妇产科行手术治疗,术后病理回报:(右侧)Leydig细胞瘤伴卵巢皮质增生;(左侧)卵泡膜纤维瘤(图7)。术后第2天查T 1.09 nmol/L。最后诊断:卵巢Leydig细胞瘤(右侧)。
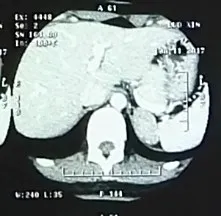
Fig.3 Image showing enhanced CT of adrenal gland图3 肾上腺增强CT
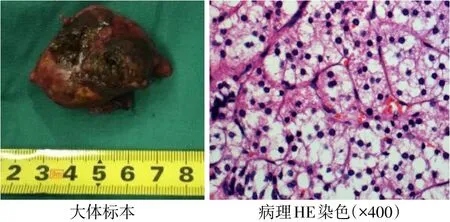
Fig.4 Adrenal adenoma tumor specimen and pathological HE staining of the case 2图4 例2肾上腺腺瘤大体标本及病理HE染色
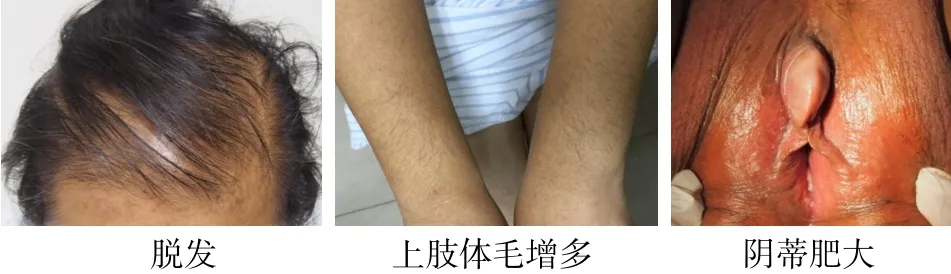
Fig.5 The clinical manifestation of the case 3图5 例3临床表现
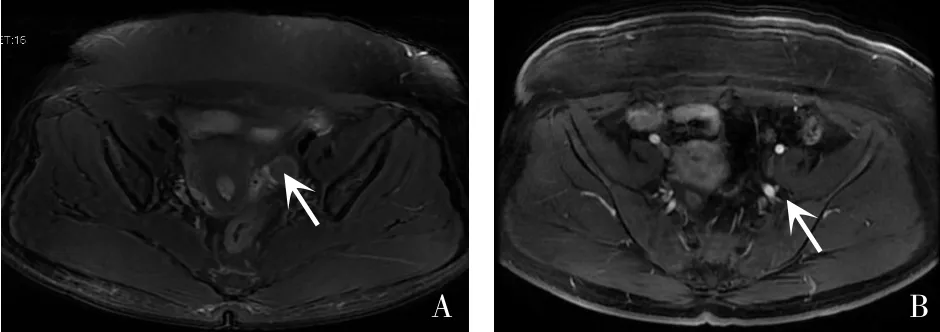
Fig.6 Image showing the enhanced MRI of pelvic cavity图6 盆腔MRI增强
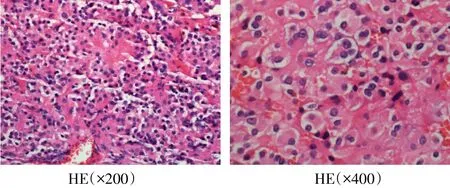
Fig.7 The pathological HE staining of the case 3图7 例3(右侧)卵巢病理结果(HE染色)
2 讨论
女性体内每日产生T 0.1~0.4 mg,其中25%由卵巢的卵泡内膜细胞分泌,25%由肾上腺皮质球状带分泌,50%由其他雄激素在外周组织如肝脏、脂肪组织、毛囊等转化形成。因年龄不同,女性雄激素增多临床表现各异,青春前女孩多表现为性早熟,如生长加速、骨龄提前、阴毛浓密、阴蒂肥大、毳毛增多等;青春期后或成年女性可出现月经紊乱或闭经、多毛、痤疮、雄激素性脱发、声音低沉等男性化表现[2]。
临床上常见的致雄激素升高的卵巢疾病有PCOS和卵巢肿瘤。2/3的PCOS患者伴有高雄激素血症,但PCOS患者高水平的雄激素可能不只来源于一种腺体。有研究指出20%~30%PCOS患者血清DHEAS水平升高[3],而DHEAS几乎完全来源于肾上腺。高胰岛素血症可能是PCOS雄激素升高的重要原因[4-5]。例1患者无典型雄激素增多的男性化表现,无典型CAH表现,因在门诊发现高胰岛素血症,曾被怀疑PCOS或高胰岛素血症相关雄激素升高,故患者初始不接受CAH的诊断,予对症改善胰岛素抵抗治疗后T未下降,不支持PCOS诊断。分泌雄激素的卵巢肿瘤占所有卵巢肿瘤不到5%,且体积都较小,不易被发现。其中睾丸母细胞瘤、卵巢门细胞瘤、颗粒细胞瘤及卵泡膜细胞瘤是较常见的分泌雄激素的卵巢肿瘤。大多数肿瘤分泌的雄激素不受促性腺激素和促肾上腺皮质激素调控。例3的成年女性患者有明显的男性化表现,在寻找雄激素来源时肾上腺CT及中剂量地塞米松抑制试验基本除外肾上腺来源,卵巢超声及盆腔MRI高度可疑卵巢来源,因术前不除外恶性可能以及左、右卵巢病变位置不确定,故行子宫加双附件切除术,经术后病理证实为(右侧)Leydig细胞瘤。
致雄激素升高的肾上腺疾病有皮质醇增多症、先天性肾上腺皮质增生症和肾上腺肿瘤等。ACTH依赖性皮质醇增多症即Cushing综合征,因高水平ACTH可刺激肾上腺皮质球状带雄激素合成增加[6],患者常有皮质醇增多症的典型外貌,如满月脸、水牛背、向心性肥胖、皮肤紫纹等,从患者的外貌及血ACTH和皮质醇水平即可诊断。CAH为肾上腺皮质类固醇激素生物合成过程中某种代谢酶的先天性缺乏,引起肾上腺皮质激素合成不足,经下丘脑-垂体-肾上腺轴反馈调节,导致肾上腺皮质增生及皮质激素合成的中间产物过量生成。21-羟化酶及11β-羟化酶缺陷症是CAH中常见的致雄激素增多的类型,因酶的缺乏致中间产物17-OHP等生成过多、胆固醇代谢向雄激素合成方向增加,睾酮升高;同时因皮质醇及醛固酮合成减少出现电解质紊乱。例1无明显雄激素过多表现,无电解质紊乱及高血压,因不孕就诊,中剂量地塞米松试验结果阳性,可疑CAH、21-羟化酶缺陷症。21羟化酶缺陷症可分为单纯男性化型、失盐型及非经典型3种类型。非经典型CAH患者临床表现差异很大,可无任何临床症状或症状较轻。经典CAH双侧肾上腺弥漫性增粗,谷伟军等[7]对45例临床诊断的CAH患者肾上腺CT进行分析,发现还有多种影像学异常表现,如单侧肾上腺弥漫性增粗、肾上腺结节样增粗、肾上腺增粗伴实性占位、肾上腺形态正常等。非经典型CAH的诊断依赖于血清17-OHP浓度。Carmina等[8]提出对基础17-OHP≥6 nmol/L的患者进行筛查;确定性诊断需要17-OHP浓度≥30 nmol/L(无论是基础或在ACTH刺激后)。例1无典型CAH临床表现及影像学异常,基础17-OHP水平达74.87 nmol/L,临床诊断非经典型CAH,后经基因检测证实为21-羟化酶缺乏症,予地塞米松治疗后T下降至正常。分泌雄激素的肾上腺肿瘤较少见,其中75%为恶性,良性肾上腺肿瘤更为罕见[9]。肾上腺皮质癌恶性程度较高、侵袭性较强,预后差。分泌的高水平的雄激素不能抑制促性腺激素,且不能被地塞米松抑制,呈自主分泌。例2雄激素升高伴肾上腺占位,中剂量地塞米松抑制试验阴性,术后病理诊断为肾上腺腺瘤。
综上所述,女性高雄激素血症需主要区分肾上腺来源和(或)卵巢来源,认真的体格检查及辅助检查有助于鉴别诊断,中剂量地塞米松抑制试验对于鉴别CAH有重要意义,必要时应行基因检测明确诊断。
[1]Mamoojee Y,Ganguri M,Taylor N,et al.Clinical case seminar:challenges in diagnostic work-up and management of ovarian thecosis[J].Clin Endocrinol(Oxf),2018,88(1):13-20.doi:10.1111/cen.13492.
[2]Lizneva D,Gavrilova-Jordan L,Walker W,et al.Androgen excess:Investigations and management[J].Best Pract Res Clin Obstet Gynaecol,2016,37:98-118.doi:10.1016/j.bpobgyn.2016.05.003.
[3]Kumar A,Woods KS,Bartolucci AA,et al.Prevalence of adrenal androgen excess in patients with the polycystic ovary syndrome(PCOS)[J].Clin Endocrinol(Oxf),2005,62(6):644-649.
[4]熊冬梅,谷霞,许志良,等.多囊卵巢综合征患者高雄激素的相关性研究[J].实用医院临床杂志,2013,10(4):56-58.Xiong DM,Gu X,Xu ZL,et al.Correlation of hyperandrogenism with insulin resistance and serum luteinizing hormone in the patients with polycystic ovary syndrome[J].Practical Journal of Clinical Medicine,2013,10(4):56-58.
[5]Tosi F,Negri C,Brun E,et al.Insulin enhances ACTH-stimulated androgen and glucocorticoid metabolism in hyperandrogenic women[J].Eur J Endocrinol,2011,164(2):197-203.doi:10.1530/EJE-10-0782.
[6]Pepe GJ,Maniu A,Aberdeen G,et al.Estrogen regulation of fetal adrenal cortical zone-specific development in the nonhuman primate impacts adrenal production of androgen and cortisol and response to ACTH in females in adulthood[J].Endocrinology,2016,157(5):1905-1913.doi:10.1210/en.2015-2087.
[7]谷伟军,王晓燕,窦京涛,等.先天性肾上腺皮质增生症的多层螺旋CT特点[J].中华内科杂志,2013,52(12):1041-1044.Gu WJ,Wang XY,Dou JT,et al.The clinical characteristics of multidetector computed tomography of congenital adrenal hyperplasia[J].Chinese Journal of Internal Medicine,2013,52(12):1041-1044.
[8]Carmina E,Dewailly D,Escobar-Morreale HF,et al.Non-classic congenital adrenal hyperplasia due to 21-hydroxylase deficiency revisited:an update with a special focus on adolescent and adult women[J].Hum Reprod Update,2017,23(5):580-599.doi:10.1093/humupd/dmx014.
[9]Else T,Auchus RJ,Miller WL.Adrenocortical carcinoma in a 17thcentury girl[J].J Steroid Biochem Mol Biol,2017,165(Pt A):109-113.doi:10.1016/j.jsbmb.2016.03.008.



