王鹏,郭狄,陈利华,章礼炜,陈海啸
破骨细胞的骨吸收和成骨细胞的骨形成之间的平衡是维持骨骼稳定的必要条件[1]。长期过量的骨吸收破坏了这种平衡,导致骨质疏松症、类风湿性关节炎[2]、人工关节无菌性松动、转移性骨肿瘤等病理性骨损失[2]。由于破骨细胞的形成和功能增强引起过度骨吸收是产生这些溶骨性病变的主要原因之一,因此通过抑制破骨细胞的形成可有效防治这些溶骨性疾病。双膦酸盐可有效抑制破骨细胞活性[3],但其使用会产生发热、骨痛、颌骨坏死[4]、不典型骨折[5]等不良反应,因此寻找新的具有抗骨丢失作用的替代药物仍然具有很大的价值。基于此,本实验通过研究灯心草对核因子(NF)-κB受体活化因子配体(RANKL)诱导破骨细胞形成的抑制作用,为寻找新型抗溶骨性疾病的药物提供依据。
1 材料与方法
1.1 实验动物 8周龄清洁级雄性C57/BL6小鼠购自上海西普尔-必凯实验动物有限公司[许可证号码:SCXK(沪)2013-0016]。
1.2 实验试剂和仪器 灯心草(提取物,粉剂)购自大连美仑生物技术有限公司;RANKL和可溶性小鼠巨噬细胞集落刺激因子(M-CSF)购自R&D公司;青链霉素、胎牛血清、α-MEM培养基均购自Hyclone公司;TRAP染色试剂盒购自Sigma公司;CCK-8检测试剂盒购自碧云天生物技术有限公司。RT-PCR所需的引物序列由生工生物工程(上海)股份有限公司合成,逆转录试剂盒购自Thermo Fisher公司。Mulitiskan FC型酶标仪、倒置荧光显微镜(Leica DMIL LED),7500实时荧光定量PCR仪(ABI StepOne plus),高速低温离心机(Thermo Fisher)。
1.3 骨髓巨噬细胞(BMMs)的获取 取8周龄雄性C57/BL6小鼠,3%戊巴比妥钠溶液腹腔注射麻醉、75%乙醇浸泡消毒,在超净台中分离取出小鼠的股骨和胫骨,PBS冲洗后更换器械,用血管钳夹住股骨和胫骨,然后用1 mL注射器在股骨胫骨两端各戳一个洞,用1 mL注射器吸取α-MEM冲洗出股骨和胫骨中的骨髓。加入含30 μg/L的M-CSF的完全培养基,5%CO2、37℃培养箱中培养48 h后,去上清液更换新鲜的完全培养基,继续培养BMMs至细胞密度达到90%。
1.4 细胞增殖实验 消化1.3中的BMMs,按照8×103个/孔接种在2块96孔板中,每板接种30个孔。培养24 h,待BMMs细胞完全贴壁后,加入含不同浓度(0、0.78、1.56、3.13、6.25、12.5、25、50、100、200 μmol/L)灯心草的完全培养基,每个浓度设置3个复孔,隔天换液1次,分别培养48 h、96 h。每孔加入CCK-8试剂10 μL,混匀后在37℃培养箱中孵育2 h,在450 nm波长处测得光密度(OD)值,并计算BMMs 48 h、96 h的半数抑制浓度(IC50)。
1.5 BMMs培养及破骨细胞分化 取8周龄雄性C57BL6小鼠,重新获取BMMs(如前所述)。消化分离后接种于96孔板中。设不同浓度(0、6.25、12.5、25 μmol/L)灯心草组,每组3个复孔,细胞密度为8×103个/孔。在30 μg/L M-CSF配成的完全培养基中培育24 h,待细胞完全贴壁后加入30 μg/L MCSF、50 μg/L RANKL和(0、6.25、12.5、25 μmol/L)灯心草配成的α-MEM培养基培养5~7 d,隔天换液1次,直到观察到成熟的破骨细胞形成。弃培养基,PBS清洗3次后,加入4%多聚甲醛固定20 min。加入TRAP染色试剂,37℃培养箱中孵育染色,直至观察到0 μmol/L灯心草组明显着色。将TRAP染色阳性且细胞核超过3个的细胞定义为破骨细胞,在40倍显微镜下观察,并记录96孔板中每孔的破骨细胞数目。
1.6 RT-PCR检测破骨细胞特异性基因的表达 消化分离1.3中的BMMs细胞,接种于6孔板中,细胞密度为1×105个/孔,细胞分组同1.5。48 h换液1次,培养4~5 d,当倒置显微镜中观察到0 μmol/L灯心草组中出现多核巨细胞时终止培养。加入1 mL TRIzol提取总RNA,测定OD260/280。取1 μg RNA 样本,1 μL Oligo(dT)18primer ,加入 ddH2O 至 12 μL,65 ℃ 反应 5 min;再 加入 4 μL 5× Reaction Buffer、1 μL RiboLock RNase Inhibitor(20 U/μL)、2 μL 10 mmol/L dNTP Mix、1 μL RevertAid M-MulV RT(200 U/μL);反应条件为42℃ 60 min,70℃ 5 min,逆转录合成cDNA,保存于-70℃的超低温冰箱中。取1 μL cDNA模板,8.5 μL ddH2O,分别为0.5 μL的上、下游引物,10 μL SYBR Green;反应条件:50 ℃ 2 min;95 ℃ 10 min;95 ℃ 15 s;60 ℃ 1 min,循环40次。并采用2-ΔΔCt法分析降钙素受体(CTR)、活化 T 细胞核因子 1(NFATC1)、空泡型H+三磷酸腺苷转运酶-d2(V-ATPased2)、空泡型H+三磷酸腺苷转运酶-a3(V-ATPase-a3)、CFOS等基因的mRNA表达水平,以GAPDH作为内参基因,重复3次。基因引物序列由生工生物工程(上海)股份有限公司合成,引物序列见表1。
1.7 统计学方法 采用SPSS 17.0统计软件进行统计分析,计量资料采用均数±标准差(±s)表示,组间比较采用单因素方差分析,组间多重比较采用SNK-q检验,2组间均数比较采用独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度灯心草对BMMs增殖的影响 CCK-8结果显示,药物浓度低于12.5 μmol/L时,灯心草对BMMs增殖无明显抑制作用,当灯心草浓度≥25 μmol/L时,其对BMMs开始有毒性作用,且随着浓度的升高,毒性作用逐渐增强,见图1。48 h和96 h时灯心草药物作用于BMMs的IC50分别为69.51 μmol/L和55.68 μmol/L。

Tab.1 Primers for RT-PCR表1RT-PCR引物序列表
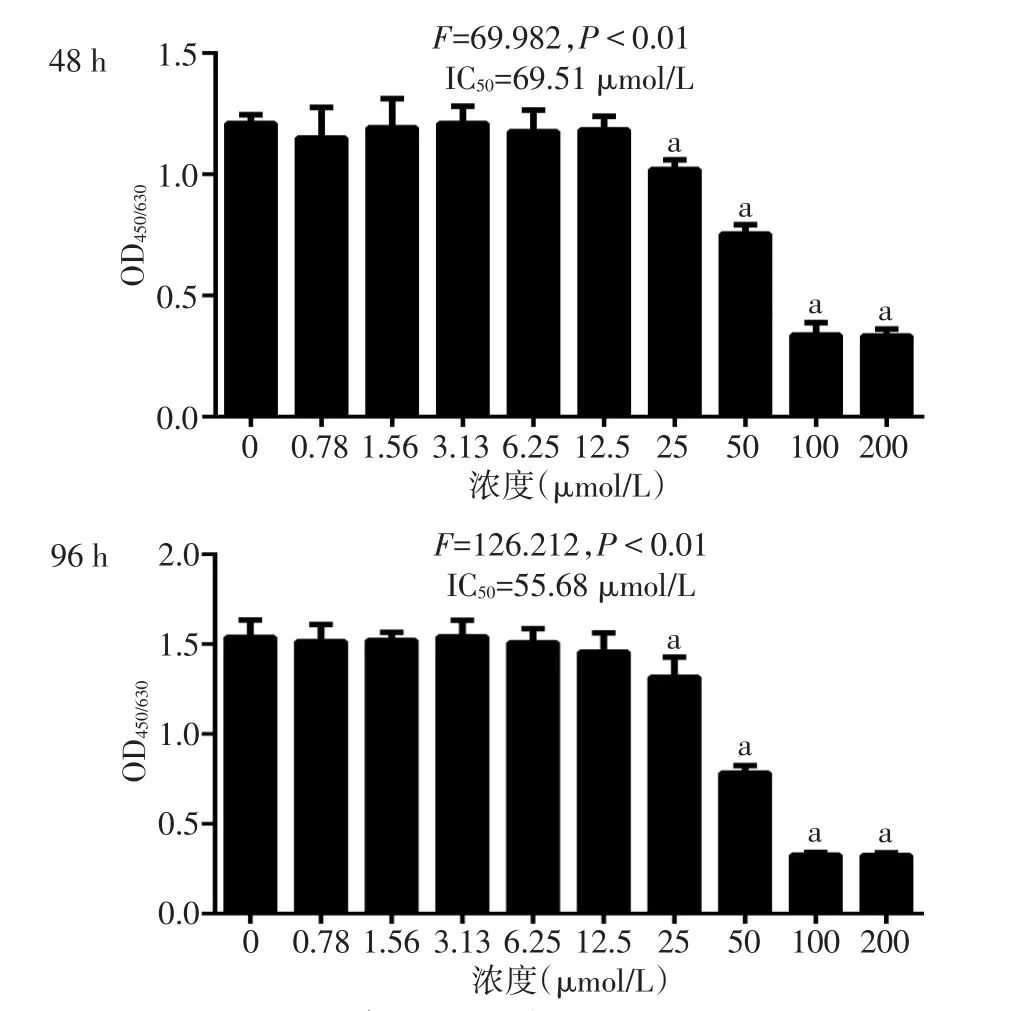
Fig.1 The effects of 0-200 μmol/L of Juncus effuses on proliferation of BMMs cells图1 不同浓度灯心草对BMMs细胞增殖的影响
2.2 不同浓度灯心草对RANKL诱导的破骨细胞形成的影响 在RANKL的刺激下,0 μmol/L灯心草组中可见BMMs形成大量的TRAP染色阳性的多核巨细胞,即成熟的破骨细胞;在不同浓度的灯心草作用下,TRAP染色阳性的多核巨细胞明显减少,并且随着药物浓度的升高,破骨细胞数目逐渐减少,见图2。
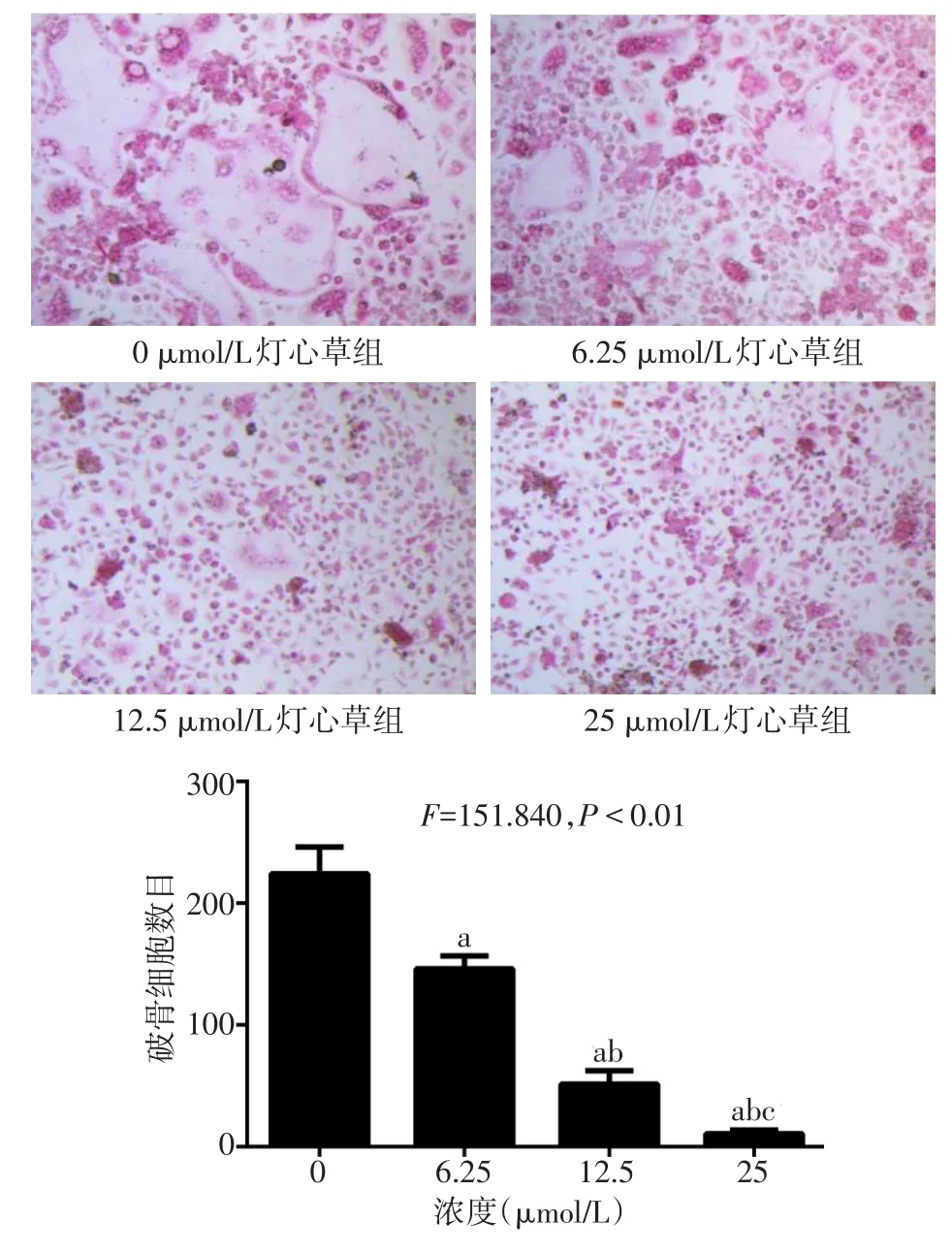
Fig.2 The effects of different concentrations of Juncus on RANKL-induced osteoclastogenesis图2 不同浓度灯心草对RANKL诱导的破骨细胞形成的影响
2.3 不同浓度灯心草对破骨细胞特异性基因表达的影响 结果显示,与0 μmol/L灯心草组相比,6.25、12.5、25 μmol/L灯心草可显着抑制破骨细胞特异性基因的表达,并且呈现一定的浓度依赖性。见图3。
3 讨论
3.1 破骨细胞增多是导致骨质疏松症的主要原因之一 骨质疏松症是一种无声的疾病,很多人直到发生骨质疏松性骨折时才发现[6]。骨质疏松性骨折严重影响患者健康,给社会带来巨大的经济负担。破骨细胞数目增加和骨吸收活性增强是导致骨质疏松症等疾病发生的主要原因[7]。研究表明,RANKL和破骨细胞表面的受体RANK结合是破骨细胞形成的重要因素[8],其相互结合后迅速激活多个不同的信号通路介导的蛋白激酶,参与破骨细胞的形成。如MAPK信号通路的活化可诱导机体产生NFATC1等转录因子[9],进而诱导破骨细胞形成[10-11]。另外,P38信号通路蛋白的磷酸化也可促进NFATC1蛋白的产生[12]。RANKL诱导的破骨细胞分化过程中会促进转录因子NFATC1的过表达,然而即使没有RANKL的刺激,NFATC1转录因子的过表达也能诱导破骨细胞的形成[7]。因此,RANKL激活NFATC1基因的过表达是促进破骨细胞分化、增强其骨吸收活性的关键因素之一[13]。有研究发现,CTR是破骨细胞上最早发现的一种受体,为破骨细胞的特征性标志之一[14]。另有研究表明,V-ATPase位于骨和破骨细胞的质膜,其作用是促进氢离子的产生,从而增强破骨细胞的骨吸收能力[15]。因此,研究药物抑制RANKL诱导的破骨细胞形成、骨吸收功能及其机制,可以为治疗骨质疏松症等溶骨性疾病提供可靠的依据。
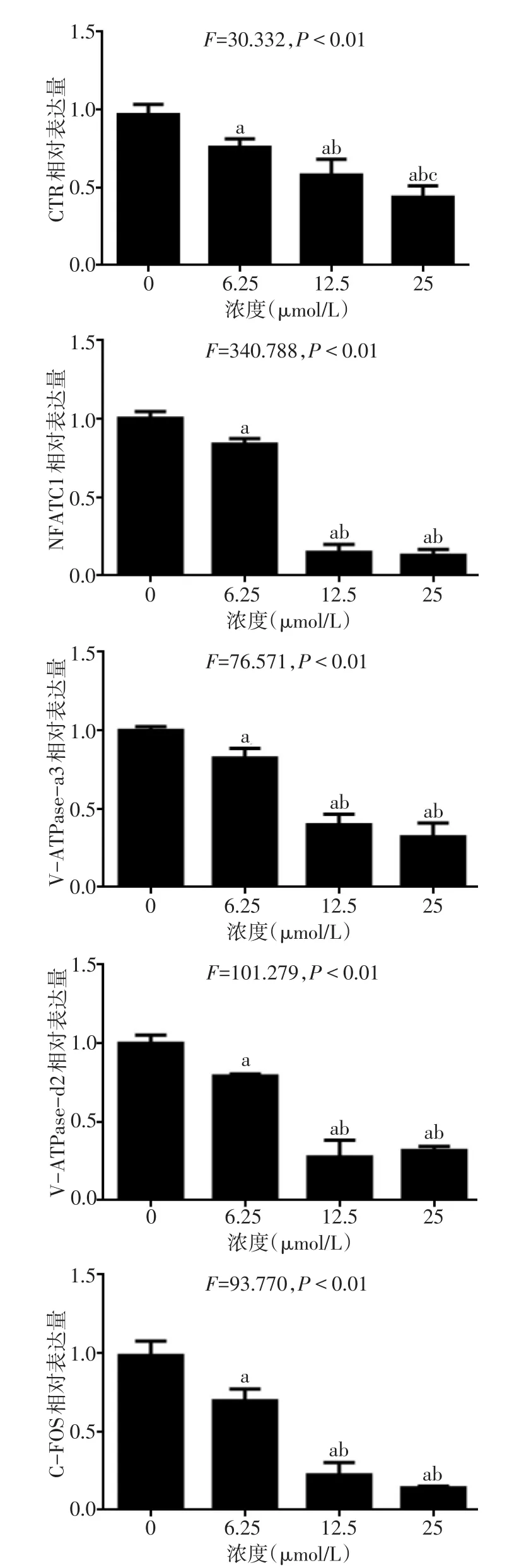
Fig.3 The effects of different concentrations of Juncus on expression levels of CTR,NFATC1,V-ATPase-a3,V-ATPase-d2 and C-FOS mRNA图3 不同浓度灯心草对破骨细胞分化过程中CTR、NFATC1、V-ATPase-a3、V-ATPase-d2及C-FOS mRNA表达的影响
3.2 灯心草对破骨细胞形成的抑制作用 我国医学发展的研究表明,中草药可以有效治疗多种慢性疾病[16]。有研究发现,灯心草提取物可以有效抑制脂多糖(Lipopolysaccharides,LPS)诱导的炎症反应,具有良好的抗炎效果[17]。本研究通过CCK-8实验筛选出灯心草对BMMs无明显毒性的浓度,用于探索其对破骨细胞分化的影响。通过记录TRAP染色阳性的多核巨细胞的数目来评价灯心草对破骨细胞形成的影响,结果显示灯心草可显着抑制破骨细胞的形成,并且呈现一定的浓度依赖性。此外,研究发现灯心草可显着抑制破骨细胞特异性基因CTR、NFATC1、V-ATPase-d2、V-ATPase-a3、C-FOS 等mRNA的表达,并且呈现了一定的浓度依赖性。由此进一步证明灯心草对破骨细胞形成的抑制作用,其机制可能是通过抑制破骨细胞形成中特异性基因的表达来实现的。
综上所述,灯心草可显着抑制破骨细胞的形成及其特异性基因的表达。本研究结果可能预示了灯心草在预防及治疗骨质疏松症、类风湿性关节炎、人工关节无菌性松动等溶骨性疾病具有潜在的价值,但其作用于破骨细胞的明确靶点和临床应用方式仍然需要进一步研究。
[1]Liu Q,Wang T,Zhou L,et al.Nitidine chloride prevents OVX-induced bone loss via suppressing NFATc1-mediated osteoclast differentiation[J].Sci Rep,2016,6:36662.doi:10.1038/srep36662.
[2]Ma J,Ma Y,Liu X,et al.Gambogic acid inhibits osteoclast formation and ovariectomy-induced osteoporosis by suppressing the JNK,p38 and Akt signalling pathways[J].Biochem J,2015,469(3):399-408.doi:10.1042/BJ20150151.
[3]Qaseem A,Snow V,Shekelle P,et al.Pharmacologic treatment of low bone density or osteoporosis to prevent fractures:a clinical practice guideline from the American College of Physicians[J].Ann Intern Med,2008,149(6):404-415.
[4]Salesi N,Pistilli R,Marcelli V,et al.Bisphosphonates and oral cavity avascular bone necrosis:a review of twelve cases[J].Anticancer Res,2006,26(4B):3111-3115.
[5] Suresh E,Pazianas M,Abrahamsen B. Safety issues with bisphosphonate therapy for osteoporosis [J]. Rheumatology(Oxford),2014,53(1):19-31. doi:10.1093/rheumatology/ket236.
[6] Pinkerton JV,Thomas S,Dalkin AC. Osteoporosis treatment and prevention for postmenopausal women: current and future therapeutic options[J]. Clin Obstet Gynecol,2013,56(4):711-721. doi:10.1097/GRF.0b013e3182a9fb02.
[7] Wang W,Wu C,Tian B,et al. The inhibition of RANKL-induced osteoclastogenesis through the suppression of p38 signaling pathwayby naringenin and attenuation of titanium-particle-induced osteolysis[J]. Int J Mol Sci,2014,15(12):21913-21934. doi:10.3390/ijms151221913.
[8]Lacey DL,Boyle WJ,Simonet WS,et al.Bench to bedside:elucidation of the OPG-RANK-RANKL pathway and the development of denosumab[J].Nat Rev Drug Discov,2012,11(5):401-419.doi:10.1038/nrd3705.
[9]Zwerina J,Hayer S,Redlich K,et al.Activation of p38 MAPK is a key step in tumor necrosis factor-mediated inflammatory bone destruction[J].Arthritis Rheum,2006,54(2):463-472.doi:10.1002/art.21626.
[10]Strait K,Li Y,Dillehay DL,et al.Suppression of NF-kappaB activation blocks osteoclastic bone resorption during estrogen deficiency[J].Int J Mol Med,2008,21(4):521-525.doi:10.3892/ijmm.21.4.521.
[11]Meissner JD,Freund R,Krone D,et al.Extracellular signalregulated kinase 1/2-mediated phosphorylation of p300 enhances myosin heavy chain I/beta gene expression via acetylation of nuclear factor of activated T cells c1[J].Nucleic Acids Res,2011,39(14):5907-5925.doi:10.1093/nar/gkr162.
[12]Choi J,Choi SY,Lee SY,et al.Caffeine enhances osteoclast differentiation and maturation through p38 MAP kinase/Mitf and DC-STAMP/CtsK and TRAP pathway[J].Cell Signal,2013,25(5):1222-1227.doi:10.1016/j.cellsig.2013.02.015.
[13]Ikeda F,Nishimura R,Matsubara T,et al.Critical roles of c-Jun signaling in regulation of NFAT family and RANKL-regulated osteoclast differentiation[J].J Clin Invest,2004,114(4):475-484.doi:10.1172/JCI19657.
[14]Jiao Z,Xu W,Zheng J,et al.Kaempferide prevents titanium particle induced osteolysis by suppressing JNK activation during osteoclast formation[J].Sci Rep,2017,7(1):16665.doi:10.1038/s41598-017-16853-w.
[15]Costa-Rodrigues J,Reis S,Teixeira S,et al.Dose-dependent inhibitory effects of proton pump inhibitors on human osteoclastic and osteoblastic cell activity[J].FEBS J,2013,280(20):5052-5064.doi:10.1111/febs.12478.
[16]Jiang M,Zhang C,Cao H,et al.The role of Chinese medicine in the treatment of chronic diseases in China[J].Planta Med,2011,77(9):873-881.doi:10.1055/s-0030-1270983.
[17]Park NY,Kim SG,Park HH,et al.Anti-inflammatory effects of Juncus effusus extract(JEE)on LPS-stimulated RAW 264.7 cells and edema models[J].Pharm Biol,2016,54(2):243-250.doi:10.3109/13880209.2015.1029053.



