阙克华,王瑜,刘洁,刘杨秋,文静
人成牙本质细胞(human odontoblasts,HODs)是牙髓组织中十分特殊且生物学功能复杂多样的细胞,在牙髓防御外界伤害性刺激和组织修复中发挥重要作用。近年来研究发现,HODs是潜在的感知外部刺激和牙髓微循环中瞬态变化的重要细胞之一[1]。瞬时感受器电位(transient receptor potential,TRP)通道蛋白在人体感受外界各种刺激,包括温度、酸、渗透压和机械刺激等方面发挥重要作用。瞬时感受器电位香草酸受体2(transient receptor potential vanilloid 2,TRPV2)离子通道是TRP亚家族成员之一,在组织中分布广泛,参与机体感受温度、渗透压和机械刺激等多种生理功能[2]。课题组前期实验已经证实TRPV2 在牙髓组织细胞中的表达[3]。但目前对TRPV2 离子通道在人牙髓组织中炎症相关的作用机制研究尚较缺乏,特别是炎症因子对HODs样细胞TRPV2影响的研究少见报道。有研究报道肿瘤坏死因子α(tumor necrosis factor-alpha,TNF-α)在早期牙髓炎症发展过程中较其他炎症因子具有更高的检出率。因此,本研究通过观察TNF-α 调控 HODs 样细胞 TRPV2 离子通道表达水平,进一步探讨TRPV2 离子通道在牙髓组织中的机制及生理功能。
1 材料与方法
1.1 样本选择 收集2016年9月—2017年1月在天津医科大学口腔医院口腔颌面外科门诊因阻生、正畸等原因而预防性拔除的健康完整第三磨牙共20 颗。患者年龄18~25 岁,无全身系统性疾病,牙髓组织健康,无龋坏、牙周炎和牙髓炎表现。所有实验用牙齿经过患者知情同意,本研究通过了天津医科大学口腔医院伦理委员会审查(批准号TMUSHh-MEC2014010)。
1.2 主要材料及仪器 小鼠抗人涎磷蛋白(DSPP)单克隆抗体、兔抗人nestin 多克隆抗体均购自美国Santa Cruz 公司;兔抗人TRPV2抗体购自美国Pro Sci公司;胎牛血清购自中国四季青公司;β-甘油磷酸钠、M-MLV 逆转录酶、高速离心机均购自美国Sigma 公司;TNF-α 购自美国 Novus Bio;肿瘤坏死因子受体1(TNF receptors 1,TNFR1)拮抗剂R-7050 购自英国 Tocris Bioscience 公司;细胞固定/破膜试剂盒、PCR 电泳仪、FACSCanto Ⅱ均购自美国BD公司;Olympus DP72型光学显微镜购自日本Olympus公司。
1.3 方法
1.3.1 HODs 样细胞的培养与鉴定 无菌条件下劈开牙齿,取出牙髓,剪刀去除根尖端约2 mm部分,用含双抗的PBS漂洗3 遍。湿润条件下将牙髓剪碎至0.5~1.0 mm3。加入1.5 mL 培养基,吹打均匀后接种到T25 培养瓶中,培养基为含10%的胎牛血清、2 mmol/L β-甘油磷酸钠、2 mmol/L L-谷氨酰胺、100 U/mL青霉素、100 mg/L链霉素和0.25 g/L两性霉素B的DMEM培养基,置入37 ℃5%CO2恒温培养箱中孵育,2~4 d 进行换液。在细胞显微镜下观察,直至组织周围有呈现成纤维细胞样形态的细胞爬出。待细胞长满后进行传代,选取第4~6代细胞进行实验。将细胞接种于60 mm平皿中,用含10%胎牛血清、50 g/L 维生素C、10 mmol/L β-甘油磷酸钠的DMEM 矿化液培养。待出现细胞结节后进行von Kossa 染色。另取细胞制成单细胞悬液,接种至12孔板,放置培养箱培养,PBS 洗涤3 次,4%多聚甲醛室温固定15 min。对细胞进行DSPP 和nestin 免疫荧光(immunofluorescence,IF)染色,一抗使用小鼠多克隆抗体DSPP(DSPP∶PBS=1∶200)和nestin(nestin∶PBS=1∶200),二抗使用异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的山羊抗小鼠 IgG(FITC∶PBS=1∶200~1∶400)。阴性对照组使用PBS 替代一抗,其余条件一致。使用Olympus DP72型光学显微镜及照相系统进行拍照,传代及诱导通过免疫荧光鉴定成为HODs 样细胞后冻存,后续实验随用随取。
1.3.2 IF 染色检测TRPV2 在HODs 样细胞中的表达 将细胞接种到载玻片上,室温下在4%多聚甲醛中固定15 min。用1%Triton X-100 渗透5 min 后,用10%山羊血清在37 ℃封闭非特异性结合位点2 h。将载玻片滴加一抗兔多克隆抗体TRPV2(稀释度1∶200),4 ℃下孵育过夜。洗净后,滴加二抗(山羊多克隆抗鼠IgG-FITC)37 ℃下孵育30 min。细胞核用4'-6-二脒基-2-苯基吲哚在室温下复染8 min,用抗荧光衰减封片剂滴在载玻片上封片,然后通过直立荧光显微镜观察。
1.3.3 实时荧光定量聚合酶链反应(RT-qPCR)检测TNF-α对TRPV2 离子通道mRNA 表达的影响 将细胞分别在含有0、1、10 μg/L TNF-α的培养基中培养24 h后,按照Trizol试剂使用说明,从细胞中提取总RNA。使用M-MLV 逆转录酶将纯化的总RNA 逆转录成cDNA。在ABI-7500 实时PCR 仪中进行实时定量 PCR 扩增,反应条件:95 ℃ 10 s,60 ℃ 34 s,40个循环。选择甘油醛-3-磷酸脱氢酶(GAPDH)作为管家基因使相对表达水平标准化。使用Opticon Monitor Analysis Software V 2.02(MJ Research)进行分析。TRPV2 引物:上游5'-TAGAGAATGGAGCGAATGTT-3',下游 5'-TCATACATGTGGATCACCAG-3',产物大小327 bp。GAPDH 引物:上游5'-GGAGGTGAAGGTCGGAGTC-3',下游5'-GAAGATGGTGATGGGATTTC-3',产物大小226 bp。另取细胞进行TNFR1拮抗剂 R-7050 的相关实验,在10 μg/L TNF-α 处理 24 h 前,用 5 μmol/L R-7050 处理细胞 2 h,阴性对照组无 R-7050 处理,再用上述方法进行检测,每组实验重复3次。
1.3.4 蛋白质印迹法(Western Blot,WB)分析 TNF-α 对TRPV2 离子通道蛋白表达的影响 将细胞分别在含有0、1和 10 μg/L TNF-α 的培养基中培养 24 h 后,预冷 PBS 冲洗细胞,洗净液体后加入含苯甲基磺酰氟的RIPA 裂解液(RIPA=1∶100,现配现用),加入量为细胞体积的4 倍,使细胞裂解。二喹啉甲酸测定法测定总蛋白质浓度。通过12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白质并转移至聚偏二氟乙烯(PVDF)膜。用5%脱脂牛奶封闭1 h,然后依次用相应的一抗和二抗,并用电化学发光免疫(ECL)系统成像。另取细胞进行R-7050 的相关实验,在10 μg/L TNF-α 处理24 h 前,用 5 μmol/L R-7050 处理细胞2 h,阴性对照组无R-7050处理,再用上述方法进行检测,每组实验重复3次。
1.3.5 流式细胞术(FCM)检测TNF-α 对TRPV2离子通道表达的影响 将细胞分别在含有0和10 μg/L TNF-α的培养基中培养24 h 后,按照细胞固定/破膜试剂盒说明配制反应体系并设置反应条件。将细胞悬浮液置于Cytofix/Cytoperm 溶液中,于4 ℃孵育20 min,滴加TRPV2 抗体(稀释度1∶200),4 ℃孵育2 h,滴加 Alexa Fluor 488 标记的针对兔 IgG 的山羊多克隆抗体,使用FACS Canto Ⅱ进行检测,通过FlowJo 程序分析数据。
1.4 统计学方法 采用SPSS 16.0统计软件对结果数据进行统计学分析。符合正态分布计量资料采用均数±标准差(±s)表示,2 组间比较采用t检验,多组间比较采用方差分析,组间多重比较采用Dunnett-t法。检验水准为双侧α=0.05。
2 结果
2.1 HODs 样细胞的鉴定 经矿化液培养诱导后,肉眼可见白色点状物,倒置显微镜下细胞呈复层生长,有白色团块,von Kossa 染色显示其中央区为深褐色,见图1。通过免疫荧光染色确定DSPP 与nestin 呈阳性表达,且主要位于细胞核和细胞浆,见图2。确定本实验分离培养的细胞为HODs样细胞。
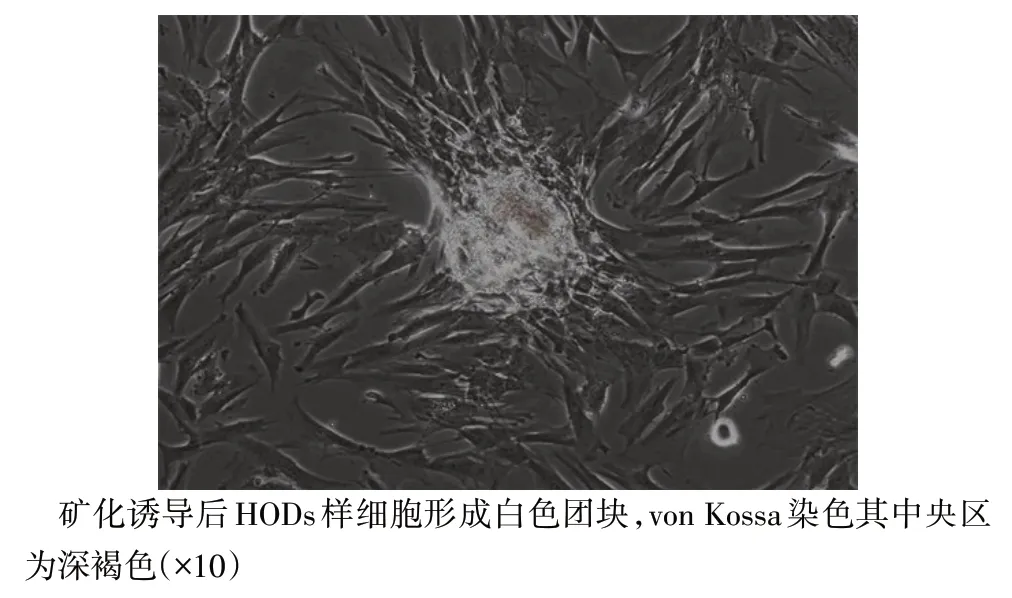
Fig.1 The expression of HODs-like cells induced by mineralization solution图1 HODs样细胞经矿化液诱导后的表现
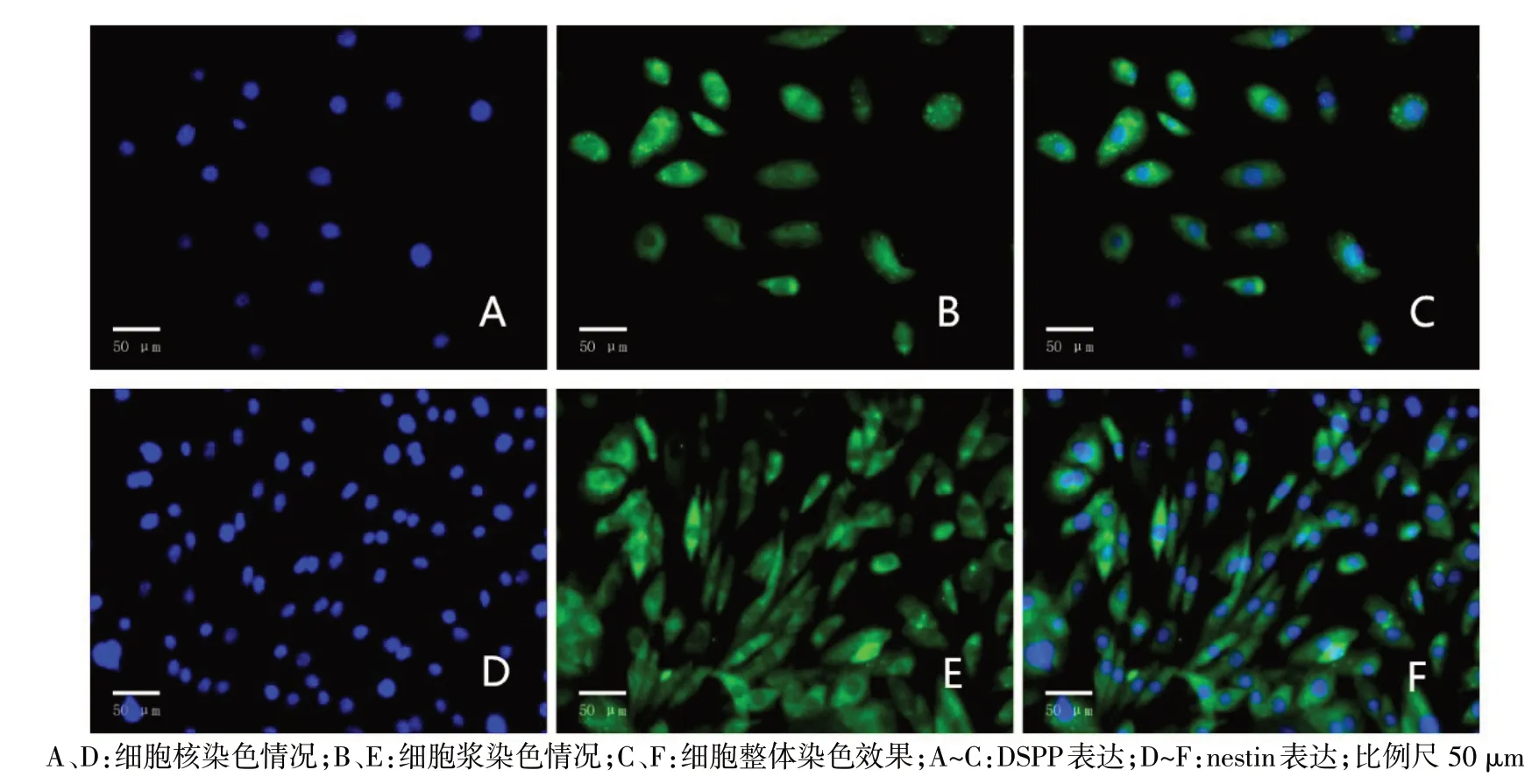
Fig.2 The expression of immunofluorescent of cellular DSPP and nestin(×200)图2 细胞DSPP和nestin免疫荧光染色结果(×200)
2.2 TRPV2离子通道在HODs样细胞中的表达 免疫荧光染色结果显示,TRPV2 离子通道几乎在所有细胞呈阳性表达,主要表达于细胞核、细胞浆和细胞膜上,见图3。
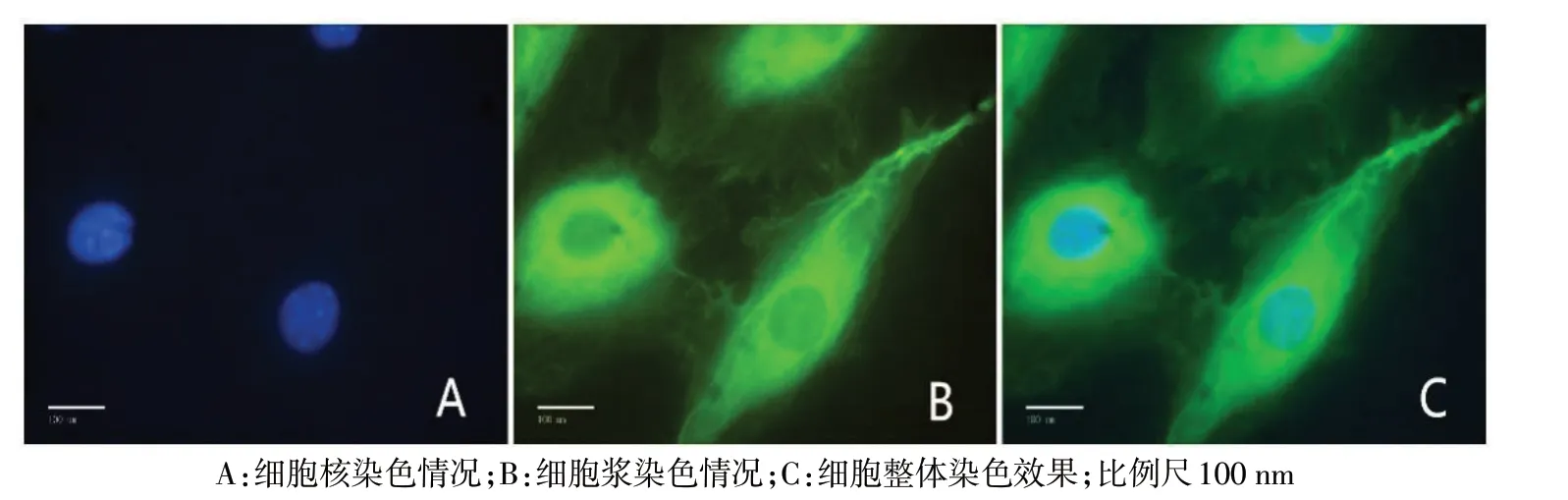
Fig.3 Results of the expression levels of TRPV2 ion channel in HODs-like cells observed by optical microscope(IF staining,×400)图3 光学显微镜下观察TRPV2离子通道在HODs样细胞中的表达(免疫荧光染色,×400)
2.3 TNF-α 影响TRPV2 离子通道表达水平 RT-qPCR 和 WB 检测结果显示,与对照组相比,1 μg/L TNF-α 对 TRPV2 通道的 mRNA 和蛋白质表达无明显影响(P>0.05),而10 μg/L TNF-α 可导致TRPV2通道的mRNA 和蛋白质表达水平明显上调(P<0.05),见图4。
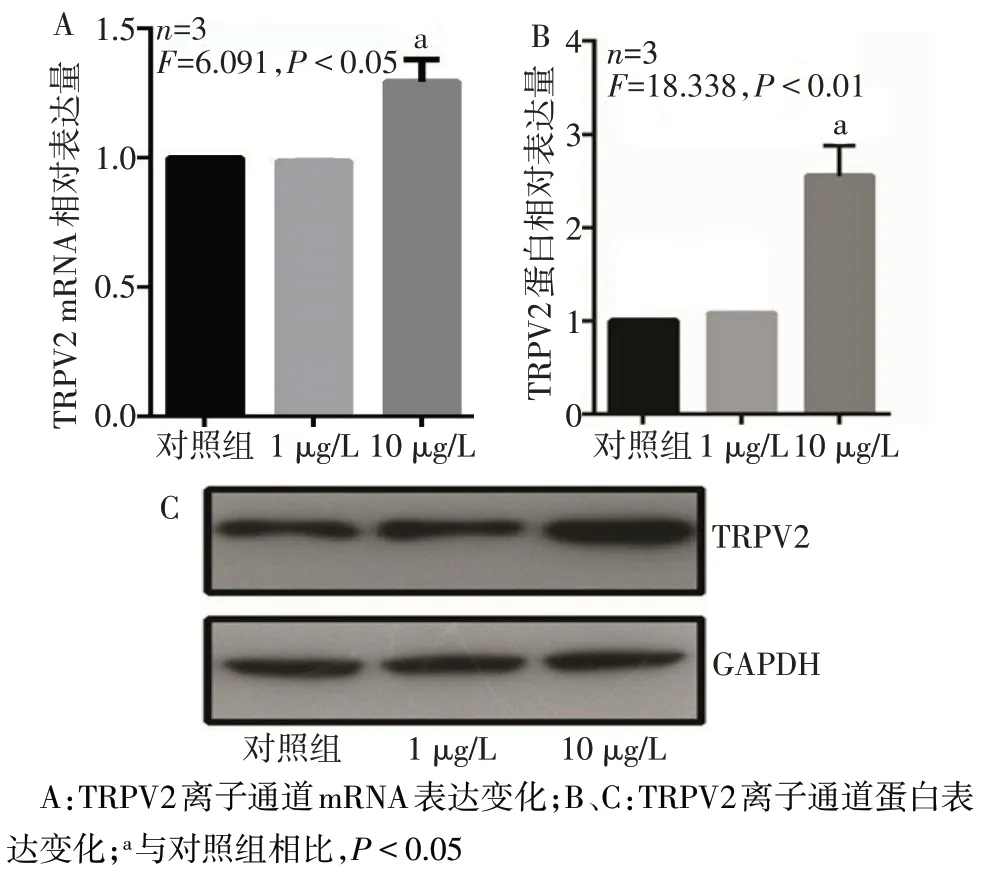
Fig.4 Effects of TNF-α with different concentrations on the expression of HODs-like cells图4 不同浓度TNF-α处理对HODs样细胞的影响
2.4 TNF-α 对 HODs 样细胞中 TRPV2 通道蛋白的作用 与对照组(18.7%)相比,加入TNF-α 处理24 h后,TRPV2通道阳性染色细胞数目(69.4%)显着增加,见图5。
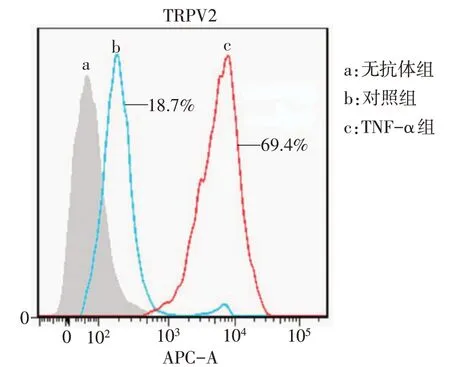
Fig.5 Results of flow cytometry for the effect of TNF-α on the expression of TRPV2 ion channel图5 流式细胞术检测TNF-α对TRPV2离子通道表达的影响
2.5 TNFRs 在 TNF-α 调控TRPV2通道中的作用 RT-qPCR和WB测定结果显示,10 μg/L TNF-α可明显上调TRPV2 通道的mRNA 和蛋白质表达水平,而这种上调作用可以被R-7050抑制。甚至在使用R-7050后,TRPV2通道的mRNA和蛋白质表达水平低于对照组(P<0.05),见图6。
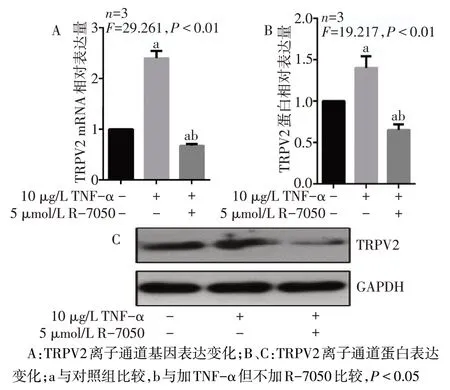
Fig.6 Gene and protein expressions of TRPV2 channel in HODs-like cells treated with TNF-α图6 TNF-α处理HODs样细胞TRPV2通道的基因和蛋白质表达
3 讨论
3.1 TRPV2 离子通道的作用及存在部位 TRPV2离子通道是TRPV 亚家族成员之一,也是人体重要的感受器之一,可被较高的热刺激激活(>52 ℃),提示其可能作为一种高阈值热伤害性感受体存在[4]。最近有研究报道,TRPV2 离子通道还可以感受低渗透压、机械刺激以及化学刺激等[5-6]。TRPV2离子通道在组织中分布广泛,主要在感觉神经元中表达,也存在于血管平滑肌、脾、胰腺等其他组织。目前研究认为其在不同组织细胞中可能发挥不同的作用,特别是与疼痛和免疫反应密切相关。由于HODs的极性细胞突起紧密嵌入牙本质小管中,很难从牙髓中分离出完整的、生物活性高的HODs,而HODs 属于高度特异的终末分化细胞,常规体外条件下尚无法进行培养增殖。因此诱导牙髓干细胞形成的HODs样细胞被广泛用于代替正常HODs 细胞用于科研。本研究通过诱导体外培养的人牙髓组织细胞,获得在形态和功能上与体内HODs相似的HODs样细胞,且表达HODs 相关的特异性蛋白,如DSPP 和nestin等。同时,在矿化液的诱导下,细胞呈复层生长并可形成矿化结节,进一步证实该细胞具有形成牙本质的能力[7],这也是目前研究HODs样细胞常用的方法。
3.2 不同浓度TNF-α 对TRPV2 通道基因和蛋白质表达水平的影响 研究显示,在深龋近髓的牙本质中或中早期牙髓炎症的牙髓中TNF-α 检出率很高[8]。因此本研究采用TNF-α作为刺激因子作用于TRPV2蛋白,且选择了1 μg/L和10 μg/L 2个不同浓度代表不同的炎症程度,从而用来推测TRPV2蛋白在炎症相关牙体牙髓疾病中可能的功能。本研究首先通过免疫荧光染色证实TRPV2 蛋白在建立的HODs样细胞模型中表达,继而用3种分子生物学方法从不同角度进一步证实TNF-α 能够明显上调HODs 样细胞中TRPV2 通道mRNA 和蛋白表达水平。通过RT-qPCR 和WB 对比不使用和分别使用低、高浓度的TNF-α 时TRPV2通道基因和蛋白质的表达水平变化,结果证实高浓度TNF-α能够明显上调HODs样细胞中TRPV2通道的基因和蛋白表达水平,而低浓度TNF-α对TRPV2通道基因和蛋白质的表达无明显影响。流式细胞术结果也充分表明,TNF-α 处理后TRPV2 通道蛋白阳性表达的细胞数量明显增多,亦证明了TNF-α对TRPV2通道蛋白表达的增强作用。以上实验结果提示,在一些牙体组织或牙髓疾病,如深龋或早期牙髓炎症中TRPV2通道表达可能会明显上调,从而介导HODs 对外界反应增强。而TRPV2通道对低、高浓度TNF-α表现的不同反应可解释为TRPV2 通道的活性可能与炎症程度有关,炎症程度越重,TRPV2 通道的活性越高,对外界刺激的反应越强。这一点与临床症状也相符合,即在深龋或可复性牙髓炎情况下,牙髓组织对外界的温度或机械等刺激的反应明显增强,导致疼痛难以忍受,本研究结果表明,TRPV2可能参与了这一复杂过程。
3.3 R-7050 对TRPV2 通道基因和蛋白表达的影响 TNF-α 主要通过细胞膜上的多种TNFRs 发挥生物效应[9]。TNF-α与细胞表面的TNFRs结合进而激活下游信号通路,表现特异性促炎反应,其中最常见的是TNFR1和TNFR2。R-7050是TNFR1信号传导的特异性抑制剂,不影响TNF-α与TNFR结合,而是通过阻断TNFR1 与细胞内衔接分子的结合从而抑制TNF-α 激活MAPK 信号通路。本研究中,RT-qPCR 和 WB 均显示 R-7050 明显抑制了 TNF-α 对TRPV2通道基因和蛋白表达的上调,表明TNFR1可能在该过程中起主导作用。然而,在加入R-7050后,TRPV2 通道基因和蛋白质表达水平却低于不使用R-7050 的对照组,具体原因仍不明确,我们推测R-7050可能通过与TNFR无关的脱靶效应而发挥某些保护作用[10]。
综上所述,TNF-α 作为在深龋和早期牙髓炎症组织中常见的炎症因子,在牙髓组织炎症发生发展过程中有重要作用,本研究结果显示其能够明显上调成HODs 样细胞中TRPV2 离子通道表达水平,提示TNF-α可能通过调控类似TRPV通道表达水平来改变牙髓组织对外界刺激反应程度,从而有助于更深入地了解牙髓疼痛感觉传导机制。



