肖黄满,尚海涛,张静宇,郝成飞,刘军舰,陈帅,张景虹,李忠廉△
梗阻性黄疸(obstructive jaundice,OJ)是由多种原因(如结石、肿瘤等)引起的胆管阻塞,出现皮肤、巩膜进行性黄染伴小便发黄,可导致肝脏以及全身各系统一系列病理改变[1]。OJ可诱发胆汁淤积性肝损害,炎性细胞因子和游离氧自由基释放,加剧肝损伤[2]。c-Jun氨基末端激酶(JNK)是丝裂原活化蛋白激酶(MAPK)超家族的关键成员。研究表明,JNK信号蛋白与细胞凋亡过程密切相关[3]。Bcl-2是Bcl-2蛋白家族成员,可在凋亡的线粒体途径中发挥重要作用。内质网应激(endoplasmic reticulum stress,ERS)常在细胞凋亡时发生,其影响下游包括C/EBP同源蛋白(CHOP)、细胞凋亡信号调节激酶1(ASK1)、JNK和Bcl-2等蛋白的表达,参与调控细胞凋亡。加味大柴胡汤(MMDB)是在经典方剂大柴胡汤(柴胡、黄芩、大黄、枳实、白芍、半夏、生姜)的基础上加入茵陈、金钱草而成,已被证实能减轻OJ 大鼠中内毒素所造成的肝损伤,下调瞬时受体电位通道(TRPC1)蛋白的表达,减轻钙超载[4]。但加味大柴胡汤对肝细胞凋亡中内质网应激机制是否有影响,特别是与JNK、Bcl-2信号蛋白的关系尚不明确。本研究通过加味大柴胡汤对OJ大鼠的干预,观察大鼠肝功能及JNK、Bcl-2 信号蛋白的变化,进一步探讨加味大柴胡汤对OJ 大鼠的影响,以期为OJ 肝损伤围手术期的治疗提供新途径。
1 材料与方法
1.1 实验材料 健康SPF级雄性SD大鼠90只,体质量220~260 g,购于解放军军事医学科学院卫生学环境医学研究所,饲养于干燥、通风环境下,自由进食、饮水。中药饮片购于天津市南开医院中药房,具体如下:柴胡15 g、黄芩10 g、大黄8 g、枳实10 g、白芍10 g、半夏10 g、生姜10 g、大枣10 g、茵陈25 g、金钱草15 g,每日1 剂,水煎 100 mL,所得 MMDB 含生药量1 g/mL。丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)和血清总胆红素(TBIL)试剂盒购自国药生物化学研究所;兔源JNK、Bcl-2和β-actin一抗购于天津博诚科技公司;辣根过氧化酶(HRP)标记的羊抗兔IgG 二抗购于美国Sigma 公司;其余常规试剂为国产分析纯级别。TG16KR型低温离心机购于长沙东旺实验仪器有限公司;倒置相差显微镜购于日本Olympus 公司;JS-680D 型电泳、电转、成像系统购于南京创睿仪器公司;VeritiFAST 型荧光定量PCR仪购于美国Thermo Fisher Scientific公司。
1.2 方法
1.2.1 实验动物模型建立及分组 将90 只健康成年SPF 级雄性大鼠编号,按照随机数字表法分为假手术组(S 组)、OJ组(O组)和干预组(M组),每组30只。O组和M组均采用胆总管双重结扎及离断建立大鼠OJ 模型,实验大鼠术前12 h禁食水,采取异氟烷吸入麻醉,经腹正中沿剑突下切口进腹,牵拉十二指肠分离出胆总管,双重结扎后离断。S 组仅从相同部位入腹探查,游离胆总管并不予以结扎。S 组和O 组每日定时给予生理盐水(10 μL/g)灌胃,M组在上述相同时间点给予加味大柴胡汤(10 μL/g)每日1次连续灌胃。于术后3 d、7 d、10 d,每组每次分别随机取10只大鼠,采取异氟烷吸入麻醉,沿腹部正中进入腹腔,使用5 mL 注射器抽取腹主动脉血,离心后备用;充分显露肝脏,剪开镰状韧带至下腔静脉前方,挤出大鼠肝脏。根据自然肝裂,取部分右肝下叶组织置于EP管中备用。
1.2.2 血清学分析 从大鼠腹主动脉血收集血液标本静置30 min 后3 000 r/min 离心10 min,用相应试剂盒检测AST、ALT、TBIL水平。
1.2.3 实时荧光定量PCR(qPCR)检测肝组织中JNK、Bcl-2mRNA水平 以TRIzol一步法提取各组大鼠肝脏组织中的总RNA,除杂质后反转录为 cDNA,37 ℃ 50 min,85 ℃ 6 min,4 ℃ 6 min,-20 ℃保存。qPCR反应体系为:SYBR Green Mix 10 μL,上游及下游引物各1 μL,ROXⅡ校准液0.4 μL,ddH2O 6.6 μL,cDNA 模板 1 μL,总体积为 20 μL。qPCR 条件为:95 ℃预变性10 min;95 ℃变性 15 s,60 ℃退火35 s,72 ℃延伸30 s,共50个循环。每组设置3个复孔。本实验重复3次,以2-ΔΔCt法计算各目的基因的表达量,扩展引物序列见表1。
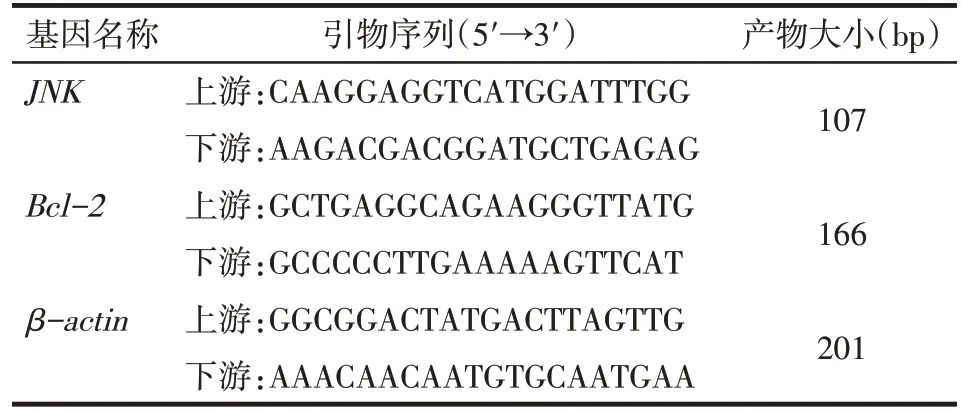
Tab.1 Primer sequence of real time PCR表1 实时定量PCR引物序列
1.2.4 免疫印迹法(Western blot)检测肝组织中JNK、Bcl-2蛋白的表达 液氮研磨-80 ℃下保存的肝组织50 mg,加入1 mL RIPA裂解液(含蛋白酶抑制剂),置于冰上裂解25 min,13 000 r/min离心30 min,吸上清液,测定样品蛋白浓度,加入SDS-loading buffer,100 ℃金属浴10 min,每孔上样20 μg,进行电泳分析,转膜,封闭,加入JNK(1∶800)、Bcl-2(1∶2 000)和β-actin(1∶10 000)一抗4 ℃孵育过夜;TBST 洗膜,加入HRP标记的羊抗兔IgG二抗(1∶8 000)孵育1 h,洗膜,显色液孵育2 min,成像仪上进行信号检测,分析条带。数码凝胶图像分析系统检测蛋白阳性表达情况,计算比较各组蛋白表达量。
1.3 统计学方法 使用GraphPad Prism 5 软件进行统计分析,计量资料以均数±标准差()表示,多组间比较采用单因素方差分析,组间多重比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠一般情况 S组大鼠术后第2天大致恢复自主活动及饮食,反应迅捷,耳朵、皮肤、尿液颜色正常;术后第3天解剖,可见大鼠腹腔手术区域轻度粘连,肝脏质地软,表面光滑;与术后7 d、10 d 解剖情况相比,未见明显差异。O组大鼠术后第2天出现尾尖及耳缘黄染,精神状态恢复较S组慢,活动能力差;可见大鼠尿液颜色变黄,食量及活动差;术后第3 天解剖大鼠见腹腔粘连较重,肝脏黄染明显伴轻度肿大,结扎处近上部可见胆总管呈半透明囊状扩张。M组大鼠术后第3天出现尾尖及耳缘轻度黄染,精神状态恢复较慢,尿液颜色加深,食量及活动稍差;术后第3天解剖大鼠见腹腔粘连,肝脏黄染明显伴轻度肿大,被膜紧张,胆总管扩张,与术后7 d、10 d解剖情况相比,上述现象加重。
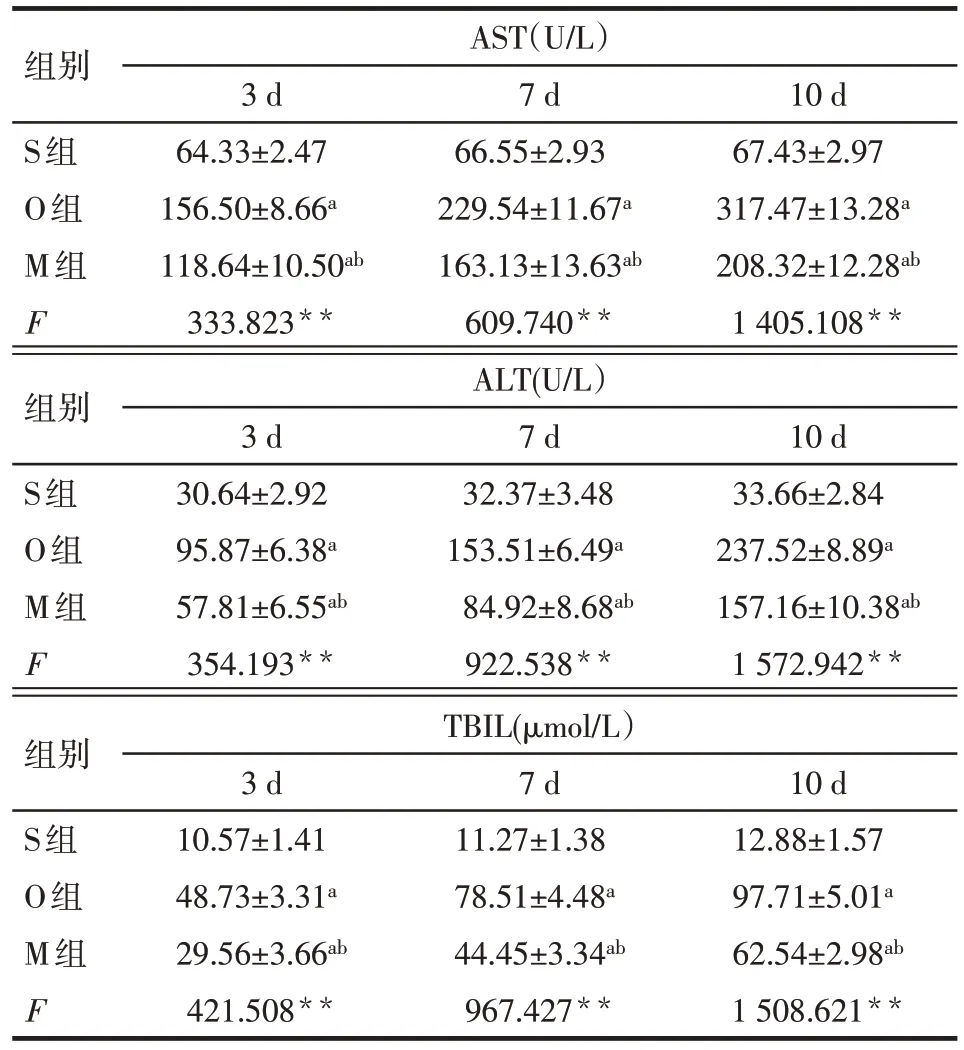
2.2 各组大鼠血清AST、ALT、TBIL 水平比较 与S组同期比较,O 组及 M 组大鼠血清 AST、ALT、TBIL水平均升高(P<0.05);与O 组同期比较,M 组AST、ALT、TBIL水平均降低(P<0.05),见表2。
Tab.2 Serum AST,ALT and TBIL contents in three groups of rats表2 各组大鼠血清AST、ALT、TBIL水平 (n=10,)
Tab.2 Serum AST,ALT and TBIL contents in three groups of rats表2 各组大鼠血清AST、ALT、TBIL水平 (n=10,)
**P<0.01;a与S组比较,b与O组比较,P<0.05
组别S组O组M组F AST(U/L)3 d 64.33±2.47 156.50±8.66a 118.64±10.50ab 333.823**7 d 66.55±2.93 229.54±11.67a 163.13±13.63ab 609.740**10 d 67.43±2.97 317.47±13.28a 208.32±12.28ab 1 405.108**组别S组O组M组F ALT(U/L)3 d 30.64±2.92 95.87±6.38a 57.81±6.55ab 354.193**7 d 32.37±3.48 153.51±6.49a 84.92±8.68ab 922.538**10 d 33.66±2.84 237.52±8.89a 157.16±10.38ab 1 572.942**组别S组O组M组F TBIL(μmol/L)3 d 10.57±1.41 48.73±3.31a 29.56±3.66ab 421.508**7 d 11.27±1.38 78.51±4.48a 44.45±3.34ab 967.427**10 d 12.88±1.57 97.71±5.01a 62.54±2.98ab 1 508.621**
2.3 各组肝组织中JNK、Bcl-2mRNA 水平比较 O组、M组JNKmRNA水平均高于同期S组(P<0.05);M组JNKmRNA水平在同期均低于O组(P<0.05);O组、M组Bcl-2mRNA水平均低于S组(P<0.05);M组Bcl-2mRNA水平在同期均高于O组(P<0.05),见图1。
2.4 各组肝组织中JNK、Bcl-2 蛋白的表达水平比较 O 组、M 组JNK 蛋白表达水平在各时间点均高于S 组(P<0.05);M 组JNK 蛋白表达水平在各时间点均低于O 组(P<0.05);O 组、M 组Bcl-2 蛋白表达水平在各时间点均低于S 组(P<0.05);M 组Bcl-2蛋白表达水平在各时间点均高于O 组(P<0.05),见图2、3。
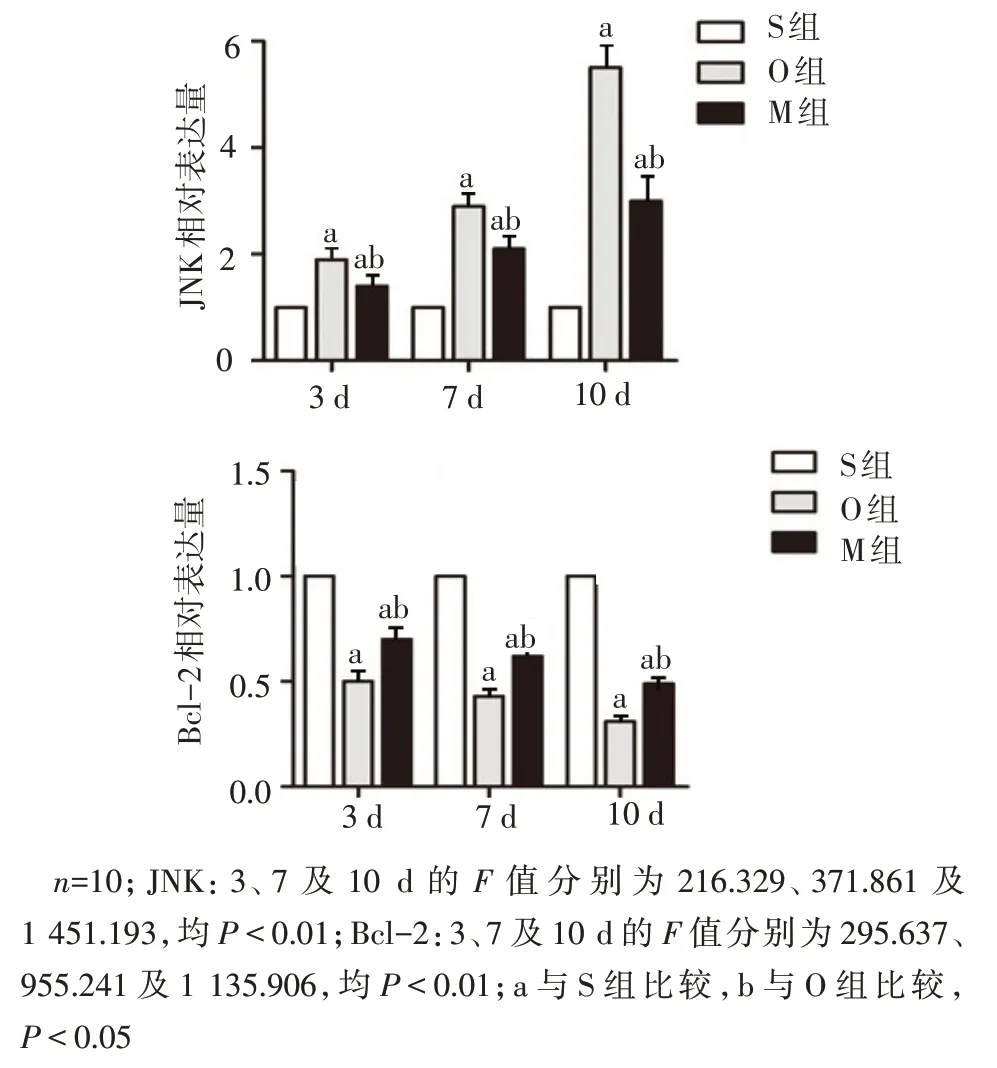
Fig.1 The mRNA expressions of JNK and Bcl-2 in liver tissue of rats in each group图1 各组大鼠肝组织JNK、Bcl-2 mRNA表达水平
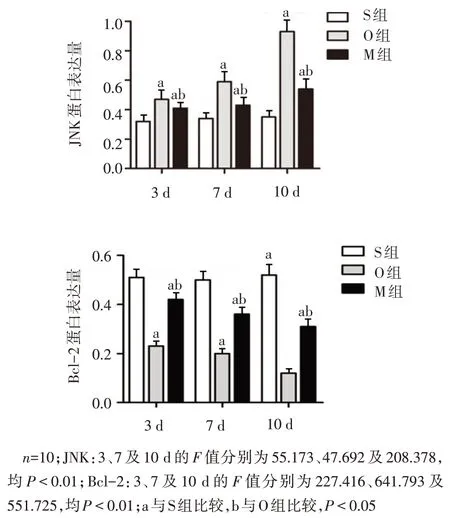
Fig.2 The protein expressions of JNK and Bcl-2 in liver tissue of rats in each group图2 各组大鼠肝组织JNK、Bcl-2蛋白表达水平
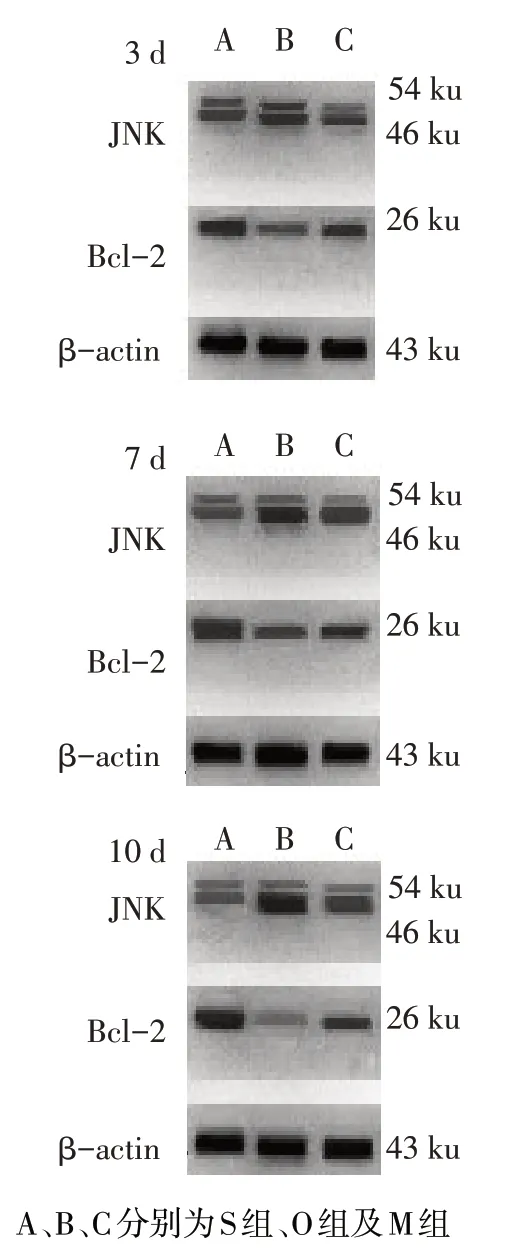
Fig.3 The expression levels of JNK and Bcl-2 in each group图3 各组大鼠肝组织JNK、Bcl-2蛋白表达水平
3 讨论
大柴胡汤是临床上常用方剂之一,由柴胡、黄芩、大黄、枳实、白芍、半夏、生姜、大枣八味药组成。在大柴胡汤中加味茵陈及金钱草,增加了利湿退黄的功效,既可疏利肝胆之气滞,又可荡涤肠胃之实热[5]。黄疸病名首见于《黄帝内经》:“面色微黄,齿垢黄,爪甲上黄,黄疸也”[6]。其病因病机为:饮食无节或过量饮酒,或嗜食肥甘厚味,脾胃受损,脾健运功能减弱,化生无力,输布水谷精微失调,湿浊而生,气机受阻,郁而化热,薰蒸肝胆,胆汁外溢乃发黄疸。OJ 是造成肝功能损害的主要原因,因胆道阻塞,胆汁流出受阻,胆汁聚集肝内,引起肝细胞损伤和凋亡。AST、ALT、TBIL 等是较为敏感的肝细胞损伤指标[7]。谢毅等[8]证实,精氨酸联合加味大柴胡汤可能通过下调Toll样受体4来降低内毒素水平,从而减轻急性胆管炎大鼠的肝脏损害。陈念平等[9]发现大黄素能降低阻塞性黄疸时的肠道细菌移位率,对肝功能有明显保护作用,可有效减轻OJ 时的肝纤维化。本研究结果显示,O 组血清AST、ALT、TBIL 升高,在加味大柴胡汤干预后,上述指标降低,表明加味大柴胡汤能改善模型大鼠的肝功能,减轻肝损伤。
为了探究ERS在OJ中的相关机制,本研究观察了 MMDB 在 OJ 模型大鼠体内对 JNK、Bcl-2 表达的影响。JNK是MAPK家族中的重要成员,在细胞ERS调节过程中起重要作用。JNK 被磷酸化激活后,能通过转录依赖或转录非依赖机制调控下游靶基因的表达或靶蛋白的活性而介导细胞凋亡[10]。JNK激活后可从胞质中转位入核,通过磷酸化激活c-JUN、c-FOS 等转录因子而调节凋亡相关靶基因的转录表达[11]。林铭斯[12]研究表明,加味茵芍散可通过影响内质网应激-胰岛素抵抗中的肌醇依赖酶1α(IRE1α)/JNK 信 号 通 路 抑 制 IRE1α 的 mRNA 及JNK1蛋白磷酸化表达水平,减轻非酒精性脂肪肝的病理变化程度。王茜等[13]发现,解毒护肝方对药物性肝损伤大鼠有明显的保护作用,其机制可能与调控Toll 样受体3/TNF-α/JNK2 信号通路有关。本研究显示,在术后3、7、10 d时OJ模型大鼠肝组织JNK的mRNA 及蛋白表达水平增强,加味大柴胡汤干预组在相同时间点,JNK表达减弱,表明黄疸模型组肝损伤凋亡明显,加味大柴胡汤干预后可以减轻肝细胞的凋亡,这可能是通过抑制JNK的合成,减轻肝细胞的氧化应激反应,从而缓解肝损伤凋亡。
Bcl-2 通常位于线粒体外膜和内质网上,其在ERS过程中表现出抑制细胞凋亡的作用[14]。JNK的凋亡诱导底物包括Bcl-2和Bim,它们分别可被JNK磷酸化抑制和激活[15-16]。目前,许多研究集中于Bcl-2 在调节T 细胞中三磷酸肌醇受体(IP3R)介导的Ca2+信号中的作用,因为TRPC1激活后IP3R 介导的Ca2+信号在免疫系统中具有非常重要的生理意义[17-18]。张贝贝等[19]发现,铁皮石斛多糖可通过抑制高糖诱导的血管内皮细胞Bax的表达,增强Bcl-2的表达,从而抑制血管内皮细胞凋亡,在一定程度上可防治糖尿病血管病变。涂玥等[20]通过研究大黄附子汤,证实其可调节肾组织JNK/Bcl-2 信号通路,减少肾小管上皮细胞凋亡,改善肾间质纤维化,最终延缓尿酸性肾病进展。与上述结果相似,本研究显示,与假手术组相比,OJ 模型大鼠肝细胞中Bcl-2 的mRNA及蛋白表达水平降低,加味大柴胡汤干预后,Bcl-2蛋白水平较相同时间点模型大鼠高,表明O组大鼠肝组织发生损伤凋亡时,Bcl-2 表达下调,而加味大柴胡汤的干预又使Bcl-2 表达增加。因此,笔者考虑加味大柴胡汤可能通过调节JNK/Bcl-2 信号通路来减少肝细胞凋亡。
综上所述,本研究双重结扎大鼠胆总管成功建立OJ 大鼠肝损伤模型,血清AST、ALT、TBIL 水平及JNK、Bcl-2 表达水平发生变化,产生了ERS,加快细胞凋亡。加味大柴胡汤干预后能一定程度上改善大鼠肝功能,同时下调JNK 表达,提高Bcl-2 表达,这可能与调节JNK/Bcl-2 信号通路有关。加味大柴胡汤可通过减轻肝细胞的ERS,减少肝细胞凋亡,进而对肝脏起保护作用,但其是否通过其他氧化应激反应或途径对肝细胞起到保护作用,尚待进一步研究。



