王冬梅,蔡桂淑,刘立生
华勒变性是脑梗死后继发的一种神经病理改变,现有研究表明华勒变性的出现与临床持续的神经功能异常有关[1]。继发华勒变性后会导致瘫痪肢体肌力减退、肌张力增高,进而出现肢体活动障碍和言语障碍进行性加重。因此,研究脑梗死后华勒变性的特点,分析该病变对神经运动功能和日常生活能力的影响,对指导临床医师全面评估病情转归有重要意义。本研究通过比较不同脑梗死部位发生华勒变性的概率及发生时间差异,为临床早期预防和治疗华勒变性提供参考。
1 对象与方法
1.1 研究对象 选取2017年1月—2018年1月在天津市北辰医院神经内科住院的急性脑梗死患者185例作为研究对象。纳入标准:(1)入组的急性脑梗死患者均符合1995年中华医学会第4届脑血管会议制定的诊断标准,并经头颅磁共振(MRI)证实,患者主诉病程均在1周内,且不存在华勒变性。(2)患者均有不同程度锥体束受损表现。(3)能配合检查及24个月的随访。排除标准:(1)合并意识障碍及严重心肺合并症不能配合运动功能评估者。(2)在随访的24个月内出现新发脑梗死或脑出血者。全部患者均签署知情同意书。
1.2 分组 依据入院时头颅MRI提示的梗死部位将患者分为3组。A组为前循环供血范围内皮层及皮层下梗死(51例),B组为前循环供血范围内半卵圆中心、脑室旁、基底节区梗死(78例),C组为后循环供血范围内胼胝体、丘脑、脑干、小脑梗死(56例)。
1.3 资料收集 收集入组患者的人口学特征(年龄、性别),既往病史(高血压病、糖尿病、冠心病等),头颅MRI(梗死部位及华勒变性)等资料。
1.4 华勒变性的MRI诊断标准 均可见较明确的原发性病灶,而且华勒变性继发病灶与原发病灶有相连或不相连的条状异常信号,此异常信号必须经由放射冠、穿过内囊膝部或内囊后肢的前半部、大脑脚和桥脑基底部,条状异常信号可以是连续的,也可以不连续,但一定与锥体束走行一致,见图1。
1.5 随访 对入组患者进行24个月的随访,在患者发病7 d内、3个月、9个月和24个月分别进行头颅MRI检查,在患者发病14 d内、3个月、9个月和24个月进行运动功能、日常生活能力的评估。神经运动功能评估采用Fugl-Meyer运动功能量表(FMA),满分为100分。<50分为严重运动障碍,50~84分为明显运动障碍,85~95分为中度运动障碍,96~99分为轻度运动障碍。日常生活能力的评估采用日常生活能力量表(ADL),≤26分为正常,>26分提示生活能力下降。
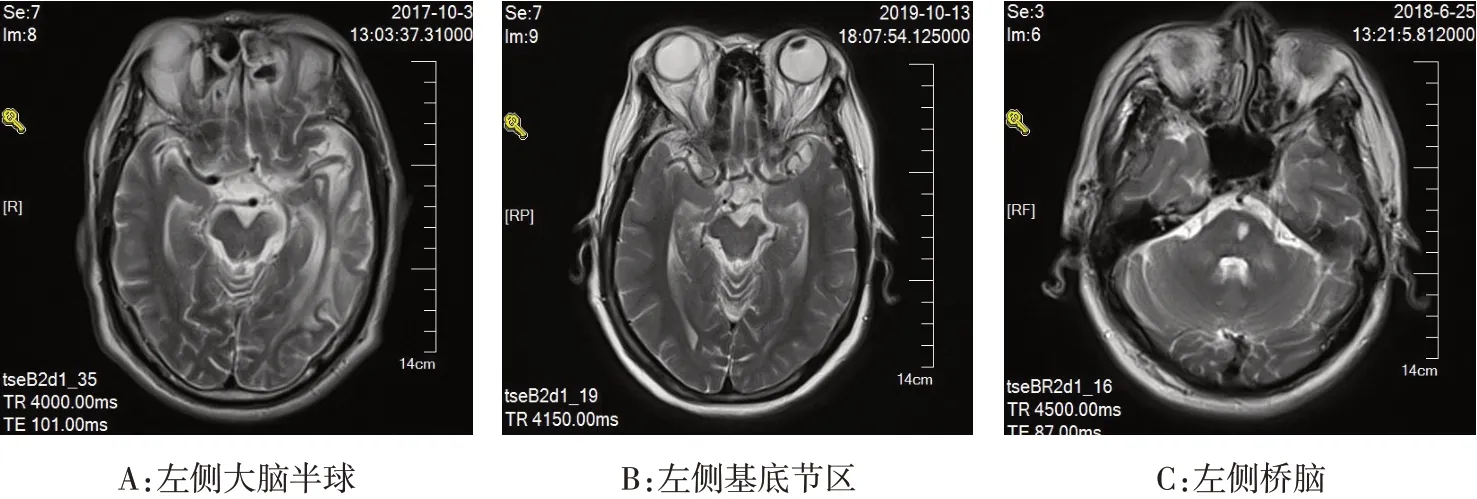
Fig.1 MRI findings of Warlerian degeneration in different parts of brain图1 大脑不同部位华勒变性的MRI表现
1.6 统计学方法 采用SAS 9.4软件进行统计分析,符合正态分布的计量资料用均数±标准差(x±s)表示,2组间比较用t检验,多组间比较采用单因素方差分析,组间多重比较采用LSD-t法。不符合正态分布的计量资料采用中位数和四分位数[M(P25,P75)]表示,多组间比较用Kruskal-WallisH检验,组间多重比较时检验水准采取Bonferroni法进行校正(α'=0.017)。计数资料以例(%)表示,组间比较采用χ2检验或Fisher确切概率法。采用多因素线性逐步回归分析发病24个月FMA下降和ADL升高的影响因素。检验水准为双侧α=0.05。
2 结果
2.1 3组患者一般情况比较 C组合并冠心病比例低于其他2组,且与B组比较,C组基线FMA评分升高,ADL评分下降,3组间性别、年龄、高血压史、糖尿病史比较差异均无统计学意义(均P>0.05),见表1。
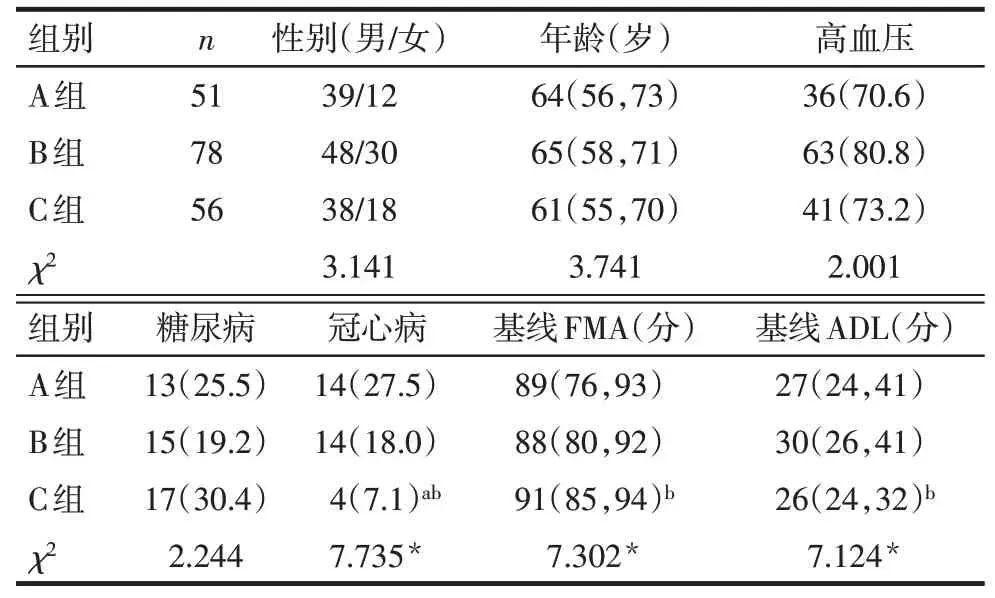
Tab.1 Comparison of general conditions between three groups of patients表1 3组患者一般情况的比较
2.2 组间发生华勒变性的特点 在3个月、9个月和24个月时A组和B组华勒变性的发生率均高于C组,前循环供血区较后循环供血区更易早期发生华勒变性,见表2。
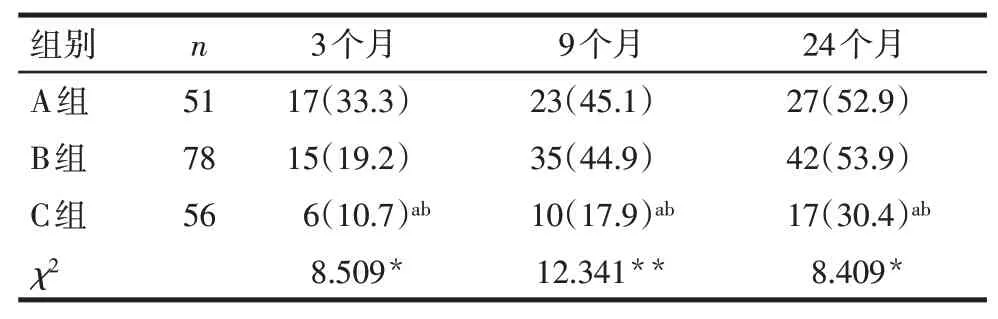
Tab.2 The difference of Wallerian degeneration in three groups of patients表2 3组间发生华勒变性的差异[例(%)]
2.3 脑梗死后神经运动功能和日常生活能力的变化 脑梗死发病24个月,3组间FMA评分差值和ADL评分差值的变化有统计学意义(P<0.05),见表3。

Tab.3 Changes of FMA score difference and ADL score difference after 24 months in three groups表3 3组发病24个月FMA评分差值和ADL评分差值的变化 [分,M(P25,P75)]
2.4 脑梗死合并华勒变性与神经运动功能的关系
2.4.1 发病24个月FMA评分变化的单因素线性回归分析 以患者发病24个月FMA评分与基线FMA评分的差值为因变量进行线性回归分析发现,性别、梗死部位、发生华勒变性以及发生华勒变性的时间是发病24个月FMA评分变化的影响因素(P<0.05),见表4。
2.4.2 发病24个月FMA评分变化的多因素线性回归分析 在校正了基线FMA值的影响后,男性、发生华勒变性的时间越早,其发病24个月FMA下降幅度越大,患者神经运动功能越差,见表5。
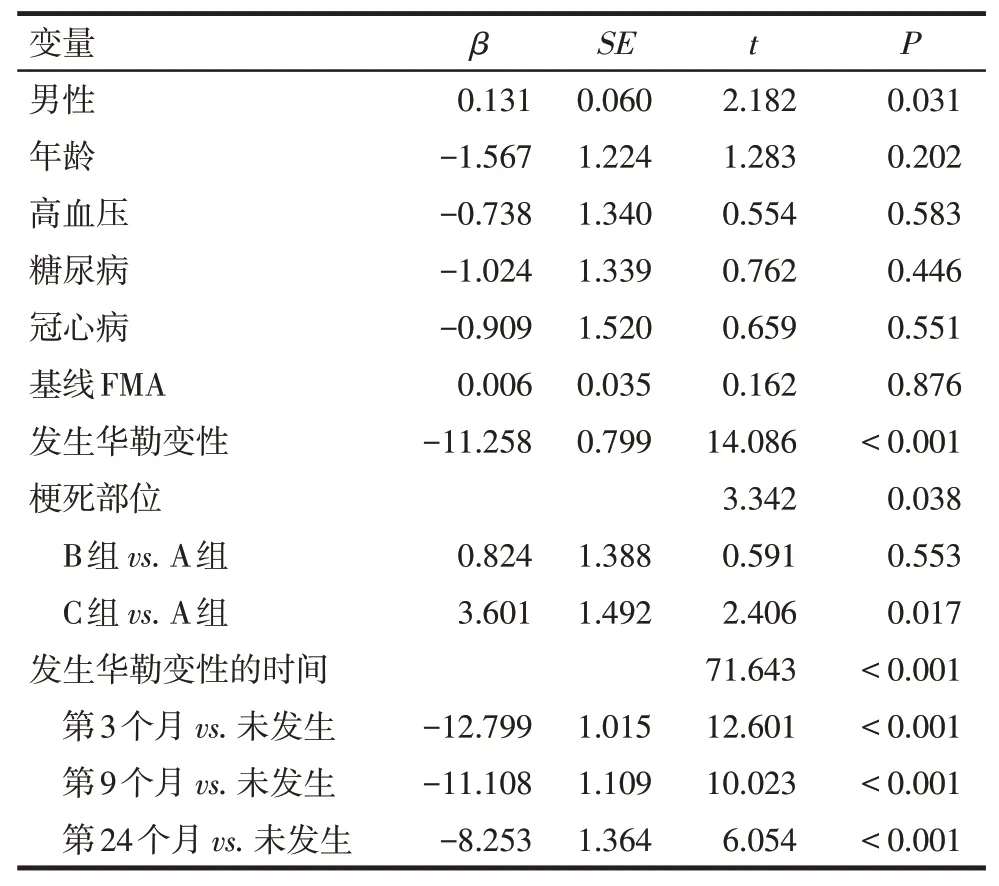
Tab.4 Univariate linear regression analysis of FMA difference after 24 months表4 发病24个月FMA评分差值变化的单因素分析
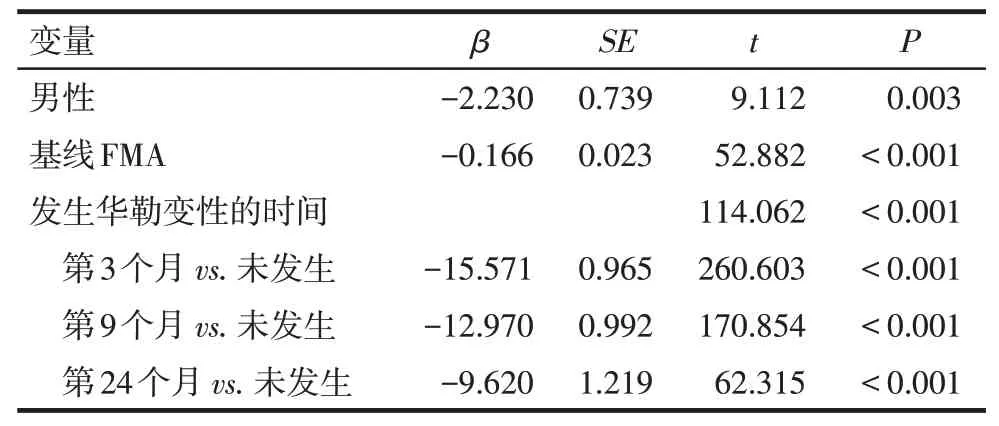
Tab.5 Multivariate linear regression analysis of FMA difference after 24 months表5 发病24个月FMA评分差值变化的多因素线性回归分析
2.5 脑梗死合并华勒变性与日常生活能力的关系
2.5.1 发病24个月ADL评分变化的单因素线性回归分析 以患者发病24个月ADL评分与基线ADL评分的差值为因变量进行线性回归分析发现,梗死部位、发生华勒变性以及发生华勒变性的时间是发病24个月ADL评分变化的影响因素(P<0.05),见表6。
2.5.2 发病24个月ADL评分变化的多因素线性回归分析 在校正了基线ADL值的影响后,发生华勒变性的时间越早,其发病24个月ADL升高幅度越高,患者日常生活能力越差,见表7。
3 讨论
华勒变性是神经元胞体或轴索近端损伤后远端神经纤维发生的继发性变性,在周围神经系统和中枢神经系统均可出现。该病变由Waller于1850年在青蛙周围神经纤维横断后的实验中首次发现[2]。华勒变性不仅累及皮质脊髓束和皮质脑桥小脑束,齿状核红核橄榄核通路、脊髓后索、胼胝体、边缘环路及视通路等也可受累,从而产生多种多样的临床神经功能损害症状[3]。

Tab.6 Univariate linear regression analysis of ADL difference after 24 months表6 发病24个月ADL评分差值的单因素分析
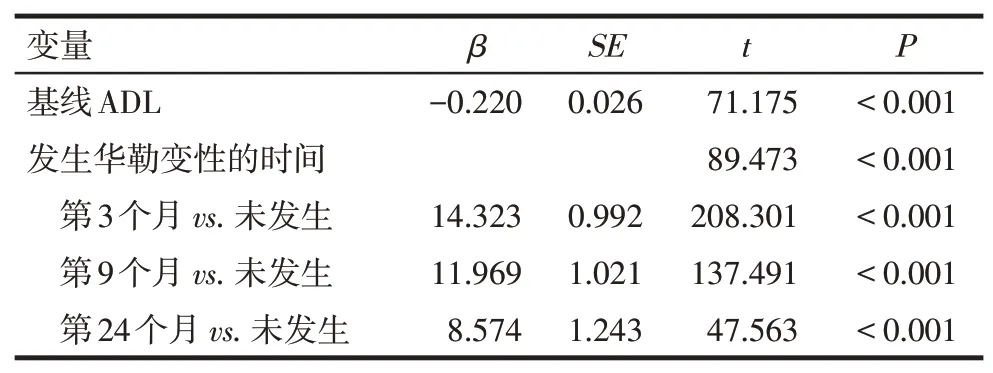
Tab.7 Multivariate linear regression analysis of ADL difference after 24 months表7 发病24个月ADL评分差值的多因素分析
在中枢神经系统中,脑梗死、脑肿瘤、脑外伤术后等均可引起神经元胞体死亡,导致神经元远侧神经轴索以及髓鞘崩解[4],促使雪旺细胞增生并吞噬轴索和髓鞘的碎屑,最终导致锥体束华勒变性的发生。急性神经损伤后1周内就可在病理组织学上呈现华勒变性的改变。华勒变性是一个动态变化过程,在不同阶段具有不同的组织病变特点,各期在MRI上有不同的影像学特征,其中扩散加权成像(DWI)有助于早期锥体束华勒变性的诊断。Shen等[5]发现桥脑梗死后继发双侧桥臂华勒变性的患者几乎均有偏瘫及构音障碍。Yin等[6]发现桥脑梗死后继发双侧桥臂华勒变性的时间间隔为3~33个月。现有研究证明,超过半数的幕上脑血管病可继发华勒变性,皮层梗死后继发华勒变性亦可出现在没有合并缺血的胼胝体和纹状体区域[7]。
脑梗死后发生华勒变性可引起不同程度的神经功能障碍,是影响脑梗死预后及神经功能恢复的重要因素[8]。脑梗死后早期继发华勒变性的患者运动功能缺损严重,其运动功能及日常生活能力恢复速度明显慢于未合并华勒变性者,且随着病程的延长差异越明显[9]。目前大多研究者认为原发病变的部位及大小与椎体束华勒变性出现的时间及变性程度密切相关[10]。脑梗死病变部位越靠近皮层锥体细胞,越易继发华勒变性,且病变范围越大,出现华勒变性的概率越高[11]。
本研究发现,不同梗死部位发生华勒变性的概率和时间均不同,前循环供血区较后循环供血区更易发生华勒变性,皮层及皮层下梗死更容易较早的发生华勒变性。多因素分析结果显示,性别和发生华勒变性的时间是发病24个月FMA下降的影响因素,说明发生华勒变性的时间越早,神经运动功能恢复越差;发生华勒变性的时间是发病24个月ADL值升高的影响因素,说明发生华勒变性的时间越早,日常生活能力越差。因此,明确梗死部位与华勒变性的关系,预判发生华勒变性的风险及对患者神经运动功能和日常生活能力的影响,有利于早期寻找有效的治疗方法(药物和康复训练)和预防措施,促进肢体运动功能的恢复,降低致残率,提高患者的生活自理能力。
本研究分析了梗死部位对华勒变性的影响,但未能分析梗死大小的影响;评估了不同部位梗死后华勒变性出现的时间,但未能对变性的程度加以评估,也未将梗死复发患者纳入研究,这些都有待后期延长随访时间,同时增加对梗死复发病例的研究,以进一步协助临床诊疗工作。



