吕明义,邓淑玲,郭文晏,邱永升,龙晓凤△
缺血再灌注损伤是指机体组织、器官血流供应短暂性障碍后再次使血流恢复灌注时所发生的炎症、凋亡、氧化应激等病理过程,虽然在缺血早期阶段及时进行再灌注治疗可使疾病进展得到有效控制,但组织、器官损伤仍然无法完全避免[1]。脑缺血再灌注损伤在各类缺血再灌注损伤中具有发病率高、致残率高、病死率高等特点,危害尤为严重[2]。因此,寻找脑缺血后有效的保护药物,进而延缓病情进展,改善神经功能,已成为近年来的研究热点[3]。
木犀草素广泛存在于胡萝卜、椰菜、甜菜、菜花、洋白菜、芽甘蓝和百里香等蔬菜中,还存在于白毛夏枯草、菊花、荆芥和金银花等传统药用植物中,为食源性黄酮类化合物[4]。木犀草素具有保护心脑血管、抗炎、抗菌、抗氧化、抗肿瘤及免疫调节等多种药理作用[5]。乔会敏等[6]研究表明,木犀草素可以通过抑制肿瘤坏死因子受体相关因子6(TRAF6)的表达对脑组织损伤起到保护作用。方露玫等[7]研究发现,木犀草素能够通过增强神经元细胞膜上的钠泵活性,减轻缺血再灌注所致的神经元损伤。此外,也有研究提示,木犀草素对脑缺血再灌注损伤的保护作用与促进氧化/抗氧化状态的再平衡有关[8]。
目前木犀草素保护脑缺血再灌注损伤的分子机制并未阐述清楚。本研究建立了大鼠大脑中动脉栓塞(MCAO)模型,在明确木犀草素减轻脑缺血再灌注损伤的基础上,探讨其对炎症反应和凋亡的影响,并进一步研究两者与Janus 蛋白酪氨酸激酶2(JAK2)/信号转导及转录激活蛋白3(STAT3)信号通路的关系,为木犀草素应用于脑缺血再灌注损伤的治疗提供依据。
1 材料与方法
1.1 实验动物 雄性SD大鼠120只,平均体质量(200±20)g,SPF 级,购自上海杰思捷实验动物公司,生产许可号:SCXK(沪)2018-0004。
1.2 主要试剂与仪器 木犀草素(HPLC≥98%,南京春秋生物公司);尼莫地平片(30 mg/片,湖南百草制药公司);2,3,5-三苯基氯化铵(TTC,上海尚宝生物科技有限公司);肿瘤坏死因子α(TNF-α)、B 细胞淋巴瘤因子2(Bcl-2)、白细胞介素(IL)-6、Bcl-2 相关X 蛋白(Bax)、IL-1β 及半胱氨酸蛋白酶3(Caspase-3)酶联免疫吸附试验(ELISA)检测试剂盒(南京建成生物工程研究所);二喹啉甲酸(BCA)蛋白定量试剂盒(上海碧云天生物技术有限公司);兔抗大鼠JAK2、磷酸化JAK2(p-JAK2)、STAT3、磷酸化STAT3(p-STAT3)、甘油醛-3-磷酸脱氢酶(GAPDH)多克隆抗体及辣根过氧化物酶(HRP)标记的山羊抗兔IgG 二抗(武汉博士德公司);ECL 发光试剂盒(上海翌圣生物科技公司)。线栓(型号3600,广州佳灵生物公司),电子天平(型号AL204IC,瑞士梅特勒-托利多仪器公司),高速台式冷冻离心机(型号PrimoR,美国ThermoFisher公司),凝胶成像分析系统(型号ChemiDoc XRS+)、酶标仪(型号680)、垂直电泳仪(型号Mini-PROTEAN Tetra)均购自美国Bio-Rad 公司,切片机(型号RM2235,德国Leica 公司);显微镜(型号BX61,日本Olympus公司)。
1.3 分组、给药及MCAO模型建立 将饲养3 d的SD大鼠根据体质量按随机数字表法分为假手术组、MCAO 组、木犀草素低剂量组(50 mg/kg)、木犀草素高剂量组(100 mg/kg)及尼莫地平组(15 mg/kg),每组24 只。大鼠均灌胃给药,灌胃体积均为20 mL/kg,频率为1 次/d,共7 d;假手术组及MCAO 组用同体积溶媒(0.5%羧甲基纤维素钠)灌胃。末次给药24 h后,各组大鼠腹腔注射10%水合氯醛(3 mL/kg)进行麻醉,于颈部正中偏左处用眼科剪剪口,将左侧颈总动脉(CCA)逐层分离,并分离颈外动脉(ECA),结扎ECA及CCA近心端,CCA远心端轻打一个线栓能穿过的小结。在CCA距离分叉约5 mm处剪开一个约0.2 mm大小的缺口,插入线栓,经CCA分叉处进入颈内动脉;当有阻力时(插入线栓长度约为18~20 mm),即阻断大脑中动脉入口处,结扎颈总动脉远心端;2 h后将线栓抽出,进行缺血后再灌注,建立MCAO大鼠模型;假手术组不做插线处理,仅暴露CCA。
1.4 神经功能损伤评分及脑组织含水量检测 神经功能损伤评分按照Bederson 等[9]的方法进行,0 分为无任何神经系统损伤症状;1分为不能完全伸展对侧前爪;2分为身体不转圈,但前爪屈曲对侧压有抵抗;3分为身体向左侧方向转圈,且伴有前爪屈曲对侧压有抵抗。脑组织含水量检测用干湿重法进行。
1.5 TTC 染色 再灌注24 h后,各组按随机数字表法抽取8只大鼠,采用TTC染色法检测脑梗死体积。大鼠脑组织进行连续冠状切片(1 mm),在37 ℃条件下放入2%TTC溶液中,浸泡15 min;随后,在4%多聚甲醛溶液中固定。经TTC 染色后,未梗死区域仍呈红色,而梗死区域呈白色,脑梗死体积检测采用Image J软件进行。
1.6 ELISA 检测 各组大鼠麻醉后断头取脑,准确称质量;按照质量(g)与体积(mL)比为1∶9的比例加入预冷的组织裂解液,匀浆,12 000 r/min离心15 min,制备10%脑组织匀浆液,分装后于冰箱中保存备用。按照试剂盒说明书中的检测步骤,进行TNF-α、IL-6、IL-1β、Bcl-2、Bax及Caspase-3含量检测。
1.7 Western blot 检测 取1.6制备的脑组织匀浆液,BCA法测总蛋白含量。加入上样缓冲液,沸水中煮5 min 使蛋白变性,每孔上样20µg蛋白样品。常规行12%SDS-PAGE电泳后转至PVDF 膜上。室温下经5%脱脂奶粉封闭后,加入JAK2(1∶1 000 倍稀释)、p-JAK2(1∶500 倍稀释)、STAT3(1∶1 000倍稀释)、p-STAT3(1∶500 倍稀释)及内参蛋白GAPDH(1∶1 000倍稀释)抗体,4 ℃孵育过夜。在室温下,再经HRP标记的二抗孵育0.5 h,ECL法显色并曝光,进行图像扫描分析。
1.8 统计学方法 采用SPSS 17.0软件进行数据分析。计量数据使用均数±标准差()表示,多组间均数比较采用单因素方差分析,组间多重比较采用LSD-t法。P<0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠脑缺血再灌注后神经功能损伤评分及脑组织含水量比较 MCAO组的神经功能损伤评分及脑组织含水量比假手术组明显增加(P<0.05),表明MCAO模型制备成功;与MCAO组比较,木犀草素低、高剂量组及尼莫地平组的神经功能损伤评分及脑组织含水量均明显降低(P<0.05);与尼莫地平组比较,木犀草素低剂量组的神经功能损伤评分明显增加(P<0.05),而木犀草素高剂量组的神经功能损伤评分及木犀草素低、高剂量组的脑组织含水量均无明显变化(P>0.05),见表1。
Tab.1 Comparison of neurological function injury score,brain tissue water content and cerebral infarct volume after cerebral ischemia and reperfusion between the five groups表1 各组大鼠脑缺血再灌注后神经功能损伤评分、脑组织含水量及脑梗死体积比较 (n=8,)

Tab.1 Comparison of neurological function injury score,brain tissue water content and cerebral infarct volume after cerebral ischemia and reperfusion between the five groups表1 各组大鼠脑缺血再灌注后神经功能损伤评分、脑组织含水量及脑梗死体积比较 (n=8,)
*P<0.05;a与假手术组比较,b与MCAO组比较,c与木犀草素低剂量比较,d与木犀草素高剂量组比较,P<0.05;表2~4同。
组别假手术组MCAO组木犀草素低剂量组木犀草素高剂量组尼莫地平组F神经功能损伤评分(分)0 2.94±0.36a 2.31±0.25b 2.05±0.30b 1.82±0.22bc 147.046*脑组织含水量(%)70.76±9.27 86.30±8.39a 75.74±8.11b 74.91±9.35b 71.54±7.71b 4.198*脑梗死体积(%)0 34.16±4.54a 30.64±3.28b 21.70±2.61b 7.25±1.17bcd 220.315*
2.2 各组大鼠脑缺血再灌注后脑梗死体积的比较 假手术组未见脑梗死病灶,MCAO 组脑梗死体积较假手术组明显增加(P<0.05),进一步表明MCAO 模型制备成功;与MCAO 组比较,木犀草素低、高剂量组及尼莫地平组脑梗死体积均明显降低(P<0.05);与尼莫地平组比较,木犀草素低、高剂量组梗死体积均明显增加(P<0.05),见表1、图1。
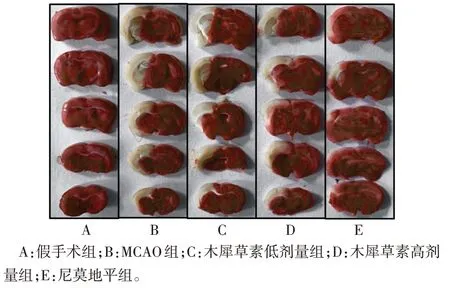
Fig.1 TTC staining of cerebral infarction volume of rats in each group图1 TTC染色检测各组大鼠脑梗死体积
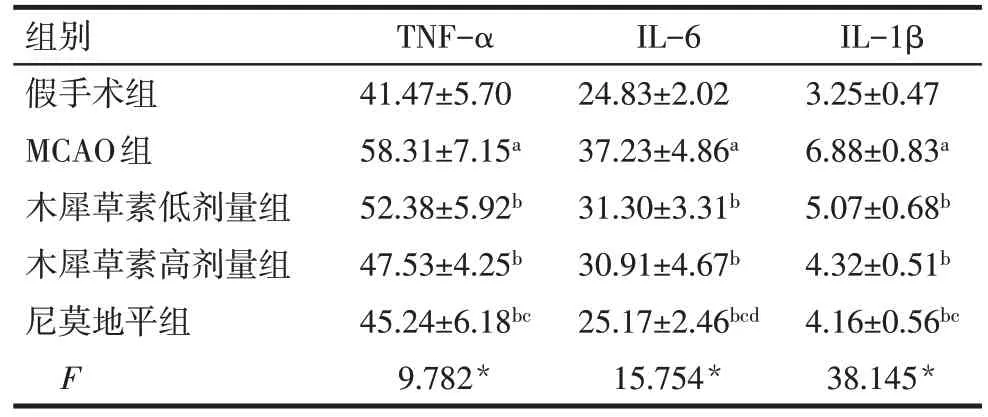
2.3 各组大鼠脑缺血再灌注后脑组织TNF-α、IL-6及IL-1β 含量比较 MCAO 组脑组织 TNF-α、IL-6及IL-1β 含量与假手术组比较均明显增加(P<0.05);与MCAO组比较,木犀草素低、高剂量组及尼莫地平组的脑组织TNF-α、IL-6 及IL-1β 含量均明显降低(P<0.05);与尼莫地平组比较,木犀草素低剂量组的脑组织TNF-α、IL-1β含量及木犀草素低、高剂量组的IL-6含量明显增加(P<0.05),见表2。
Tab.2 Comparison of TNF-α,IL-6 and IL-1β contents of brain tissue after cerebral ischemia and reperfusion between the five groups of rats表2 各组大鼠脑缺血再灌注后脑组织TNF-α、IL-6及IL-1β含量比较 (n=8,ng/L,)
Tab.2 Comparison of TNF-α,IL-6 and IL-1β contents of brain tissue after cerebral ischemia and reperfusion between the five groups of rats表2 各组大鼠脑缺血再灌注后脑组织TNF-α、IL-6及IL-1β含量比较 (n=8,ng/L,)
组别假手术组MCAO组木犀草素低剂量组木犀草素高剂量组尼莫地平组F TNF-α 41.47±5.70 58.31±7.15a 52.38±5.92b 47.53±4.25b 45.24±6.18bc 9.782*IL-6 24.83±2.02 37.23±4.86a 31.30±3.31b 30.91±4.67b 25.17±2.46bcd 15.754*IL-1β 3.25±0.47 6.88±0.83a 5.07±0.68b 4.32±0.51b 4.16±0.56bc 38.145*
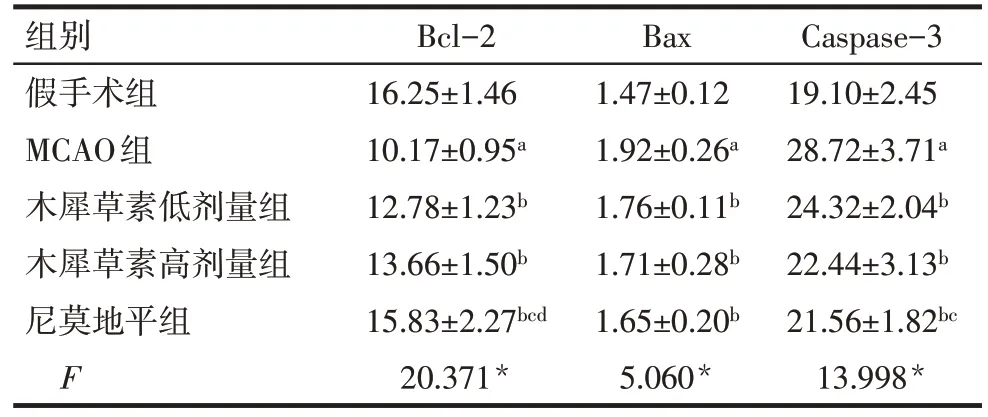
2.4 各组大鼠脑缺血再灌注后脑组织Bcl-2、Bax及Caspase-3含量比较 与假手术组比较,MCAO 组的脑组织Bcl-2 含量明显降低,而Bax 及Caspase-3 含量明显增加(P<0.05);与MCAO 组比较,木犀草素低、高剂量组及尼莫地平组的脑组织Bcl-2 含量明显增加,而Bax 及Caspase-3 含量明显降低(P<0.05);与尼莫地平组比较,木犀草素低、高剂量组的脑组织Bcl-2 含量明显降低,木犀草素低剂量组Caspase-3含量明显增加(P<0.05),见表3。
Tab.3 Comparison of Bcl-2,Bax and Caspase-3 contents of brain tissue after cerebral ischemia and reperfusion between the five groups of rats表3 各组大鼠脑缺血再灌注后脑组织Bcl-2、Bax及Caspase-3含量比较 (n=8,ng/L,)
Tab.3 Comparison of Bcl-2,Bax and Caspase-3 contents of brain tissue after cerebral ischemia and reperfusion between the five groups of rats表3 各组大鼠脑缺血再灌注后脑组织Bcl-2、Bax及Caspase-3含量比较 (n=8,ng/L,)
组别假手术组MCAO组木犀草素低剂量组木犀草素高剂量组尼莫地平组F Bcl-2 16.25±1.46 10.17±0.95a 12.78±1.23b 13.66±1.50b 15.83±2.27bcd 20.371*Bax 1.47±0.12 1.92±0.26a 1.76±0.11b 1.71±0.28b 1.65±0.20b 5.060*Caspase-3 19.10±2.45 28.72±3.71a 24.32±2.04b 22.44±3.13b 21.56±1.82bc 13.998*
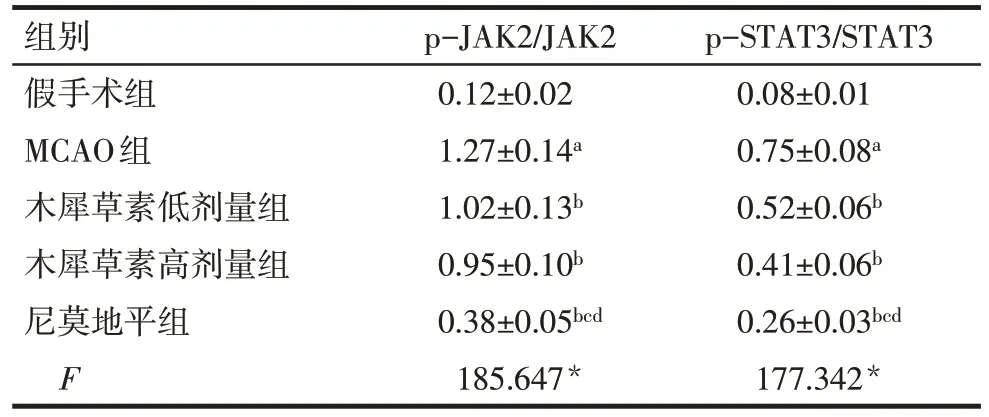
2.5 各组大鼠脑缺血再灌注后脑组织JAK2 及STAT3 蛋白磷酸化水平比较 MCAO 组的脑组织JAK2 及STAT3 蛋白磷酸化水平较假手术组明显增加(P<0.05);与MCAO组比较,木犀草素低、高剂量组及尼莫地平组的脑组织JAK2 及STAT3 蛋白磷酸化水平明显降低(P<0.05);与尼莫地平组比较,木犀草素低、高剂量组的脑组织JAK2及STAT3蛋白磷酸化水平明显增加(P<0.05),见图2、表4。

Fig.2 The protein expressions of p-JAK2 and p-STAT3 detected by Western blot assay图2 Western blot检测p-JAK2和p-STAT3蛋白表达
Tab.4 Comparison of p-JAK2 and p-STAT3 protein expressions of brain tissue after cerebral ischemia and reperfusion between the five groups of rats表4 各组大鼠脑缺血再灌注后脑组织p-JAK2及p-STAT3蛋白表达量比较 (n=8,)
Tab.4 Comparison of p-JAK2 and p-STAT3 protein expressions of brain tissue after cerebral ischemia and reperfusion between the five groups of rats表4 各组大鼠脑缺血再灌注后脑组织p-JAK2及p-STAT3蛋白表达量比较 (n=8,)
组别假手术组MCAO组木犀草素低剂量组木犀草素高剂量组尼莫地平组F p-JAK2/JAK2 0.12±0.02 1.27±0.14a 1.02±0.13b 0.95±0.10b 0.38±0.05bcd 185.647*p-STAT3/STAT3 0.08±0.01 0.75±0.08a 0.52±0.06b 0.41±0.06b 0.26±0.03bcd 177.342*
3 讨论
脑缺血再灌注损伤是缺血性脑血管疾病治疗后的严重并发症,主要以运动和肢体感觉功能障碍为主要特征[10]。MCAO 动物模型具有重现性好、无需开颅手术、颅内感染概率低等优势,在脑缺血再灌注损伤的研究中使用频率较高[11]。本研究采用线栓法建立MCAO 大鼠模型后发现,MCAO 组大鼠神经功能损伤评分、脑组织含水量及脑梗死体积均明显增加,表明模型制备成功。尼莫地平为二氢吡啶类钙通道拮抗剂,可降低脑缺血再灌注损伤大鼠神经功能损伤评分及脑组织含水量,也可降低脑梗死体积;同时,尼莫地平也具有较好的抗炎及抗凋亡作用,因此本研究将其作为阳性对照药物使用[12-13]。本研究结果发现,木犀草素低、高剂量组及尼莫地平组大鼠神经功能损伤评分、脑组织含水量及梗死体积均明显降低,表明木犀草素具有减轻大鼠脑缺血再灌注损伤的作用。
脑组织缺血再灌注后,释放炎症信号,聚集大量炎性细胞,导致TNF-α、IL-6及IL-1β等炎性因子释放,最终发生系列炎症反应。TNF-α 作为炎症反应的起始因子,可促进IL-6 及IL-1β 等因子的表达量增加,引起炎性损伤的级联效应,使脑缺血再灌注损伤加重[14]。IL-6 在脑组织中可诱导磷脂酶-2 基因表达,刺激炎性因子IL-1β 的产生,加快炎症进展[15]。IL-1β是脑及神经组织中IL-1的主要存在形式,可以促进白细胞聚集黏附,并向缺血区转移及浸润[16]。本研究结果显示,与MCAO组比较,木犀草素低、高剂量组及尼莫地平组大鼠脑组织TNF-α、IL-6及IL-1β 含量均明显降低,表明木犀草素具有抑制炎症反应,减轻大鼠脑缺血再灌注损伤作用。
在发生脑缺血时,缺血中枢区周围的神经元死亡以凋亡为主,因此神经元凋亡也是脑缺血再灌注损伤发生的重要机制[17]。神经细胞凋亡由多重调节基因共同参与完成,涉及一系列复杂的级联反应,其中以Bcl-2、Bax 及Caspase-3 为代表的凋亡因子发挥着关键作用。Bcl-2 是研究较为透彻的抗凋亡基因,具有抑制缺血所致的神经细胞凋亡,进而缓解神经系统损伤的作用[18]。Bax 可以诱导神经元凋亡,Caspase-3 是Caspase 家族中关键的蛋白酶,在缺血引起的早期神经元细胞凋亡中扮演着重要角色[19]。已有研究证实,促进Bcl-2表达,抑制Bax、Caspase-3表达,减少神经元凋亡,可以有效保护脑缺血再灌注引起的损伤[20]。本研究同样发现,与MCAO组比较,木犀草素低、高剂量组及尼莫地平组大鼠脑组织Bcl-2 含量明显增加,而 Bax 及 Caspase-3 含量明显降低,表明木犀草素可以通过减少神经元凋亡,进而延缓脑组织损伤。
JAK2/STAT3 信号通路与脑缺血再灌注损伤密切相关,其中JAK2蛋白主要表达于胶质细胞及神经元内,而STAT3 蛋白广泛分布于整个脑组织中[21]。脑缺血后,JAK2 及STAT3 蛋白磷酸化水平增加,使JAK2/STAT3信号通路活化,进而介导缺血后的炎症反应及神经元凋亡。研究发现,姜黄素对大鼠缺血后造成的脑损伤具有缓解作用,其分子机制与抑制JAK2/STAT3信号通路、减轻炎症反应有关[22]。黄角颗粒可以通过降低JAK2及STAT3蛋白磷酸化水平,减少脑组织神经元凋亡,在一定程度上延缓大鼠脑缺血再灌注引起的病理改变[23]。本研究结果同样证实,与MCAO 组比较,木犀草素低、高剂量组及尼莫地平组大鼠脑组织JAK2 及STAT3 蛋白磷酸化水平明显降低,表明抑制JAK2/STAT3信号通路的活化是木犀草素减弱炎症反应、减少细胞凋亡的可能机制。
综上,本研究结果证实,木犀草素具有减轻大鼠脑缺血再灌注损伤作用,该作用与抑制JAK2/STAT3信号通路活化,进而减弱炎症反应及减少细胞凋亡有关。



