莫少娥 刘可鹏 傅文 谢酬勤 郁冬玲 陈实 蓝雨雁
摘要:目的 探讨sigma-1受体(sig-1R)对神经病理性疼痛(NP)大鼠内质网应激的作用。方法 将鞘内置管成功的SPF级雄性SD大鼠24只按随机数字表法分为假手术组(S组)、NP模型组(C组)、sig-1R抑制剂BD1047干预组(B组),每组8只。C组和B组采用坐骨神经慢性挤压性损伤法建立NP模型。术后第4、5、6天,S组和C组鞘内注射生理盐水20 μL,B组鞘内注射BD1047(120 μmol/L)20 μL,1次/d。于术前1 d及术后第1、3、5、7天检测术侧足机械缩足反应阈(MWT)。采用Westen blot和免疫荧光染色法检测背根神经元(DRG)sig-1R、免疫球蛋白重链结合蛋白(BIP)、转录活化因子4(ATF4)、C/EBP同源蛋白(CHOP)的表达情况;采用HE染色法观察DRG形态大小及病理改变;采用透射电镜观察DRG内质网改变。结果 与S组比较,C组大鼠术后各时间点术侧足MWT明显下降,DRG病理损伤和内质网破坏明显加重,sig-1R、BIP、ATF4、CHOP表达均上调(P<0.05);与C组比较,B组大鼠术后第5、7天MWT升高,DRG病理损伤和内质网破坏减轻,sig-1R、BIP、ATF4、CHOP表达均下调(P<0.05)。结论 sig-1R参与了大鼠神经病理性疼痛的过程,其机制可能与抑制DRG内质网应激有关。
关键词:神经痛;内质网应激;免疫球蛋白重链;sigma-1受体;背根神经元
中图分类号:R614,R745文献标志码:ADOI:10.11958/20221491
The role of sigma-1 receptor in endoplasmic reticulum stress in neuropathic pain rats
MO Shaoe, LIU Kepeng, FU Wen, XIE Chouqin, YU Dongling, CHEN Shi, LAN Yuyan
Department of Anesthesiology, the First Affiliated Hospital of Guangxi Medical University, Nanning 530021, China
Corresponding Author E-mail: blueyuyan@163.com
Abstract: Objective To investigate the role of sigma-1 receptor (sig-1R) in endoplasmic reticulum stress in neuropathic pain (NP) rats. Methods Twenty-four SPF male SD rats with successful sheath tube were divided into the sham operation group (group S), the neuropathic pain model group (group C) and the BD1047 intervention group (group B) according to random number table, with 8 rats in each group. Chronic crush injury of sciatic nerve was used to establish NP model. On the 4th, 5th and 6th day after operation, normal saline 20 μL was injected intrathecally in the group S and the group C, and BD1047 (120 μmol/L) 20 μL was injected intrathecally in the group B once a day. The mechanical foot withdrawal response threshold (MWT) of the surgical side foot was measured on the first day before operation and on the first, 3rd, 5th and 7th day after operation. Western blot assay and immunofluorescence staining were used to detect the expression levels of sig-1R, glucose-regulated protein (BIP), activating transcription factor 4 (ATF4) and C/EBP-homologous protein (CHOP) in dorsal root neurons (DRG). HE staining was used to observe the morphological size and pathological changes of DRG. Changes of endoplasmic reticulum in DRG were observed by scanning electron microscopy. Results Compared with the group S, intraoperative parapodum MWT was significantly decreased (P<0.05), and pathological injury and endoplasmic reticulum destruction of DRG were significantly aggravated. Expressions of sig-1R, BIP, ATF4 and CHOP were up-regulated in the group C after CCI (P<0.05). Compared with the group C, the MWT was increased on the 5th and 7th day after CCI in the group B (P<0.05), and the expressions of sig-1R, BIP, ATF4 and CHOP were down-regulated (P<0.05). The pathological injury of DRG was improved. Conclusion sig-1R are involved in the neuropathic pain in rats, and the mechanism may be related to the inhibition of endoplasmic reticulum stress in dorsal root neurons.
Key words: neuralgia; endoplasmic reticulum stress; immunoglobulin heavy chains; sigma-1 receptor; dorsal root neurons
神经病理性疼痛(neuropathic pain,NP)是一种慢性继发性疼痛,在普通人群中的发病率约为7%[1]。由于NP的形成机制尚不明确,诊断和治疗较为困难,患者的生活质量受到严重影响。因此,深入研究NP的可能机制和治疗位点具有重要意义。研究表明,背根神经元(sorasal root ganglion,DRG)内质网应激(endoplasmic reticulum stress,ERS)与NP的发生发展密切相关,发生NP时,免疫球蛋白重链结合蛋白(immunoglobulin heavy chain binding protein,BIP)的激活促进ERS相关蛋白的活化,引发ERS,使用药物减轻ERS可显着改善NP[2]。sigma-1受体(sig-1R)是位于线粒体相关内质网膜上的一种分子伴侣蛋白,广泛分布于神经系统,参与多项神经系统生理与病理功能的调节[3-4]。研究发现,抑制sig-1R的表达可减轻大鼠的神经性疼痛[5]。但sig-1R是否可通过减轻ERS来改善NP目前尚不明确。本研究拟探讨sig-1R在NP大鼠ERS中的作用,以期为NP的防治提供作用位点和实验依据。
1 材料与方法
1.1 实验动物与分组 SPF级成年雄性SD大鼠24只,体质量200~250 g,由广西医科大学实验动物中心提供[动物生产许可证号:SCXK(桂)20200003]。本实验已通过广西医科大学实验动物福利伦理委员会批准(审批号:202104004)。所有大鼠均单笼饲养,自由摄食、饮水,处于昼夜交替环境,适应性饲养7 d。
1.2 主要试剂与仪器 sig-1R抑制剂BD1047(中国爱必信生物科技有限公司);兔抗大鼠sig-1R多克隆抗体(美国CST公司)、β-actin多克隆抗体(美国Abclonal公司);小鼠抗大鼠BIP、转录活化因子4(activating transcription factor 4,ATF4)、C/EBP同源蛋白(CHOP)单克隆抗体(美国Santa Cruz公司),山羊抗兔及山羊抗鼠二抗(北京中杉金桥生物技术有限公司);山羊抗兔549通道绿色荧光二抗和山羊抗鼠488通道红色荧光二抗(美国Abbkine公司);BCA试剂盒、RIPA裂解液、Triton X-100破膜液、DAPI、抗荧光猝灭封片剂(上海碧云天公司);von Frey纤维丝(中国医学科学院生物工程研究所);电泳仪/转印仪(美国Bio-Rad公司);倒置相差荧光显微镜(德国Leica公司);透射电镜(日本HTACHI公司)。
1.3 研究方法
1.3.1 鞘内置管术 参考文献[6]的方法行鞘内置管术。大鼠于术前8 h禁食不禁饮,称质量后麻醉,取俯卧位固定,将无菌PE-10导管用生理盐水冲洗后备用,背部备皮、消毒;切开约2 cm皮肤,分离肌肉,使L3-4脊椎间隙充分暴露,将PE-10导管突破椎间隙后斜行缓慢置入,置入过程中可见导管内有脑脊液溢出且大鼠出现甩尾反应,导管沿皮下引至颈部,外端牵出固定。置管后观察2 d,如大鼠出现后肢神经损伤则剔除,其余大鼠鞘内注射2%利多卡因10 μL,若大鼠出现双下肢软瘫并且于30 min内恢复正常,表明鞘内置管成功,可用于建模。
1.3.2 NP模型建立 参照文献[7]建立大鼠坐骨神经慢性挤压性损伤(chronic construction injury,CCI)模型。24只大鼠均鞘内置管成功且无神经损伤,按照随机数字表法分为假手术组(S组)、NP模型组(C组)、sig-1R抑制剂BD1047干预组(B组),每组8只。大鼠造模前8 h禁食不禁饮,称质量后麻醉,备皮消毒,C组和B组在股骨结节下方0.5 cm处切皮,分离肌肉间隙,充分暴露并游离出坐骨神经,用4-0丝线在坐骨神经干上结扎4道,每道间隔1 mm,结扎强度以小腿肌肉轻微颤抖时停止。S组大鼠仅游离暴露坐骨神经,不予结扎。CCI手术麻醉清醒后观察到缩爪、舔足、术侧足不敢着地等疼痛行为视为造模成功。造模成功的大鼠休养3 d后给药。CCI术后第4、5、6天,B组鞘内注射120 μmol/L BD1047 20 μL,S组和C组鞘内注射20 μL生理盐水,1次/d。
1.3.3 机械缩足反应阈(mechanical withdraw threshold,MWT)检测 分别于CCI手术前1 d,手术后第1、3、5、7天测定大鼠术侧足MWT(第5天于给药1 h后检测术侧足MWT)。在安静舒适的环境中,将大鼠置于底部为金属网格且透光的笼子中,适应30 min后测试,用von Frey纤维丝垂直刺激大鼠术侧足底皮肤,刺激力度以纤维丝弯曲90°为宜,持续刺激3~5 s,当大鼠出现迅速缩足、舔足等反应时记为阳性,记录该刺激力度。初始刺激力度为6 g,若出现刺激反应,则选低一级的刺激力度;反之则选高一级的刺激力度,重复测试3次,每次间隔5 min,取平均值。最大刺激力度设为60 g,以防损伤大鼠后足。
1.3.4 Western blot法检测DRG组织sig-1R、BIP、ATF4、CHOP蛋白表达 CCI术后第7天MWT测试结束后,处死大鼠,于冰上取出术侧DRG,置入RIPA裂解液中充分裂解。提取总蛋白上清液,采用BCA法测定蛋白质浓度,调整蛋白上样量,加入上样缓冲液,于100 ℃水浴变性5 min;SDS-PAGE分离蛋白,于150 mA恒流条件下湿转至PVDF膜,5%脱脂奶粉中封闭1 h;洗涤后加入一抗:sig-1R(1∶1 000)、BIP(1∶1 000)、ATF4(1∶500)、CHOP(1∶800)和内参蛋白β-actin(1∶1 000)4 ℃孵育过夜;取出PVDF膜,经TBST漂洗后放入山羊抗兔IgG、山羊抗鼠IgG二抗室温孵育1 h,洗涤后ECL显影、曝光,采用Image J软件分析灰度值。
1.3.5 免疫荧光法检测DRG组织sig-1R、BIP、ATF4、CHOP的表达定位 取术侧的DRG组织,于4%多聚甲醛中固定24 h,石蜡包埋,制成厚度5 μm的石蜡切片。取各组石蜡切片,经烤片、脱蜡、PBS洗涤、抗原修复后,3%过氧化氢室温孵育10 min,加入0.3% Triton X-100破膜,洗涤后用血清封闭1 h,加入一抗:sig-1R、BIP(1∶200),ATF4(1∶100)、CHOP(1∶100)4 ℃孵育过夜,在相应组织上滴加相应的绿色或红色荧光二抗(1∶200),室温避光孵育1 h,PBS洗涤后将DAPI滴于组织上染核3~5 min,滴加抗荧光猝灭剂封片。于暗室中用荧光显微镜观察,结果使用Image J软件进行图像分析。
1.3.6 HE染色 取各组DRG组织石蜡切皮,经烤片、脱蜡、PBS洗涤后,置于苏木素染液中作用5 min,洗净后用1.0%盐酸乙醇分色,而后放入伊红染液中浸泡。洗涤、脱水后封片,显微镜下观察DRG形态大小及病理改变。
1.3.7 透射电镜观察内质网改变 迅速取出各组大鼠DRG组织,于2.5%戊二醛缓冲液中室温固定4 h,PBS洗涤,于2%四氧化锇中再固定2 h,洗涤、脱水,环氧树脂室温渗透过夜,于树脂中加入催化剂包埋、聚合,切片,透射电镜下观察。
1.4 统计学方法 采用SPSS 26.0软件进行数据分析。正态分布的计量资料用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间多重比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
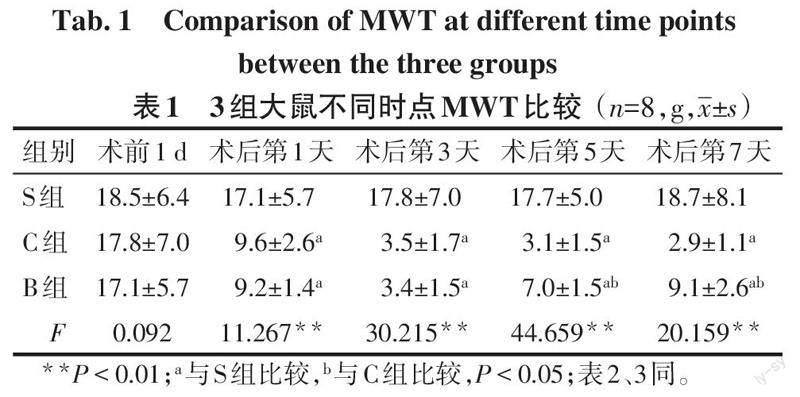
2.1 MWT比较 各组大鼠CCI术前1 d MWT差异无统计学意义。与S组比较,C组、B组CCI术后各时点MWT降低(P<0.05);与C组比较,B组CCI术后第5、7天MWT升高(P<0.05),见表1。
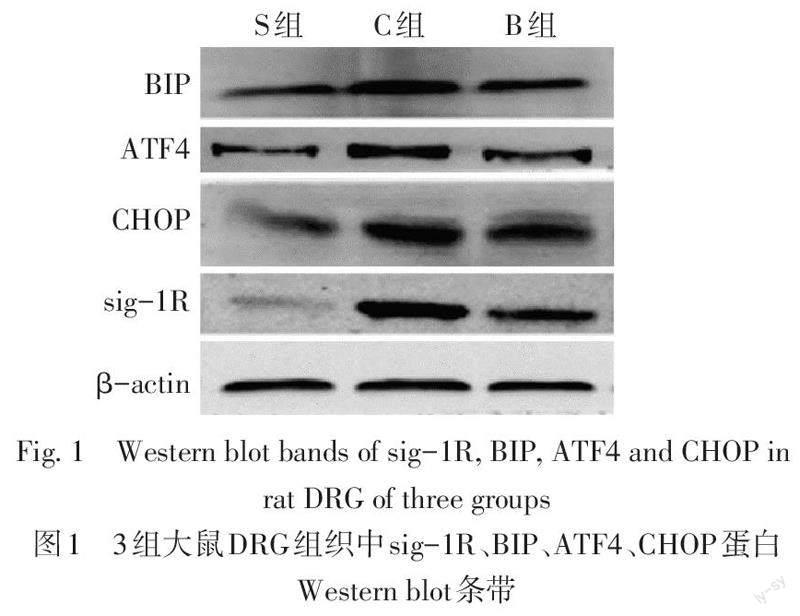
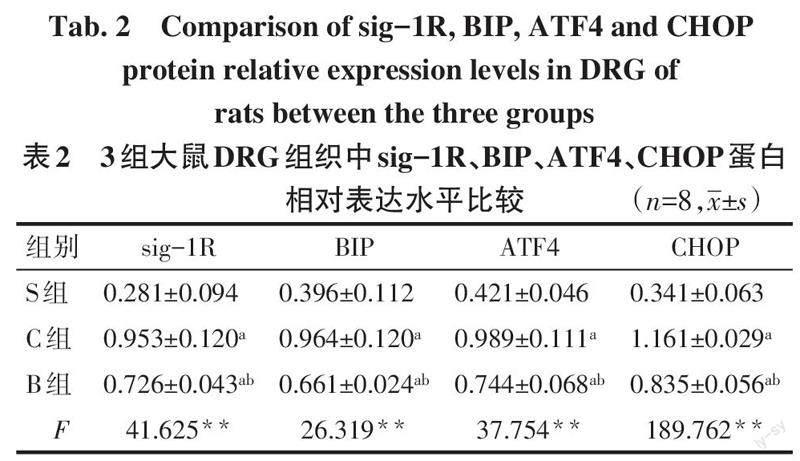
2.2 各组sig-1R、BIP、ATF4、CHOP蛋白的表达水平 与S组比较,C组和B组DRG组织sig-1R、BIP、ATF4、CHOP表达上调(P<0.05);与C组比较,B组DRG sig-1R、BIP、ATF4、CHOP表达下调(P<0.05),见图1、表2。
2.3 sig-1R、BIP、ATF4、CHOP蛋白免疫荧光染色比较 sig-1R、BIP、ATF4、CHOP蛋白均表达于DRG细胞质;与S组比较,C组和B组DRG中sig-1R、BIP、ATF4、CHOP蛋白荧光表达均升高(P<0.05),C组sig-1R富集于细胞膜附近;与C组比较,B组DRG中sig-1R的表达及在细胞膜的富集减少,BIP、ATF4、CHOP表达均降低(P<0.05),见表3、图2。
2.4 DRG组织病理形态表现 HE染色显示,S组大鼠DRG组织神经细胞形态大小正常,细胞核居中;C组DRG神经元明显肿胀,细胞核移位,可见胞质溶解、核固缩;B组DRG神经元肿胀程度较轻,大部分细胞核居中,见图3。
2.5 透射电镜表现 S组DRG神经元内质网结构致密、有大量核糖体附着,无明显脱落,细胞线粒体脊明显,无肿胀水解;C组DRG神经元内质网松散、肿胀、解离,核糖体明显脱落,线粒体脊明显减少甚至消失,线粒体空泡化;B组DRG神经元内质网结构较为致密,核糖体无明显脱落,少数内质网和线粒体轻微肿胀,见图4。
3 讨论
CCI是研究NP的一种常用建模方法,坐骨神经结扎可引起神经水肿及炎症发生,模拟临床上的自发性疼痛、痛觉过敏等症状[8]。本研究中大鼠CCI术后MWT显着降低,并于术后第7天MWT达最低值,而S组MWT无明显变化,提示大鼠NP模型制备成功。本课题组前期研究证实CCI术后第7天疼痛表现最为明显[9]。本研究选择CCI术后第7天取材完成相关指标测定。
sig-1R是一种分子伴侣蛋白,在机体的组织和器官中广泛分布,参与多种细胞功能和生物过程。DRG是疼痛转导和调节的关键结构,sig-1R在DRG中高度表达,与NP的发生密切相关[10-11]。BD1047是选择性sig-1R拮抗剂,在非应激条件下,sig-1R拮抗剂不会改变感觉阈值,也不产生伤害性反应;在细胞应激状态下,sig-1R表达升高并沿内质网迁移到质膜和核膜,与离子通道或受体相互作用。研究表明,抑制sig-1R的表达可以抵抗痛觉过敏,使痛觉阈值恢复到较高水平,从而改善神经病理性疼痛[12-13]。本研究结果显示,制备CCI模型后sig-1R表达水平较S组明显升高,免疫荧光染色可见sig-1R富集于细胞膜附近,表明DRG处于应激状态;与C组比较,B组sig-1R表达水平下调,笔者推测可能是BD1047与sig-1R结合后发生了构象改变,形成了较为紧密的结合体,从而阻断下游信号传导;在检测sig-1R蛋白时,该结合体未能被sig-1R一抗结合,因此检测到的sig-1R表达降低。B组大鼠MWT明显回升,表明抑制sig-1R可以明显改善NP大鼠的痛觉过敏。
ERS是细胞为应对错误折叠蛋白质的异常聚集而激活未折叠蛋白反应(unfolded protein response,UPR)信号的反应过程。BIP是一种驻留在内质网的伴侣蛋白,正常情况下,BIP在内质网中含量较低;当ERS发生时,在压力作用下,BIP释放并激活非折叠蛋白反应,其中包括蛋白激酶R样内质网激酶(PERK)-真核细胞起始因子2α(eIF2α)-ATF4-CHOP通路的激活[14];ATF4会促进CHOP的大量表达,而CHOP是ERS介导细胞死亡的关键蛋白,如果CHOP持续表达,蛋白质合成的增加将导致细胞的氧化应激加剧和细胞凋亡[15]。这是一条经典的ERS通路,可在一定程度上反映细胞凋亡的诱发因素,因此本研究选择测定该通路的相关指标。本课题组前期研究证明,大鼠NP的发生发展与ERS时UPR的激活紧密相关,NP时DRG中的BIP蛋白表达明显上调,并引发一系列的神经炎性反应,产生痛觉过敏,通过抑制ERS可以有效减轻大鼠的神经病理性疼痛[9,16]。本研究结果显示,ERS相关蛋白BIP、ATF4及CHOP在CCI术后表达量明显升高,透射电镜下可见内质网明显肿胀、核糖体脱落等表现,表明CCI术后DRG发生了ERS,进一步可能会出现细胞凋亡,与行为学上出现痛觉过敏表现一致。与C组比较,B组BIP、ATF4及CHOP表达下调,透射电镜下内质网结构破坏较轻微,表明鞘内注射BD1047抑制sig-1R表达,DRG中ERS有所缓解,其疼痛行为也明显改善,但并不能恢复到正常水平。HE染色结果显示C组大鼠CCI术后第7天出现明显的细胞水肿等损伤表现,而B组细胞损伤较轻,说明抑制sig-1R对NP大鼠的DRG细胞有保护作用。
综上所述,sig-1R与NP的发生发展有关,疼痛早期抑制sig-1R表达可以减轻大鼠CCI术后的NP,其机制可能与减轻DRG的ERS有关,这为NP的治疗药物研发提供新的方向。由于NP的形成机制复杂,本研究仅探讨了sig-1R对NP大鼠ERS的作用,未对ERS可能引起的细胞凋亡进行深入研究,以及两者在体外细胞中的关系仍待进一步研究。
参考文献
[1] SZOK D,TAJTI J,NY?RI A,et al. Therapeutic approaches for peripheral and central neuropathic pain[J]. Behav Neurol,2019,2019:8685954. doi:10.1155/2019/8685954.
[2] 刘可鹏,罗金辉,农小连,等. 鞘内注射Salubrinal对大鼠神经病理性痛的影响[J]. 中华麻醉学杂志,2020,40(10):1246-1250. LIU K P,LUO J H,NONG X L,et al. Effects of intrathecal salubrinal on neuropathic pain in rats[J]. Chin J Anesthesiol,2020,40(10):1246-1250. doi:10.3760/cma.j.cn131073.20200522.01023.
[3] DELPRAT B,CROUZIER L,SU T P,et al. At the crossing of ER stress and MAMs:A key role of sigma-1 receptor?[J]. Adv Exp Med Biol,2020,1131:699-718. doi:10.1007/978-3-030-12457-1_28.
[4] 杜宜楠,王砾莹,刘志强. Sigma-1受体在慢性疼痛中的调节作用及其神经机制[J]. 中国生物化学与分子生物学报. 2021,37(4):458-466. DU Y N,WANG S Y,LIU Z Q. Regulation of the Sigma-1 receptor on chronic pain and its neuromechanism[J]. Chinese Journal of Biochemistry and Molecular Biology,2021,37(4):458-466. doi:10.13865/j.cnki.cjbmb.2020.11.1362.
[5] GRIS G,PORTILLO-SALIDO E,AUBEL B,et al. The selective sigma-1 receptor antagonist E-52862 attenuates neuropathic pain of different aetiology in rats[J]. Sci Rep,2016,6:24591. doi:10.1038/srep24591.
[6] HOU Y,WANG L,GAO J,et al. A modified procedure for lumbar intrathecal catheterization in rats[J]. Neurol Res,2016,38(8):725-732. doi:10.1080/01616412.2016.1196870.
[7] ZHONG Y,CHEN J,CHEN J,et al. Crosstalk between Cdk5/p35 and ERK1/2 signalling mediates spinal astrocyte activity via the PPARγ pathway in a rat model of chronic constriction injury[J]. J Neurochem,2019,151(2):166-184. doi:10.1111/jnc.14827.
[8] NONG X,LAN Y. Picroside II attenuates CCI-induced neuropathic pain in rats by inhibiting spinal reactive astrocyte-mediated neuroinflammation through the NF-κB pathway[J]. Neurochem Res,2018,43(5):1058-1066. doi:10.1007/s11064-018-2518-7.
[9] 罗金辉,农小连,刘可鹏,等. 大鼠神经病理性痛时外周神经BIP与Nav1.8的关系[J]. 中华麻醉学杂志,2020,40(1):87-91. LUO J H,NONG X L,LIU K P,et al. Relationship between BIP and Nav1.8 in peripheral nerve in a rat model of neuropathic pain[J]. Chin J Anesthesiol,2020,40(1):87-91. doi:10.3760/cma.j.issn.0254-1414.2020.01.021.
[10] S?NCHEZ-FERN?NDEZ C,MONTILLA-GARC?A ?,GONZ?LEZ-CANO R,et al. Modulation of peripheral μ-opioid analgesia by σ1 receptors[J]. J Pharmacol Exp Ther,2014,348(1):32-45. doi:10.1124/jpet.113.208272.
[11] ESPOSITO M F,MALAYIL R,HANES M,et al. Unique characteristics of the dorsal root ganglion as a target for neuromodulation[J]. Pain Med,2019,20(Suppl 1):S23-S30. doi:10.1093/pm/pnz012.
[12] MERLOS M,BURGUE?O J,PORTILLO-SALIDO E,et al. Pharmacological modulation of the sigma 1 receptor and the treatment of pain[J]. Adv Exp Med Biol,2017,964:85-107. doi:10.1007/978-3-319-50174-1_8.
[13] MERLOS M,ROMERO L,ZAMANILLO D,et al. Sigma-1 receptor and pain[J]. Handb Exp Pharmacol,2017,244:131-161. doi:10.1007/164_2017_9.
[14] IBRAHIM I M,ABDELMALEK D H,ELFIKY A A. GRP78:A cell's response to stress[J]. Life Sci,2019,226:156-163. doi:10.1016/j.lfs.2019.04.022.
[15] HAN J,BACK S H,HUR J,et al. ER-stress-induced transcriptional regulation increases protein synthesis leading to cell death[J]. Nat Cell Biol,2013,15(5):481-490. doi:10.1038/ncb2738.
[16] 傅文,农小连,刘可鹏,等. GSK-3β在大鼠背根神经节神经元细胞内质网应激中的作用机制研究[J]. 广西医科大学学报,2021,38(10):1871-1875. FU W,NONG X L,LIU K P,et al. Study on the mechanism of GSK-3β in the endoplasmic reticulum stress of rat DRG neurons[J]. Journal of Guangxi Medical University,2021,38(10):1871-1875. doi:10.16190/j.cnki.45-1211/r.2021.10.007.
(2022-09-15收稿 2022-10-28修回)
(本文编辑 李志芸)



