宋玉,朱争艳,黄桓,李春,鲁晶泉,刘和宇,胡丽娜
多囊卵巢综合征(PCOS)作为高发于育龄期女性的一种内分泌代谢紊乱性疾病,严重危害女性身体健康[1-2]。研究表明,炎症是其发病的危险因素之一,抗炎和抗氧化治疗可有效改善PCOS大鼠卵巢多囊样改变、肥胖和激素紊乱等症状[3-4]。Klotho 是体内的一种单向跨膜蛋白,可增强胰岛素敏感性,起到抗凋亡、抗氧化应激、抗衰老和抗炎等作用,Klotho缺失会诱导炎症反应和细胞凋亡,干扰细胞新陈代谢,导致小鼠早衰[5],且Klotho 在PCOS 患者血清中水平降低,与PCOS 的发生关系密切[6]。研究显示,Wnt/β-Catenin 及MEK/ERK 是Klotho 的下游信号通路,参与介导Klotho 对炎症的调控过程[5,7]。另外,Wnt/β-Catenin 和MEK/ERK 信号通路之间存在串扰,两者相互作用并参与调控细胞凋亡和胚胎发育过程,激活Wnt/β-Catenin 信号通路和抑制MEK/ERK 信号通路可导致囊胚细胞凋亡率升高[8],且Wnt/β-Catenin 和MEK/ERK 参与介导PCOS 发病过程,下调Wnt/β-Catenin可改善PCOS症状[9],而ERK信号传导受限可引发PCOS 患者排卵功能和代谢障碍[10],由此推测通过Klotho下调Wnt/β-Catenin及激活MEK/ERK 信号可能是PCOS 的潜在治疗策略。虾青素是一种天然酮基类胡萝卜素,具有抗氧化、提高免疫力、抗炎等生物学功效,可有效清除活性氧及自由基,抑制炎性信号激活,改善动物精子活力及生殖激素分泌,从而提高其生殖性能[11],还可通过调控Wnt/β-Catenin等信号来防治肝脏缺血再灌注损伤、非酒精性脂肪肝等肝脏疾病[12]。本研究通过构建PCOS 大鼠模型,探究虾青素能否通过Klotho 调节Wnt/β-Catenin和MEK/ERK信号改善PCOS症状。
1 材料与方法
1.1 材料
1.1.1 实验动物 健康雌性SPF 级SD 大鼠95 只,6~7 周龄,体质量190~220 g,购自湖南斯莱克景达实验动物有限公司,动物生产许可证号:SCXK(湘)2019-0004。在本院动物房中分笼适应饲养,每笼大鼠不超过4 只,温度23~25 ℃,湿度50%~60%,通风换气10~12次/h,并且室内维持屏障环境。
1.1.2 试剂与仪器 来曲唑(纯度98%)、虾青素(纯度≥98%)、羧甲基纤维素钠(黏度:800~1 200 mPa·s)、氯化锂(纯度≥98.0%)以及大鼠白细胞介素(IL)-18、IL-17、肿瘤坏死因子(TNF)-α、前列腺素E2(PGE2)酶联免疫吸附试验(ELISA)试剂盒购自北京索莱宝科技有限公司;PD98059(纯度98.22%)购自美国MCE 公司;Klotho siRNA 质粒及其空载质粒购自苏州吉玛基因股份有限公司;大鼠黄体生成素(LH)、卵泡刺激素(FSH)、睾酮(T)ELISA 试剂盒及HE 染色试剂盒购自生工生物工程(上海)股份有限公司;兔抗大鼠GAPDH抗体、BCA 蛋白检测试剂盒、重组兔抗大鼠β-Catenin 抗体、兔抗大鼠p-MEK 抗体、兔抗大鼠ERK 抗体、兔抗大鼠Wnt1抗体、兔抗大鼠MEK 抗体、兔抗大鼠Klotho 抗体、兔抗大鼠p-ERK 抗体、HRP 偶联羊抗兔二抗购自英国Abcam 公司;二辛可宁酸(BCA)蛋白浓度测定试剂盒购自上海碧云天生物科技有限公司。
酶联免疫检测仪(型号JD-SY96A,山东竞道光电科技有限公司);加热石蜡包埋机(型号G1150H)、病理轮转切片机(型号RM2035)、生物光学显微镜(型号DM3000)、全自动脱水机(型号ASP200S)购自德国Leica公司;电泳仪基础电源与小型蛋白电泳转膜系统(型号PROTEAN)、凝胶成像系统(型号GelDocEZ)购自美国Bio-Rad公司;高速冷冻离心机(型号Fresco 21)购自美国Thermo Fisher公司。
1.2 方法
1.2.1 构建PCOS模型大鼠并分组处理后检测其体质量与卵巢质量 参照文献[13],取32 只SD 大鼠,1 mg/kg 来曲唑溶液(溶于1%羧甲基纤维素钠)灌胃,1 次/d,连续灌胃21 d。于造模第17 天开始每天上午7:00—8:00 收集阴道分泌物,制成阴道涂片后进行瑞氏染色,镜下观察各细胞形态及其比例,连续观察5 d,若阴道涂片无动情周期性改变并基本维持在动情间期,且尾静脉采血检测血清T水平显示较正常大鼠明显升高,提示造模成功。将造模成功的30只大鼠以随机数字表法分为模型组,虾青素低、中、高剂量组,虾青素高剂量+空载组,虾青素高剂量+Klotho敲低组,每组5只,另取5只SD大鼠灌胃等剂量1%羧甲基纤维素钠溶液作为对照组。
将虾青素和质粒溶于生理盐水制成溶液,虾青素低、中、高剂量组分别以50、100、200 mg/kg 虾青素灌胃(1 次/d)[14],同时尾静脉注射与虾青素高剂量+Klotho 敲低组相等剂量的生理盐水(2 次/周);虾青素高剂量+空载组、虾青素高剂量+Klotho敲低组分别尾静脉注射空载质粒和Klotho siRNA质粒溶液(2次/周),同时均以200 mg/kg虾青素灌胃(1次/d);模型组、对照组以10 mL/kg生理盐水灌胃(1次/d),同时尾静脉注射与虾青素高剂量+Klotho敲低组相等剂量的生理盐水(2次/周),各组大鼠均处理3周后称体质量,然后以乙醚麻醉后断头处死,解剖取出卵巢称质量。
1.2.2 再次构建PCOS 模型大鼠后分组处理 取49 只SD 大鼠,再次以同样的方法成功构建PCOS 模型大鼠45 只,将其以随机数字表法分为模型组、虾青素组(200 mg/kg)、虾青素(200 mg/kg)+Klotho 敲低组、虾青素+氯化锂组、虾青素+PD98059组,每组9只,另取9只SD大鼠灌胃等剂量1%羧甲基纤维素钠溶液作为对照组。对照组、模型组、虾青素组和虾青素+Klotho敲低组处理方法同1.2.1;虾青素+氯化锂组以200 mg/kg虾青素灌胃,同时尾静脉注射与虾青素高剂量+Klotho敲低组相等剂量的生理盐水(2 次/周)并腹腔注射15 mg/kg氯化锂(1 次/d)[15];虾青素+PD98059 组大鼠以200 mg/kg 虾青素灌胃(1 次/d),同时尾静脉注射与虾青素高剂量+Klotho敲低组相等剂量的生理盐水(2 次/周)并腹腔注射10 mg/kg的PD98059(1次/d)[16];各组大鼠均处理3周。
1.2.3 体质量、卵巢质量与体积测定及标本采集 将1.2.2中各组大鼠于3周处理结束后24 h,称其体质量,接着以乙醚麻醉后采集尾静脉血,离心(2 000 r/min、4 ℃、15 min)后获得血清于-80 ℃冰箱中保存备用;将大鼠断头处死,解剖取出卵巢并称质量,测长径(L)和短径(H),计算卵巢体积,体积=(π/6)×L×H2。然后剪取0.8 g卵巢组织于液氮中保存备用,剩余卵巢组织常规固定并脱水,石蜡包埋后切片备用。
1.2.4 卵巢组织囊状卵泡数量检测 将1.2.3 中的卵巢组织切片浸入二甲苯中脱蜡,梯度乙醇水化,按试剂盒说明书进行HE染色,在光学显微镜下观察卵巢形态,随机读取5个视野拍照,使用Image J 软件分析图像,定量每组大鼠每个视野卵巢组织囊状卵泡数量,取平均值。
1.2.5 血清FSH、LH、T、PGE2、IL-17、TNF-α、IL-18 水平测定 将1.2.3 中血清提前取出后放入冰水浴中缓慢解冻,取0.4 mL 采用ELISA 试剂盒测定FSH、LH、T、PGE2、IL-17、TNF-α、IL-18水平,操作步骤严格依照各自说明书进行。
1.2.6 卵巢组织Klotho 蛋白和Wnt/β-Catenin、MEK/ERK 信号相关蛋白检测 将1.2.3中冻存在液氮中的卵巢组织块取出,剪碎,研磨,匀浆,离心(3 000 r/min、4 ℃、20 min)后获得卵巢组织蛋白样品液。测量其蛋白总浓度后煮沸使蛋白变性,每组取30 μg 总蛋白通过电泳分离,再通过电泳转移到PVDF 膜上,将Klotho、GAPDH、Wnt1、β-Catenin、p-MEK、MEK、p-ERK1/2、ERK1/2 蛋白条带裁下后封闭其非特异抗原,以各自兔抗大鼠一抗和山羊抗兔二抗孵育进行抗原抗体反应,化学发光法显色后以凝胶成像系统采集各组蛋白条带图像,采用Image J软件分析相对表达水平。
1.3 统计学方法 采用GraphPad Prism 8.0.1 软件进行数据分析,符合正态分布的计量数据均采用均数±标准差()表示,多组间比较采用单因素方差分析,组间多重比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 虾青素对大鼠体质量与卵巢质量的影响 与对照组比较,模型组的体质量与卵巢质量明显升高(P<0.05);与模型组比较,虾青素低、中、高剂量组的体质量与卵巢质量均降低,并呈剂量依赖性(P<0.05);与虾青素高剂量组比较,虾青素高剂量+Klotho 敲低组的体质量与卵巢质量升高(P<0.05),虾青素高剂量+空载组体质量与卵巢质量无明显变化(P>0.05),见表1。
Tab.1 Comparison of body mass and ovary mass of rats between the seven groups表1 各组大鼠体质量与卵巢质量比较(n=5,)
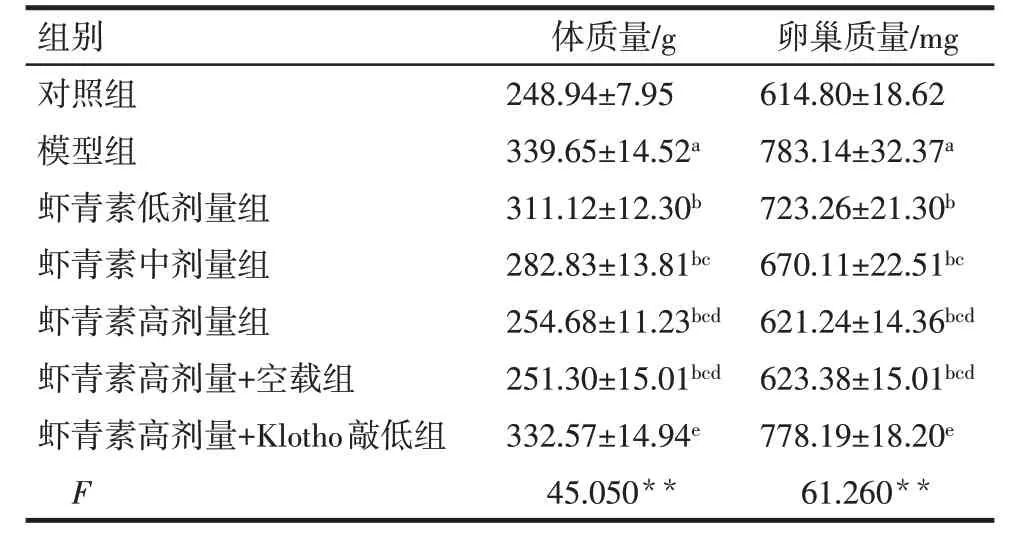
Tab.1 Comparison of body mass and ovary mass of rats between the seven groups表1 各组大鼠体质量与卵巢质量比较(n=5,)
**P<0.01;a与对照组比较,b与模型组比较,c与虾青素低剂量组比较,d与虾青素中剂量组比较,e与虾青素高剂量组比较,P<0.05。
?
2.2 各组大鼠体质量、卵巢质量与体积比较 与对照组比较,模型组体质量、卵巢质量与体积明显升高(P<0.05);与模型组比较,虾青素组体质量、卵巢质量与体积降低(P<0.05);与虾青素组比较,虾青素+Klotho 敲低组、虾青素+氯化锂组、虾青素+PD98059组体质量、卵巢质量与体积升高(P<0.05),见表2。
Tab.2 Comparison of body mass,ovarian mass and volume of rats between the six groups表2 各组大鼠体质量、卵巢质量与体积比较(n=9,)

Tab.2 Comparison of body mass,ovarian mass and volume of rats between the six groups表2 各组大鼠体质量、卵巢质量与体积比较(n=9,)
**P<0.01;a与对照组比较,b与模型组比较,c与虾青素组比较,P<0.05;表3—5同。
?
2.3 各组大鼠血清激素水平与卵巢组织囊状卵泡数量比较 与对照组比较,模型组血清FSH 水平明显降低,LH、T水平与卵巢组织囊状卵泡数量明显升高(P<0.05);与模型组比较,虾青素组血清FSH 水平升高,LH、T 水平与卵巢组织囊状卵泡数量降低(P<0.05);与虾青素组比较,虾青素+Klotho 敲低组、虾青素+氯化锂组、虾青素+PD98059组血清FSH水平均降低,LH、T水平与卵巢组织囊状卵泡数量均升高(P<0.05),见图1、表3。

Fig.1 Histomorphology of ovaries of rats in each group observed by HE staining(×200)图1 HE染色观察各组大鼠卵巢组织形态(×200)
Tab.3 Comparison of serum FSH,LH,T levels and number of follicles in ovarian tissue between the six groups表3 各组大鼠血清FSH、LH、T水平与卵巢组织囊状卵泡数量比较(n=9,)

Tab.3 Comparison of serum FSH,LH,T levels and number of follicles in ovarian tissue between the six groups表3 各组大鼠血清FSH、LH、T水平与卵巢组织囊状卵泡数量比较(n=9,)
?
2.4 各组大鼠血清炎性因子水平比较 与对照组比较,模型组血清PGE2、IL-17、TNF-α、IL-18 水平升高(P<0.05);与模型组比较,虾青素组血清PGE2、IL-17、TNF-α、IL-18 水平降低(P<0.05);与虾青素组比较,虾青素+Klotho敲低组、虾青素+氯化锂组、虾青素+PD98059 组血清PGE2、IL-17、TNFα、IL-18水平均升高(P<0.05),见表4。
Tab.4 Comparison of serum PGE2,IL-17,TNF-α and IL-18 levels of rats between the six groups表4 各组大鼠血清PGE2、IL-17、TNF-α、IL-18水平比较(n=9,ng/L,)

Tab.4 Comparison of serum PGE2,IL-17,TNF-α and IL-18 levels of rats between the six groups表4 各组大鼠血清PGE2、IL-17、TNF-α、IL-18水平比较(n=9,ng/L,)
?
2.5 各组大鼠卵巢组织Klotho 和Wnt/β-Catenin、MEK/ERK信号相关蛋白表达比较 与对照组比较,模型组卵巢组织Klotho、p-MEK、p-ERK1/2 蛋白表达降低,Wnt1、β-Catenin 蛋白表达升高(P<0.05)。与模型组比较,虾青素组卵巢组织Klotho、p-MEK、p-ERK1/2蛋白表达升高,Wnt1、β-Catenin蛋白表达降低(P<0.05)。与虾青素组比较,虾青素+Klotho敲低组卵巢组织Klotho、p-MEK和p-ERK1/2蛋白表达降低,Wnt1、β-Catenin 蛋白表达升高(P<0.05);虾青素+氯化锂组、虾青素+PD98059 组卵巢组织Klotho 蛋白表达差异无统计学意义,p-MEK、p-ERK1/2 表达降低,Wnt1、β-Catenin 蛋白表达升高(均P<0.05),见图2、表5。

Fig.2 Expression of Klotho protein and Wnt/β-Catenin,MEK/ERK signal related protein in ovarian tissue of rats in each group detected by Western blot assay图2 免疫印迹检测各组大鼠卵巢组织Klotho蛋白表达和Wnt/β-Catenin、MEK/ERK信号相关蛋白表达
Tab.5 Comparison of the relative expression level of Klotho,Wnt/β-Catenin,MEK/ERK signal related proteins in ovaries of rats between the six groups表5 各组大鼠卵巢组织Klotho蛋白和Wnt/β-Catenin、MEK/ERK信号相关蛋白相对表达水平比较(n=9,)

Tab.5 Comparison of the relative expression level of Klotho,Wnt/β-Catenin,MEK/ERK signal related proteins in ovaries of rats between the six groups表5 各组大鼠卵巢组织Klotho蛋白和Wnt/β-Catenin、MEK/ERK信号相关蛋白相对表达水平比较(n=9,)
?
3 讨论
PCOS临床治疗以激素类药物为主,但长期应用存在较多不良反应且停药后易复发。本研究通过对SD 大鼠灌胃来曲唑的方法构建PCOS 模型,大鼠血清FSH 水平降低,体质量、卵巢质量与体积、囊状卵泡数量以及血清LH、T、PGE2、IL-17、TNF-α、IL-18水平升高,说明来曲唑可促使炎性因子表达,引发炎症反应,诱导大鼠出现雄性激素升高等性激素分泌异常、肥胖及卵巢多囊样病变症状,损伤卵巢形态功能,提示PCOS模型构建成功。虾青素是提取自海洋生物的一种天然次生类胡萝卜素,抗氧化、抗炎作用明显,具有药用价值,可明显降低活性氧及自由基水平,阻断炎性信号活化传导,减轻动物机体氧化应激及炎性损害,并可改善动物生殖激素平衡及其生殖能力[11],还可通过抑制活性氧产生及炎症反应而减轻碘海醇诱导的肾细胞凋亡和急性肾损伤[17]。本研究结果显示,以不同剂量虾青素处理PCOS 大鼠,可呈剂量依赖性降低其体质量与卵巢质量;另外以200 mg/kg 虾青素处理PCOS 大鼠,可升高其血清FSH 水平,降低体质量、卵巢质量与体积、囊状卵泡数量以及血清LH、T、PGE2、IL-17、TNF-α、IL-18 水平,表明虾青素可降低炎性因子表达,抑制炎症,改善性激素分泌异常、肥胖及卵巢多囊样病变症状。
Klotho是一种具有抗衰老、抗凋亡、抗氧化和抗炎等功效的跨膜蛋白,在PCOS患者中Klotho表达降低,且Klotho 的缺失可引发下丘脑-垂体-卵巢轴功能障碍,导致性激素分泌异常、卵巢早衰和多囊样病变等,在包括PCOS在内的女性生殖疾病发生和进展中起到关键作用[6,18]。研究显示Klotho 可通过调控Wnt/β-Catenin 及MEK/ERK 信号介导炎症的发生,上调Klotho 可阻止Wnt/β-Catenin 激活,从而降低炎性因子表达,改善慢性肾脏疾病大鼠症状[7],还可激活MEK 信号,进而抑制炎症和延缓衰老过程[5,19]。另外Wnt/β-Catenin 和ERK 信号在PCOS 患者体内表达失调,Wnt/β-Catenin 上调和ERK 失活与PCOS发病机制有关,抑制Wnt/β-Catenin信号可用于治疗PCOS[9-10]。倪晓锋等[20]研究显示,虾青素可通过激活ERK信号来减轻H2O2诱导的PC-3细胞氧化应激损伤。王群[12]研究显示,虾青素可通过调控Wnt/β-Catenin 信号发挥肝脏疾病治疗作用,由此可预测虾青素改善PCOS 大鼠症状的药理机制可能是通过上调Klotho 而引发Wnt/β-Catenin 下调及MEK/ERK 信号激活。本研究结果显示,PCOS模型大鼠卵巢组织Klotho、p-MEK 和p-ERK1/2 蛋白表达降低,Wnt1 与β-Catenin 蛋白表达明升高,而虾青素可消除PCOS大鼠上述蛋白变化趋势,表明Klotho 和Wnt/β-Catenin、MEK/ERK 信号参与介导虾青素对PCOS 大鼠症状的改善过程。以虾青素处理PCOS 大鼠的同时敲低Klotho,可减弱虾青素的抗炎活性,消除其对PCOS大鼠性激素分泌异常、肥胖及卵巢多囊样病变症状的改善作用,逆转其对PCOS 大鼠的治疗功效;另外Wnt/β-Catenin 激活剂氯化锂、MEK/ERK 信号抑制剂PD98059与敲低Klotho的作用相似;氯化锂、PD98059 不会影响大鼠卵巢组织Klotho 蛋白表达,但氯化锂可抑制MEK/ERK 信号通路激活,PD98059可促使Wnt/β-Catenin信号通路激活升高,说明Wnt/β-Catenin 和MEK/ERK 是Klotho 下游信号,而Wnt/β-Catenin 和MEK/ERK 之间存在串扰,可相互作用调控彼此表达,提示虾青素改善PCOS大鼠症状的作用机制是通过上调Klotho 导致Wnt/β-Catenin 失活及MEK/ERK信号激活。
综上所述,虾青素可通过上调Klotho 而使Wnt/β-Catenin 信号失活及MEK/ERK 信号激活,从而减少炎性因子表达释放,阻止炎症发生发展,最终减轻PCOS大鼠性激素分泌异常、肥胖及卵巢多囊样病变症状,对PCOS大鼠起到治疗作用。但Klotho的具体调节机制还未研究清楚,还需深入探讨。



