何广宁 吴永定 陈果 蔡志煅 曾彦茹 江福能
523059东莞,南方医科大学附属东莞人民医院肿瘤外科(何广宁);510180 广州,广州医科大学公共卫生学院(吴永定);510180 广州,广州医科大学附属广州市第一人民医院泌尿外科 广东省临床分子医学及分子诊断重点实验室(陈果,曾彦茹,江福能);510515 广州,南方医科大学南方医院 广东省肾脏病研究所(蔡志煅)
NEK2对前列腺癌细胞增殖的影响
何广宁吴永定陈果蔡志煅曾彦茹江福能
523059东莞,南方医科大学附属东莞人民医院肿瘤外科(何广宁);510180 广州,广州医科大学公共卫生学院(吴永定);510180 广州,广州医科大学附属广州市第一人民医院泌尿外科 广东省临床分子医学及分子诊断重点实验室(陈果,曾彦茹,江福能);510515 广州,南方医科大学南方医院 广东省肾脏病研究所(蔡志煅)
【摘要】目的探讨中心体相关激酶2(NEK2)在良性前列腺上皮细胞和前列腺癌细胞中的表达差异,及NEK2对前列腺癌细胞增殖的影响。方法运用荧光实时定量PCR检测NEK2在良性前列腺上皮细胞PrEC和前列腺癌细胞PC3、LNCaP和DU145中的表达情况,通过短发夹RNAs(shRNA)抑制LNCaP细胞株中内源性NEK2的表达,再利用细胞增殖实验及裸鼠肿瘤种植检测LNCaP增殖情况。结果前列腺癌细胞PC3、LNCaP和DU145中的NEK2表达水平均比良性前列腺上皮细胞PrEC增加(P均<0.01)。shRNA技术构建的NEK2表达在LNCaP细胞中下调, NEK2 mRNA和蛋白表达水平均下降(P均<0.01)。细胞增殖实验显示,培养至72 h时shNEK2的细胞增殖率明显低于注射无关序列的LNCaP(Scrambled)细胞。体内试验显示,shNEK2组的移植瘤体积明显小于Scrambled细胞,shNEK2组移植瘤的NEK2蛋白表达比Scrambled组下调(P<0.01)。结论NEK2的过度表达能促进前列腺癌细胞的增殖,NEK2有望作为前列腺癌治疗的潜在生物学标志物。
【关键词】前列腺癌;中心体相关激酶2;细胞增殖
前列腺癌的发生、发展是环境的刺激和众多基因的变异共同作用的结果[1]。正常细胞转变成癌细胞的过程和抑癌基因的失活、原癌基因的激活和信号转导基因、DNA修复相关基因及生长因子基因的突变及细胞周期的控制有关。中心体相关激酶2(NEK2) 是细胞周期调控蛋白激酶家族成员之一[2]。NEK2除了分离中心体,在有丝分裂的启动阶段具有调节中心体中微管构成的作用[3-4]。NEK2能加快中心体蛋白(NIP)的移位。另外,NEK2也可能加速了有丝分裂中微管核化所必需的蛋白的补充[5]。因此,NEK2不仅是分裂间期中心体的一个关键组件,而且还是中心体自身装配及检修所必需的[6]。我们迫切需要深入研究和探索介导促进前列腺肿瘤细胞增殖的分子生物学机制,找到潜在的治疗靶标,为前列腺癌的分子靶向治疗提供理论依据。本课题组在前期研究miR-195的表达谱芯片时,筛选了一批下调基因,结合Taylor数据库统计,发现NEK2与miR-195临床表达呈高度负相关,本研究观察了NEK2在良性前列腺上皮细胞及前列腺癌细胞中表达水平的差异,旨在探讨NEK2对前列腺癌细胞增殖的影响。
材料与方法
一、细胞株与实验动物
3种前列腺癌细胞株(PC3、DU145、LNCaP)为2012年从美国马纳萨斯学院(Manassas, VA, USA)的美国模式培养物集存库 (ATCC)购买所得,而良性前列腺上皮细胞系PrEC是从瑞士Lonza 公司购买,从公司购买的细胞株均由公司负责鉴定和包装,并在细胞复苏3个月内送到实验室。所有细胞株均在10% 胎牛血清、5%CO2、37℃的条件下培养。裸鼠购于广东省医学实验动物中心,饲养于广州医科大学动物实验中心,所有操作均符合动物伦理要求。
二、主要试剂
细胞培养所需试剂全部购于美国Gibco公司,核酸蛋白提取试剂盒、SYBR GreenⅠPCR试剂盒以及蛋白免疫印迹所用试剂全部购于日本Takara公司,FuGENE转染试剂购于美国Promega公司,全部引物由上海生工生物技术有限公司合成,细胞计数试剂盒(CCK)-8购于碧云天生物技术研究所, NEK2抗体 (bs-5732R)购于北京博奥森生物技术有限公司。
三、 方法
1. 细胞RNA提取和质控
采用Trizol法,将样本按照说明书要求提取PC3、DU145、LNCaP 、PrEC的RNA,所得RNA经美国安捷伦2100生物分析仪及配套试剂RNA6000 Nano检测电泳鉴定,将RNA条带清晰、RNA完整性计数≥6.0并且 28S/18S>0.7的样本保存备用。
2. 实时荧光定量PCR
采用一步法实时荧光定量PCR(RT-PCR),使用PC3、DU145、LNCaP及PREC mRNA的逆转录产物为模板,分别扩增目的基因,检测并验证NEK2 mRNA在前列腺癌细胞中的表达水平,所有数据分析采用美国Bio-Rad 公司的Opticon Monitor software 3.1版。
3. 细胞株构建与验证
按照试剂盒说明书用短发夹RNA(shRNA)转染LNCaP(shNEK2)。使用蛋白免疫印迹法验证NEK2蛋白表达强度:转染48 h后提取蛋白,进行十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳,然后将凝胶上的蛋白转移至膜上,封闭,加入抗体孵育后与发光液充分反应,曝光并将结果扫描后用图像分析系统处理,β-actin 用作内参对照。设PrEC为阴性对照、未转染的LNCaP为阳性对照、转染无关序列的LNCaP(Scrambled)为阴性对照。通过RT-PCR验证shNEK2及Scrambled的NEK2 mRNA表达水平。引物序列:NEK2上游5’- GCTTAGGTAGCCCTTTTCATTTACA-3’、下游5’-GCCTCAGGTCTATGAACCCAG-3’,长度1 155 bp;GA-PDH上游5’-CATGGGTGTGAACCATGAGAAGT-3’、下游5’-ACAGTAGAGGCAGGGATGATGTTCT-3’。
4. LNCaP增殖情况检测
按照CCK-8试剂盒说明书把细胞接种到96孔板,按步骤加入试剂后使用ELISA法测定各孔光密度。
5. 裸鼠肿瘤模型构建及检测
在裸鼠的左右两侧分别注射sh-NEK2(sh-NEK2组)与Scambled(Scrambled组)各2×106个。植入细胞43 d后,收集肿瘤组织使用卡尺测量肿瘤进行免疫组织化学检测。
四、统计学处理
结果
一、NEK2 mRNA在PrEC、LNCaP、DU145和PC3中的表达情况
NEK2在前列腺癌细胞DU145、 LNCap、PC3中的表达水平分别为0.76±0.08、0.96±0.02、0.84±0.05,均高于前列腺上皮细胞PrEC中的0.35±0.04(t分别为12.965、38.580、21.645,P均<0.001)。前列腺癌细胞中,LNCaP的NEK2表达水平分别高于DU145及PC3 (t分别为6.860、6.303,P均<0.001),见图1。
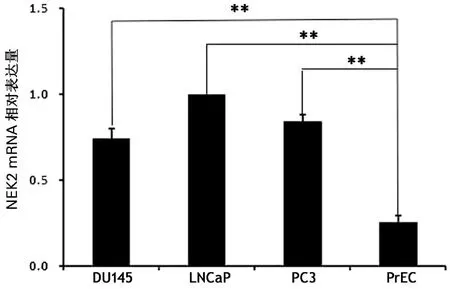
图1 NEK2在人类前列腺癌和前列腺增生
与PrEC比较,**P<0.01
二、NEK2在PrEC、LNCaP、Scramble和shNEK2中的表达
shRNA-LNCaP中NEK2蛋白表达强度均低于PrEC、LNcap、Scrambled细胞,其mRNA表达水平为1.01±0.01,亦低于Scrambled细胞的0.12±0.02(t=11.258,P<0.001),提示实验组LNCaP的NEK2表达被成功抑制,见图2。
三、NEK2对LNCaP增殖的影响
1. 体外试验
培养至72 h时,shNEK2的细胞增殖(18.1±5.3)%,低于Scrembled组的(41.2±1.7)% (t=3.951,P<0.001) 。
2. 接种shNEK2和Scrambled的裸鼠移植瘤比较
裸鼠分别皮下注射Scrambled和shNEK2细胞43 d后,shNEK2组的移植瘤体积小于Scrambled组,见图3。shNEK2组移植瘤的NEK2蛋白表达比Scrambled组下调(4.82±0.06vs. 1.37±0.02,t=94.482,P<0.001),见图4。
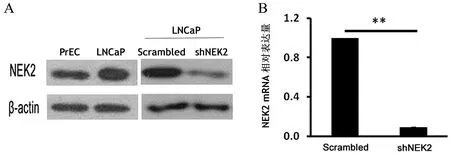
图2 NEK2在PrEC、LNCaP、Scrambled和shNEK2中的表达
A:蛋白免疫印迹结果;B:RT-PCR结果;**P<0.01
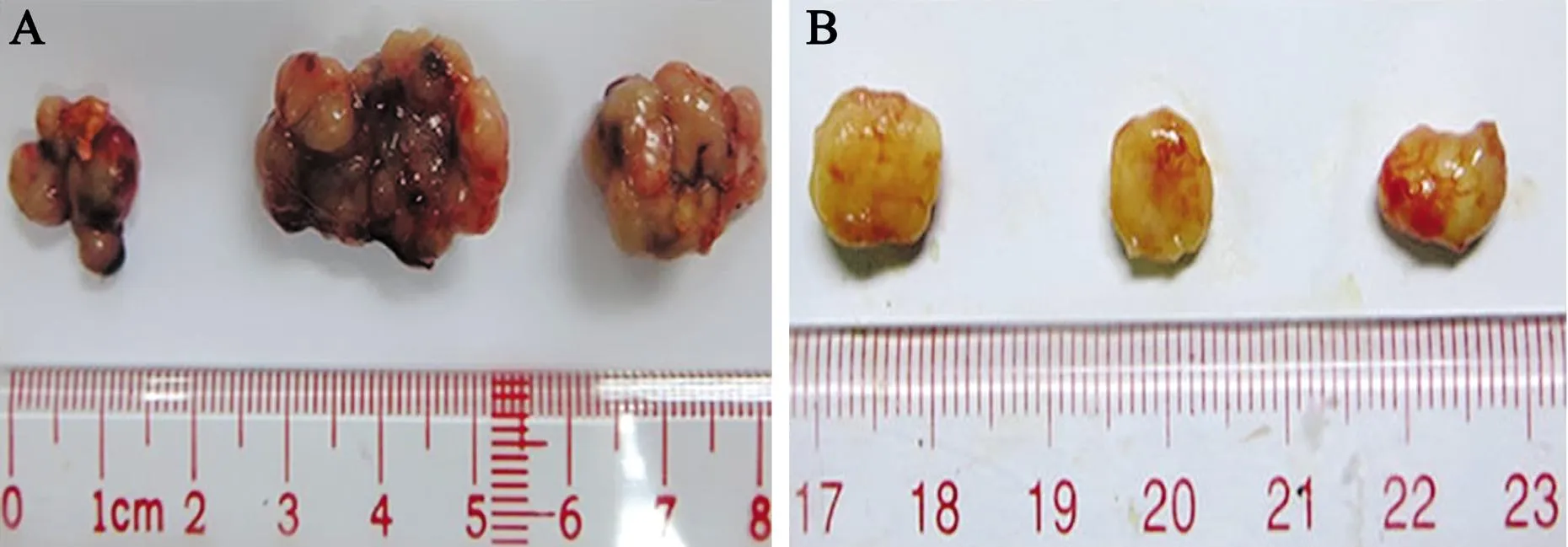
图3 Scrambled组和shNEK2组的移植瘤体积比较
A:Scrambled组;B:shNEK2组
讨论
异常中心体几乎存在于所有的人类肿瘤中。有学者认为,中心体异常可能引起染色体不稳定性的发生,由此增加了野生型抑癌基因丢失和原癌基因突变的几率[7]。因此,染色体有丝分裂的操纵失控是多种恶性肿瘤发生、发展的中心环节。目前公认的中心体相关激酶家族包括Polo样激酶家族、Aurora蛋白激酶家族及NIMA相关激酶家族[8]。有研究显示,NEK2在细胞周期调控尤其在中心体周期调控方面起着重要作用[9],NEK2不仅是分裂间期中心体的一个关键组件,而且还是中心体自身装配及检修所必需的酶[6]。已有研究指出,有活性的NEK2可能使不成熟中心体的分离,导致2代中心粒间的内聚力丧失[10]。无活性的NEK2会导致单极纺锤体、异常中心体及非整倍体的形成[11]。上述研究显示,NEK2可影响肿瘤的发生过程。
目前已发现,在包括肾癌、 胆管癌、 睾丸癌、乳腺癌、卵巢癌等各种肿瘤中均存在着 NEK2 过度表达[12-14]。更重要的是,NEK2的表达上调已经被证实与直肠癌、乳腺癌和黑色素瘤的临床进展和不良预后存在重要的联系[15-16]。但是,目前笔者尚未见对NEK2在前列腺癌中的作用机制以及与前列腺癌进展预后关系的研究。
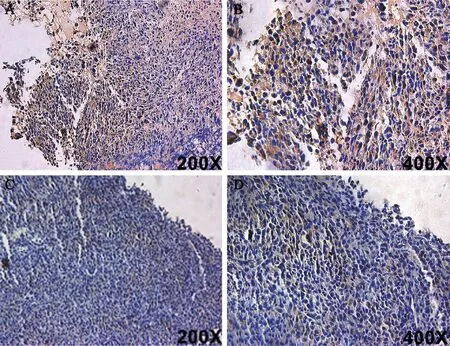
图4 Scrambled组和shNEK2组异种移植物的免疫组织化学染色结果
A、B:Scramble组;C、D:shNEK2组;棕色:NEK2阳性表达;蓝色:细胞核染色
本研究首先检测NEK2在良性的前列腺上皮细胞株PrEC和前列腺癌细胞株PC3、DU145、LNCaP中的表达差异,并发现NEK2的过度表达可能促进了前列腺癌细胞的增殖,初步证明NEK2参与肿瘤的发病进程,可能起着促癌基因的作用。有学者认为,NEK2 及其同系物过度表达可聚集中心体,加快推进有丝分裂进程,甚至直接导致染色质的分裂[17]。也有认为变异的 NEK2 表达影响染色体着丝点蛋白,导致异倍体形成[18]。还有研究表明,NEK2的过度表达可以引发额外中心体的产生,从而导致细胞的异常增殖[10]。结合本研究,NEK2可能通过细胞周期调控细胞增殖影响前列腺肿瘤的发展。
肿瘤的发生是个复杂的过程,还需要做大量的工作才能更好地理解NEK家族的成员在肿瘤的发生中所起的作用。本研究在细胞水平和动物层面证实NEK2影响肿瘤细胞增殖方面的作用,可能为前列腺癌的诊断与治疗带来新方向。
参考文献
[1]DeMarzo AM, Nelson WG, Isaacs WB, Epstein JI. Pathological and molecular aspects of prostate cancer.Lancet,2003,361(9361):955-964.
[2]Fry AM.The Nek2 protein kinase: a novel regulator of centrosome structure.Oncogene,2002,21(40):6184-6194.
[3]Sonn S, Khang I, Kim K, Rhee K.Suppression of Nek2A in mouse early embryos confirms its requirement for chromosome segregation.J Cell Sci,2004,117(Pt 23):5557-5566.
[4]Bowers AJ, Boylan JF.Nek8, a NIMA family kinase member, is overexpressed in primary human breast tumors.Gene,2004,328:135-142.
[5]Casenghi M, Meraldi P, Weinhart U, Duncan PI, Körner R, Nigg EA.Polo-like kinase 1 regulates Nlp, a centrosome protein involved in microtubule nucleation.Dev Cell,2003,5(1):113-125.
[6]Gräf R.DdNek2, the first non-vertebrate homologue of human Nek2, is involved in the formation of microtubule-organizing centers.J Cell Sci,2002,115(Pt 9):1919-1929.
[7]Salisbury JL, D’Assoro AB, Lingle WL. Centrosome amplification and the origin of chromosomal instability in breast cancer.J Mammary Gland Biol Neoplasia,2004,9(3):275-283.
[8]Dai J, Higgins JM. Haspin: a mitotic histone kinase required for metaphase chromosome alignment.Cell Cycle,2005,4(5):665-668.
[9]Du J, Cai X, Yao J, Ding X, Wu Q, Pei S, Jiang K, Zhang Y, Wang W, Shi Y, Lai Y, Shen J, Teng M, Huang H, Fei Q, Reddy ES, Zhu J, Jin C, Yao X.The mitotic checkpoint kinase NEK2A regulates kinetochore microtubule attachment stability. Oncogene, 2008,27(29):4107-4114.
[10]Mardin BR, Lange C, Baxter JE, Hardy T, Scholz SR, Fry AM, Schiebel E. Components of the Hippo pathway cooperate with Nek2 kinase to regulate centrosome disjunction.Nat Cell Biol,2010,12(12):1166-1176.
[11]Sonn S, Jeong Y, Rhee K.Nip2/centrobin may be a substrate of Nek2 that is required for proper spindle assembly during mitosis in early mouse embryos.Mol Reprod Dev,2009,76(6):587-592.
[12]Szponar A, Zubakov D, Pawlak J, Jauch A, Kovacs G. Three genetic developmental stages of papillary renal cell tumors: duplication of chromosome 1q marks fatal progression.Int J Cancer,2009,124(9):2071-2076.
[13]Kokuryo T, Senga T, Yokoyama Y, Nagino M, Nimura Y, Hamaguchi M.Nek2 as an effective target for inhibition of tumorigenic growth and peritoneal dissemination of cholangiocarcinoma.Cancer Res,2007,67(20):9637-9642.
[14]Wang S, Li W, Lv S, Wang Y, Liu Z, Zhang J, Liu T, Niu Y.Abnormal expression of Nek2 and β-catenin in breast carcinoma: clinicopathological correlations.Histopathology,2011,59(4):631-642.
[15]Wei R, Ngo B, Wu G, Lee WH.Phosphorylation of the Ndc80 complex protein, HEC1, by Nek2 kinase modulates chromosome alignment andsignaling of the spindle assembly checkpoint.Mol Biol Cell,2011,22(19):3584-3594.
[16]Marina M, Saavedra HI.Nek2 and Plk4: prognostic markers, drivers of breast tumorigenesis and drug resistance.Front Biosci (Landmark Ed),2014,19:352-365.
[17]Takahashi Y, Iwaya T, Sawada G, Kurashige J, Matsumura T, Uchi R, Ueo H, Takano Y, Eguchi H, Sudo T, Sugimachi K, Yamamoto H, Doki Y, Mori M, Mimori K.Up-regulation of NEK2 by microRNA-128 methylation is associated with poor prognosis in colorectal cancer.Ann Surg Oncol,2014,21(1):205-212.
[18]Zhou W, Yang Y, Xia J, Wang H, Salama ME, Xiong W, Xu H, Shetty S, Chen T, Zeng Z, Shi L, Zangari M, Miles R, Bearss D, Tricot G, Zhan F.NEK2 induces drug resistance mainly through activation of efflux drug pumps and is associated with poor prognosis in myeloma and other cancers.Cancer Cell,2013,23(1):48-62.
(本文编辑:林燕薇)

Effect of NEK2 on prostate cancer cell proliferation
HeGuangning,WuYongding,ChenGuo,CaiZhiduan,ZengYanru,JiangFuneng.
DepartmentofSurgicalOncology,DongguanMunicipalPeople’sHospital,SouthernMedicalUniversity,Dongguan523059,China
【Abstract】ObjectiveTo compare the expression levels of NEK2 between the benign prostate epithelial cells and prostate cancer cells, and evaluate the effect of NEK2 upon prostate cancer cell proliferation. MethodsThe expression levels of NEK2 in benign prostate cancer PrEC cell line and prostate cancer PC3, LNCaP and DU145 cell lines were measured by qRT-PCR. The expression of endogenous NEK2 in the LNCaP cell line was inhibited with shRNA. CCK8 assay and subcutaneous implantation of xenografts were utilized to assess the proliferation of LNCaP cells. ResultsThe expression levels of NEK2 in the PC3, LNCaP and DU145 were significantly higher compared with that in the PrEC (all P<0.01). By using shRNA, the expression of NEK2 was down-regulated in the LNCaP cells at both mRNA and protein levels (both P<0.01). Cell proliferation assayshowed that the LNCaP cells treated with NEK2 shRNA yielded lower proliferation rate compared with those LNCaP cell treated with non-sense sequence(P<0.01). In vivo experiment revealed smaller grafted tumors and lower expression of NEK2 protein in mice injected with shNEK2 LNCaP cell compared with those injected with scrambled LNCaP cell. ConclusionsOverexpression of NEK2 can promote the proliferation of prostate cancer cells. NEK2 has the potential to serve as a biomarker for prostate cancer therapy.
【Key words】Prostate cancer; NEK2; Cell proliferation
(收稿日期:2015-10-24)
Corresponding author, Jiang Funeng, E-mail:jiangfuneng@qq.com
通讯作者,江福能,E-mail:jiangfuneng@qq.com
基金项目:广东省自然科学基金项目(2014A030310088);广州市医药卫生科技项目(20141A011007);广东省临床分子医学及分子诊断实验室重点实验室资助项目
DOI:10.3969/j.issn.0253-9802.2016.04.005
·基础研究论着·



