易小友 何容涵 廖瑛扬 王哲 江诗海 王昆
关节纤维化是指关节手术或者关节长期制动导致的主动或被动的关节活动度(ROM)的丧失,临床表现为持续性的主动及被动活动受限[1]。关节纤维化发生的机制目前尚未明确,公认的是,关节周围原位成纤维肌活化并转化为肌成纤维细胞[1-3]。组织学上主要表现为α-平滑肌肌动蛋白(α-SMA)阳性的肌成纤维细胞活化、聚集并分泌大量以Ⅰ型胶原为主的细胞外基质成分。因此,阻断成纤维细胞向肌成纤维细胞的转化、减少细胞外基质的沉积成为治疗关节纤维化的主要方向。
含t复合多肽伴侣素亚基(CCT)是广泛存在于真核细胞胞质中的一种重要分子伴侣,以维持相关蛋白在细胞内的正常功能[4-6]。任何亚基的变化均会导致细胞不同的生物学改变。前期研究显示,CCT-7在成纤维细胞的活化过程中是高表达的,另有研究也显示CCT-7在皮肤瘢痕形成、关节纤维化过程中亦是高表达的[4-6]。有研究显示CCT-6参与皮肤瘢痕的形成[7]。CCT-6可以分为6a和6b。在肺的非小细胞肺癌中,CCT-6a已被证实能够通过转化生长因子-β(TGF-β)通路调节癌细胞的代谢,而TGF-β信号通路具有最强的致纤维化作用[8-10]。Rommelaere等[11]在动物的睾丸中最早发现CCT-6b高表达,但笔者见目前CCT-6b在纤维化方面缺乏相关研究,因此在本研究中,通过筛查关节纤维化的成纤维细胞中CCT家族各个亚基的表达,探索各亚基在关节纤维化中的可能作用,为临床上治疗关节纤维化指明方向。
材料与方法
一、主要实验试剂
全蛋白提取试剂盒、蛋白定量试剂盒、细胞增殖及毒性检测试剂盒(CCK-8试剂盒)购自Keygen公司,总RNA提取试剂盒购自Invitrogen公司,实验抗体均购自Abclonal公司,一步法PCR试剂盒购自Takara公司,引物合成由谷歌生物公司合成。
二、方 法
1.关节纤维化动物模型的建立
本动物实验通过中山大学附属第三医院医学伦理委员会批准。成年SD大鼠(雌性)12只,体质量280~320 g,取其右下肢为固定组,左下肢为对照组。固定组以1%戊巴比妥钠5 ml/kg腹腔注射麻醉后,沿膝关节内侧切开皮肤,分离皮下组织和肌肉,显露股骨远端、膝关节内侧及胫骨近端。保持膝关节屈曲至45°左右时放置聚甲醛树脂板(POM板),以1.1 mm电钻于股骨内侧远端、胫骨内侧近端钻孔,用POM板及2枚直径1.2 mm、长16 mm不锈钢螺钉将膝关节固定约45°(图1A),随后缝合伤口。对照组不作处理。在8周时间内常规饲养大鼠(图1B)。
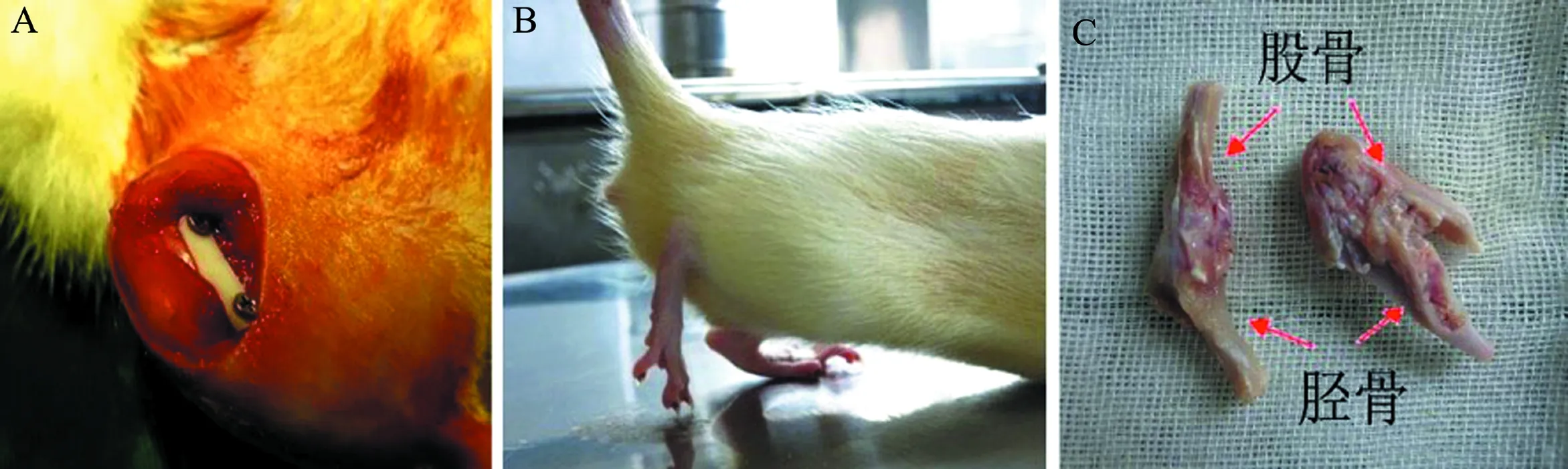
图1 大鼠膝关节纤维化模型的建立
2.大鼠膝关节最大伸直角度的测量
手术8周后,采用颈椎脱臼法处死大鼠,取出不锈钢螺钉和POM板,小心剔除膝关节周围的肌肉、韧带等组织,保证膝后方关节囊完好。用角度测量器测量固定组和对照组膝关节的活动度(ROM),完全伸直的膝关节记为180°,比较2组膝关节的最大伸直角度,以评估关节纤维化的严重程度(图1C)。
3.大鼠膝关节囊原代细胞的培养
分离大鼠膝关节后方关节囊,用大量含双抗(100 U/ml青霉素,100 μg/ml链霉素)的磷酸盐缓冲液(PBS)冲洗组织块,去除肌肉、肌腱、脂肪等周围组织,将组织剪碎成1 mm×1 mm大小,均匀铺至25 cm2培养瓶底部,倒置放入体积分数为5%二氧化碳的37 ℃细胞培养箱中,约3 h后取出,组织块贴壁后再加入含10%胎牛血清的高糖Dulbecco改良Eagle培养基(DMEM),将培养瓶平置放入培养箱中。每隔2 d取出换液。约第7日可镜下观察到部分贴壁组织块周边有成纤维样细胞爬出,约第14日,可见成纤维样细胞大量接触成片,即为原代成纤维细胞。常规消化细胞传代,放入培养箱中进行细胞培养,此后每隔2 d取出细胞换液1次。
4.Transwell细胞迁移实验
取2组细胞饥饿培养12 h,调整细胞密度为2.5×105个/ml,取200 μl细胞悬液加入Transwell小室中,下层小室加入600 μl含10%胎牛血清的高糖DMEM,每组细胞设置4个复孔,置于细胞培养箱培养。24 h后取出上层小室,用PBS清洗2次,再用4%多聚甲醛固定10 min后,清洗小室2次,用0.1%结晶紫染色15 min,洗去多余染剂,置于倒置显微镜下观察,随机选取5个高倍镜视野(×100)进行拍照及细胞计数。以穿过Transwell小室微孔细胞的数量代表该组细胞的迁移能力。
5.CCK-8细胞增殖实验
取2组细胞调整细胞密度为1×105个/ml,取100 μl细胞悬液加入96孔板中,每组细胞设置5个复孔,置于细胞培养箱培养。24 h后取出96孔板,按试剂盒说明书操作。用酶标仪在450 nm波长下测定吸光度(OD450)在各个孔的读数,计算每组细胞的增殖活力。
6.蛋白免疫印迹试验
采用蛋白免疫印迹实验检测2组成纤维细胞的α-SMA、Ⅰ型胶原蛋白(COL-1)表达水平及CCT家族各亚基表达水平。提取2组细胞总蛋白溶液,根据目的蛋白分子量选择分离胶为12%浓度、浓缩胶5%浓度,设定电压80 V电泳30 min,待样品进入分离胶后改电压为120 V电泳约30 min。按恒定电流200 mA转膜60 min,用TBST配制5 % 脱脂牛奶作为封闭液,封闭1 h。按1∶1 000稀释一抗,4 ℃孵育过夜。按1∶5 000稀释二抗,室温孵育60 min。洗膜后取出浸没于5 ml增强化学发光法(ECL)发光液中约1 min,可置入Fluor Chem M多色荧光蛋白免疫印迹成像系统,进行自动曝光成像。
7.实时荧光定量PCR
采用实时荧光定量PCR检测2组细胞的CCT家族各亚基基因表达,提取2组细胞的总RNA,使用一步法反转录试剂盒(One Step SYBR Prime Script RT-PCR Kit),根据目的基因的序列设计并合成引物,按试剂盒说明书操作,组成20 μl real-time PCR反应体系,以甘油醛-3-磷酸脱氢酶(GAPDH)作为内参(表1)。应用Applied Biosystems 7500 Fast实时荧光定量PCR系统,按说明书设定条件。PCR反应共进行40个循环。待反应结束后读取每个孔的CT值做分析,以2-ΔΔCT计算2组细胞每个目的基因的mRNA的相对表达量。
三、统计学处理

表1 实验使用的PCR引物序列
结 果
一、固定组与对照组大鼠膝关节最大伸直角度比较
术后8周时间内2组大鼠均无死亡、局部感染、固定松动等情况。拆除内固定后,比较2组膝关节的最大伸直角度,固定组12个关节的膝关节最大伸直角度为(97.7±6.5)°,对照组12个关节的膝关节最大伸直角度为(158.3±8.2)°,2组比较差异有统计学意义(t=17.570,P<0.001)。
二、固定组与对照组大鼠成纤维细胞的表型差异
组织贴壁法分离的原代细胞,细胞为长梭形的成纤维样,经过消化传代后,固定组和对照组细胞均为贴壁生长的成纤维样,细胞外形、生长特点基本一致,呈长梭形。与对照组相比,固定组细胞触角伸展更多,体积更大,细胞接触相对更紧密,见图2。
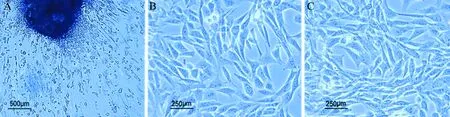
图2 膝关节后方关节囊原代成纤维细胞光镜下形态
三、固定组与对照组大鼠成纤维细胞迁移能力比较
Transwell细胞迁移实验结果显示,固定组细胞在高倍镜(×100)视野下平均迁移出小室的细胞数量为(84±7)个、对照组成纤维细胞为(51±5)个,2组比较差异有统计学意义(t=11.635,P<0.001)。即固定组成纤维细胞迁移能力增强,见图3。
四、固定组与对照组大鼠成纤维细胞增殖活力比较
固定组成纤维细胞的OD450为1.131±0.016,对照组为0.698±0.018,2组比较差异有统计学意义(t=18.010,P<0.001),见图4。
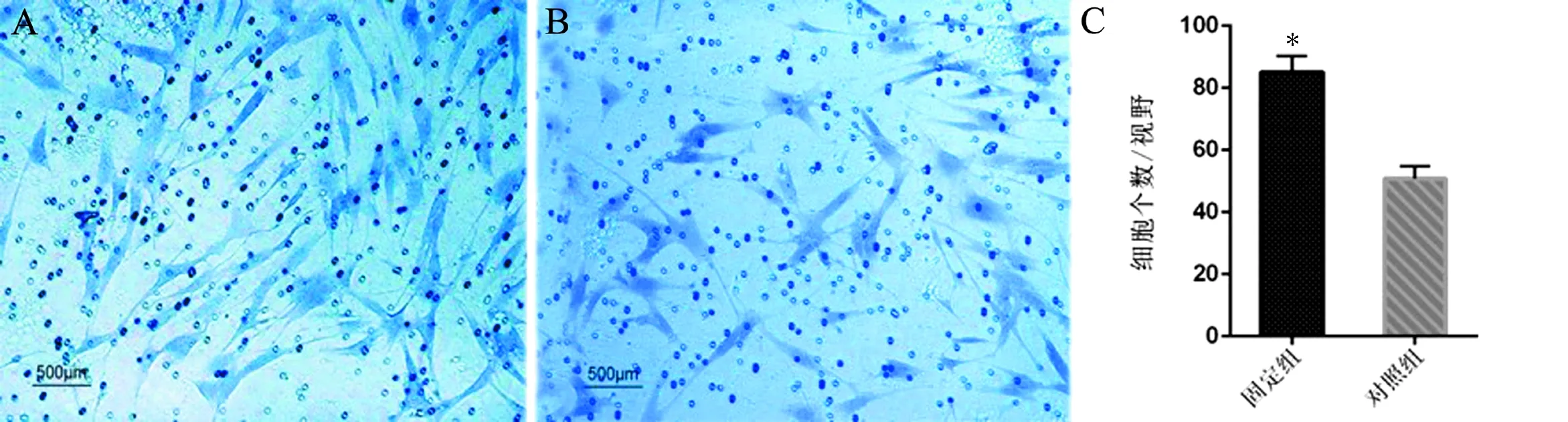
图3 Transwell细胞迁移实验结果
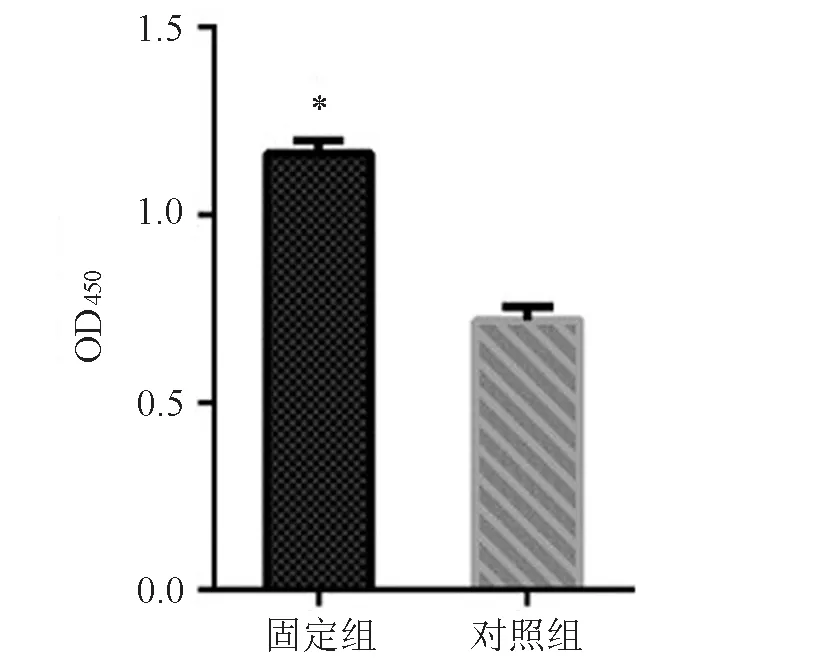
图4 细胞增殖实验结果
五、固定组与对照组大鼠成纤维细胞α-SMA、COL-1表达的比较
固定组α-SMA表达灰度值为0.482±0.025,对照组为0.130±0.007,2组比较差异有统计学意义(t=13.57,P<0.001);固定组COL-1表达灰度值为1.235±0.060,对照组为0.356±0.019,2组比较差异有统计学意义(t=13.96,P<0.001),见图5A。
固定组α-SMA的基因表达为对照组的(5.399±0.096)倍(t=44.65,P<0.001);COL-1的基因表达为对照组的(1.615±0.050)倍(t=12.28,P<0.001),见图5B。
六、固定组与对照组细胞表达CCT家族各亚基情况的比较
固定组成纤维细胞CCT-6b蛋白表达灰度值较对照组低(P<0.001),CCT-1、CCT-2、CCT-4、CCT-6a、CCT-7则较高(P均<0.05),见表2、图6。
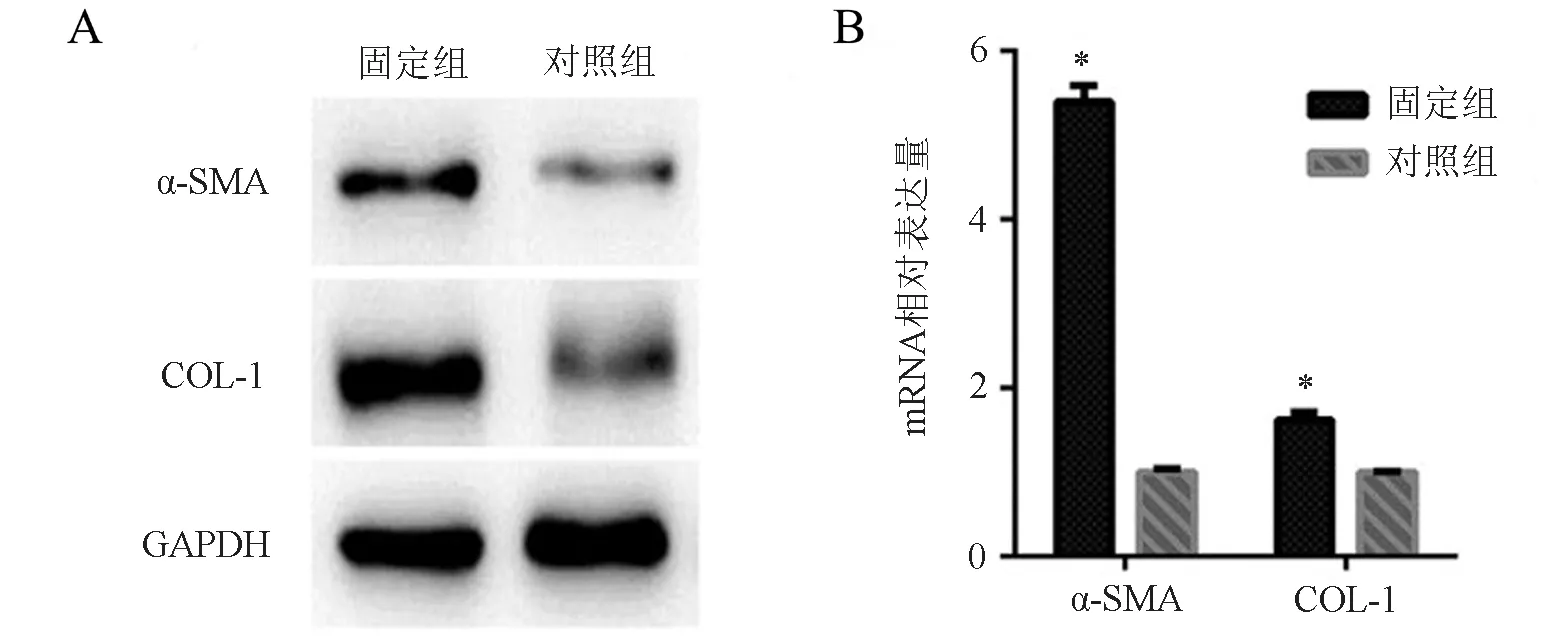
图5 α-SMA、COL-1蛋白和基因表达情况
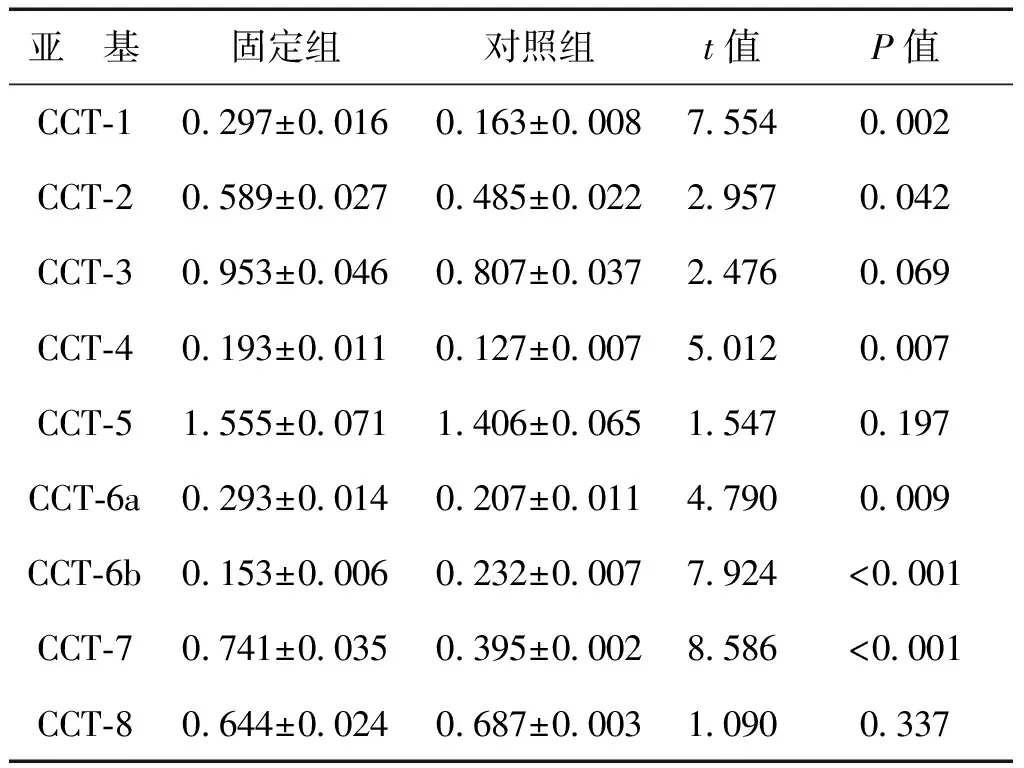
表2 固定组与对照组大鼠CCT各亚基蛋白表达灰度值比较
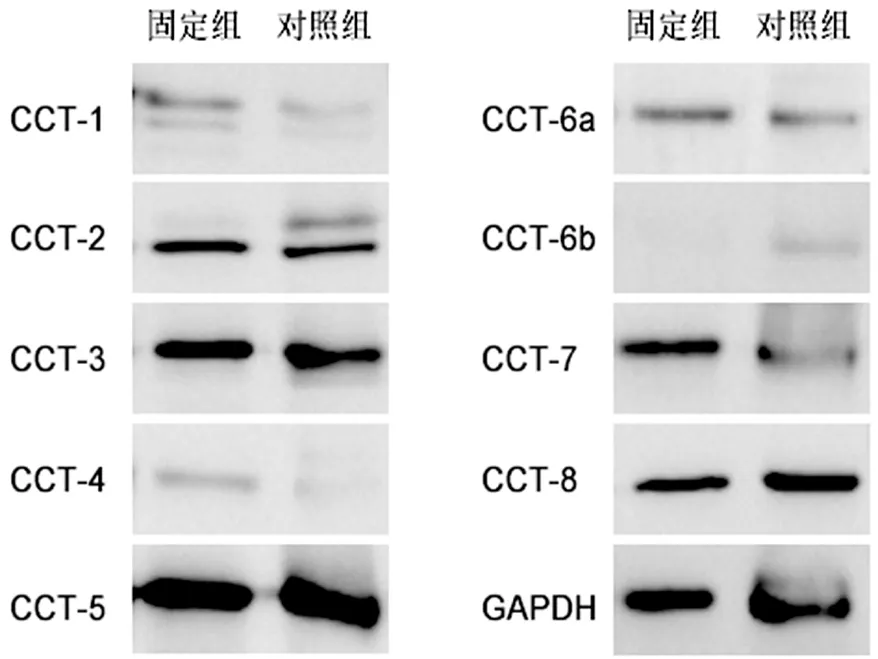
图6 蛋白免疫印迹显示CCT家族各亚基的蛋白表达变化
七、固定组与对照组大鼠细胞表达CCT家族各亚基基因表达的比较
固定组成纤维细胞CCT-6b基因表达较对照组低(P<0.001),CCT-7基因2组比较无差异,其余亚基固定组均较对照组高(P均<0.05),见表3、图7。

表3 固定组与对照组CCT各个亚基mRNA表达的相对定量值
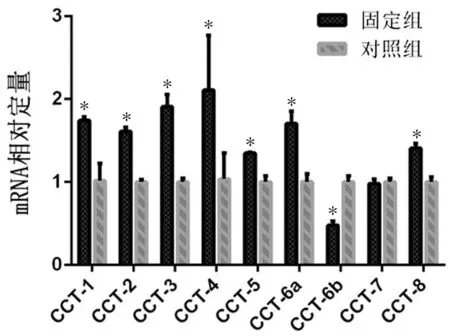
图7 实时荧光定量PCR结果显示CCT家族各亚基的基因表达变化,与对照组比较,*P<0.05
讨 论
目前关节纤维化的治疗方法主要是通过手术松解纤维组织以及物理治疗,达到增加关节活动度的目的,但是物理治疗效果不佳,手术也存在术后加重关节挛缩以及感染、出血等风险。既往研究表明,在心脏、肝脏、皮肤、肺脏等器官的纤维化过程中,成纤维细胞受到刺激转化为肌成纤维细胞,表达并分泌大量α-SMA、COL-1,且细胞的增殖活力、迁移能力增强[1-3,12-13]。本研究结果显示,在固定大鼠膝关节8周后,测量膝关节最大伸直角度发现固定组关节活动度降低,固定组细胞相对于对照组细胞在细胞表型上更接近于肌成纤维细胞,并且细胞迁移能力、增殖活力增高,在蛋白水平和基因水平上均表达更多的α-SMA、COL-1,以上结果均与既往研究结果相同[4]。因此,本研究大鼠膝关节纤维化动物模型建立成功,细胞适用于关节纤维化疾病的进一步研究。
CCT家族在真核细胞中普遍存在并参与了许多生物学过程。有研究者已证实CCT-7在纤维化疾病中是升高的,干扰CCT-7表达后细胞纤维化指标明显下降[4]。在本研究中,笔者筛查了关节纤维化的成纤维细胞CCT家族各亚基的表达变化,发现与对照组比较,固定组CCT-6b蛋白和基因表达均较低,CCT-1、CCT-2、CCT-4、CCT-6a、CCT-7蛋白表达较高,CCT-1、CCT-2、CCT-4、CCT-6a基因表达较高。而Satish等(2008年)的研究证实,CCT-2在其它CCT亚基发生变化时的变化较小。目前缺乏CCT-6b在纤维化疾病中的相关研究,既往Walkley等(1996年)对CCT-6的研究显示,CCT-6在折叠肌动蛋白和微管蛋白中具有关键作用,而且与CCT-3具有54%的基因相似程度。有研究显示,在口腔黏膜损伤修复过程中,CCT-6的基因表达水平明显高于未损伤的对照组[7]。另一项研究则显示CCT-6基因在正常胎儿皮肤中高表达,而成年人皮肤中相对低表达,提示CCT-6可能与皮肤瘢痕形成(皮肤纤维化)有一定关系。因此在本研究中的大鼠关节纤维化模型中,固定组成纤维细胞CCT-6b表达下调可能是成纤维细胞活化过程的标志,提示了CCT-6b可能参与了成纤维细胞纤维化的过程,并可能是抗纤维化因子,但其中的具体变化还有待进一步实验验证。
目前关节纤维化的发病机制尚未阐明,其病理生理学过程未得到合理的解释,这也是临床上预防和治疗关节纤维化效果不佳的主要原因。本研究通过构建关节纤维化动物模型,发现固定后的成纤维细胞迁移能力、增殖能力增强,表达α-SMA、COL-1增高,CCT-6b的蛋白和基因表达下调,提示CCT家族参与了关节纤维化的发生,其中CCT-6b可能作为抗纤维化因子参与了细胞纤维化过程。



