叶琨?万圣云?丁洋

【摘要】目的 探讨三维(3D)打印技术在复杂主动脉疾病腔内治疗中的应用。方法 回顾性分析24例复杂主动脉疾病患者的资料,术前根据24例患者的CT血管造影(CTA)进行主动脉3D重建,将病变区域进行3D打印,选择中空透明材料制作3D打印模型并消毒,术中根据3D打印模型将支架“预开窗”并缝制铂金弹簧圈,重装支架后在体内完成主体支架的释放和分支支架的选择并释放。术后观察疗效、并发症和随访情况。结果 24例包括12例复杂腹主动脉瘤、11例胸主动脉夹层、1例胸腹主动脉瘤,均在术前完成病变段主动脉3D模型打印,根据模型数据辅助制定手术方案,手术均顺利。24例术前3D打印模型测量和术中造影各项数据比较差异均无统计学意义(P均> 0.05)。主动脉夹层患者术后真腔最大直径较术前增大、术后假腔最大直径较术前减小;主动脉瘤患者术后瘤体最大直径较术前减小(P均< 0.05)。所有患者术后均未出现出血、脏器功能损害等严重并发症,术后3个月复查CTA显示支架位置良好,无内漏,分支动脉血供良好。结论 3D打印技术能使复杂主动脉疾病的腔内治疗更加精准。
【关键词】复杂主动脉疾病;腔内治疗;3D打印技术
Application of 3D printing technology in endovascular treatment of complex aortic disease Ye Kun, Wan Shengyun, Ding Yang. Department of Vascular Surgery, the Second Hospital of Anhui Medical University, Hefei 230601, China Corresponding author, Wan Shengyun, E-mail: wshy63@ sina. com
【Abstract】Objective To evaluate the application of three-dimensional (3D) printing technology in the endovascular treatment of complex aortic disease. Methods Clinical data of 24 patients with complex aortic disease were retrospectively analyzed. Three-dimensional reconstruction of the aorta was performed according to preoperative CT angiography (CTA) of 24 patients. The diseased area was subjected to 3D printing. Hollow transparent materials were employed to produce and sterilize 3D printing models. Intraoperatively, pre-fenestration of the stent was carried out and the platinum coils were sewed around the holes of the covered stent based upon the 3D printing models. After stent reassembly, the releasing of the covered stent and the selection and releasing of the branch stent were performed. Postoperative efficacy, complications and follow-up prognosis were observed. Results Among 24 patients, 12 cases were diagnosed with complex abdominal aortic aneurysm, 11 cases of thoracic aortic dissection and 1 case of thoracoabdominal aortic aneurysm. All 3D printing models of the aortic lesion were accomplished preoperatively. The surgical plans were determined based on the data of 3D printing models. All patients successfully underwent the surgery. The data of preoperative 3D printing models did not significantly differ from intraoperative CTA data (all P > 0.05). For patients with aortic dissection, the maximum diameter of the true lumen was significantly increased, whereas that of the false lumen was considerably decreased after surgery (both P < 0.05). For aortic aneurysm patients, the maximum diameter of the aneurysm was significantly decreased after surgery (P < 0.05). No severe complications, such as bleeding or organ failure, occurred postoperatively. CTA at postoperative 3 months showed that the stents were located in proper position, no internal leakage and good blood supply of branch arteries. Conclusion Application of 3D printing technology can enhance the accuracy of endovascular treatment of complex aortic disease.
【Key words】Complex Aortic disease;Endovascular treatment;Three-dimensional printing technology
复杂主动脉疾病的腔内治疗一直是血管外科的难点,包括累及弓上分支的胸主动脉夹层、破口位于内脏区的胸主动脉夹层、胸腹主动脉瘤、复杂腹主动脉瘤等。延长锚定区、保证重要分支动脉血供一直是腔内治疗面临的挑战[1]。而“开窗”“烟囱”“分支支架”“转流”等分支重建技术就是重要的解决手段。“开窗”技术的难点在于位置的确定,仅仅依靠术前影像学方法往往不够精确,容易导致开窗位置和分支支架不匹配,进而影响分支动脉的血运[2]。随着三维(3D)打印技术的发展和普及,我们可以建立1∶1的精确模型,通过术前测量、3D打印模型上规划“开窗”位置、术中体外在覆膜支架上“预开窗”实现精准定位[3]。但3D打印出的模型,是否可以与实际病变的几何参数做到完全匹配,之前的研究甚少涉及。就此问题我们采用详细的主动脉形态学测量方法对术前3D打印模型和术中测量数据进行了比较,希望了解3D打印模型是否能对真实病变主动脉准确建模。
对象与方法
一、研究对象
收集安徽医科大学第二附属医院血管外科2019年8月1日至2020年12月30日进行的3D打印模型辅助全腔内修复治疗复杂主动脉疾病患者的临床资料。所有患者均经CT血管造影(CTA)明确诊断,纳入标准:被诊断为累及弓上分支的胸主动脉夹层、破口位于内脏区的胸主动脉夹层、胸腹主动脉瘤和复杂腹主动脉瘤,能够耐受全身麻醉,能够接受手术相关风险。排除标准:患马凡综合征、多发性大动脉炎、自身免疫性疾病及不能接受手术者。共入组24例患者,男14例、女10例,年龄(56.0±13.1)岁。24例接受的手术如下:12例累及双肾动脉的复杂腹主动脉瘤行腔内修复,7例累及弓上分支的胸主动脉夹层行腔内修复,4例远端破口位于内脏区的胸主动脉夹层行腔内修复,1例Crawford V型胸腹主动脉瘤行腔内修复。患者术前均完成常规检查。本研究通过我院医学伦理委员会审批(批号:SL-LC2019050)。
二、主动脉CTA 3D重建和3D打印模型
所有患者术前均行主动脉CTA,采用德国西门子SOMATOM Force双源CT,经肘静脉注射造影剂碘帕醇(370 mg/ml),注射流速5 ml/s,总量85 ml,扫描层厚5 mm,重建层厚0.625 mm,输出DICOM格式原始数据文件。CT原始数据以DICOM格式导入Mimics 16.0软件,进行主动脉3D重建,提取病灶部位,并以STL格式导出模型,将数据导入计算机上的ChiTuBox切片软件进行打印调整,调整后以CBDDLP格式保存3D模型,将CBDDLP文件拷贝到SD卡,以聚已内酯材料在3D打印机进行病变段主动脉形态3D打印,3D打印后经等离子灭菌包装。本研究仅对病变段主动脉进行3D打印建模,并不是对主动脉进行整体打印,节省了时间,也避免了因正常段主动脉扭曲形态等原因造成的支架输送系统进入模型困难。
三、术前评估
根据患者术前CTA 3D重建结果和3D打印模型,测量夹层破口大小、主动脉直径(近远端锚定区或近远端瘤颈、双侧髂股动脉等)及病变长度、分支动脉情况(直径、开口位置、适宜C臂角度),观察入路血管、主动脉弓型、瘤颈等成角及扭曲情况。讨论分析手术方案、支架选择、备用方案如“烟囱”技术等。向患者及其家属展示3D打印模型,充分告知目前的治疗方案包括开放手术、腔内修复和保守治疗等方式,该研究中的24例患者均因开放手术的创伤大、恢复慢决定选择腔内修复,充分告知其腔内修复手术的围术期风险,取得其理解,患者均签署知情同意书。
四、术中操作
1. 支架的准备
将主动脉覆膜支架(记忆合金血管支架,北京有研公司;Endurant,美敦力公司)释放在术前定制并消毒好的空心透明的1∶1病变段主动脉3D打印模型中,按照3D打印模型中预先开孔的位置在主动脉覆膜支架上用无菌标记笔描记分支动脉开口位置。取出覆膜支架后用电灼笔或显微剪刀按照描记位置、大小“开窗”。用5-0 Prolene缝线将铂金弹簧圈(COOK)连续缝合在窗口边缘。对于动脉瘤患者,为预防内漏,一般缝合10 ~ 20 mm短覆膜支架于“窗口”外以增加主体支架和分支支架间的接触面积。沿主体支架长轴穿行V18导丝并使用5-0 Prolene缝线对主体支架相邻节段进行缝合,“束径”缩窄主体支架至少30%以方便其在主动脉中调整位置。最后将制备好的支架重装回输送系统。
2. 分支动脉的导管预置
对于主动脉夹层继发破口、胸腹主动脉瘤及复杂腹主动脉瘤的治疗,在准备支架的同时,另一组医师从术前规划的入路(一般是主体支架入路对侧的股动脉或肱动脉)预置导管超选至各分支动脉,以备“窗口”对位不准确紧急放置“烟囱”支架保证分支动脉血供。
3. 主体支架和分支支架的植入
经股动脉顺超硬导丝导入主体支架至预定位置,先释放支架近心端1 ~ 2个节段,调整支架“开窗”位置至相应的分支动脉。经上肢动脉或对侧股动脉进入主体支架,超选各分支动脉后跟进长鞘,退出预置导管,继续释放主体支架至下一个预“开窗”节段。经长鞘导入分支支架至合适位置,抽出V18“束径”导丝,依次释放各分支支架(Fluency,Bard公司;Viabahn,Gore公司),再次造影确定支架无内漏。
五、术后随访
术后3个月进行门诊随访,行主动脉CTA评估支架内通畅情况、是否存在内漏、瘤腔/真假腔直径和分支动脉供血情况。
六、统计学处理
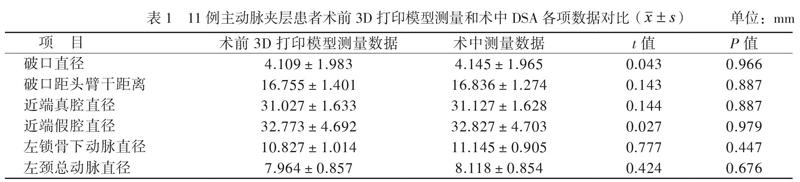
所有数据采用SPSS 19.0进行统计学分析。术前3D打印模型测量及术中数字减影血管造影(DSA)各项指标量(包括破口大小、破口距头臂干距离、病变长度、瘤体最大直径、内脏动脉直径)、术前及术后真假腔最大直径和瘤体最大直径均为计量资料。经检验全部计量资料均符合正态分布,以表示,计量资料的比较采用配对t检验。P < 0.05为差异有统计学意义。
结果
一、一般情况
所有患者均完成术前增强CT 3D重建和病变段主动脉模型3D打印,经统计学分析,对术前3D打印模型测量的指标(破口直径、破口距头臂干距离、近端真腔直径、近端假腔直径、瘤体最大直径、分支动脉直径)和术中主动脉DSA比较,差异均无统计学意义,见表1、2。根据术前测量的重要数据制定手术方案,并指导术中操作,24例手术均顺利,围术期无死亡病例,未发生出血、脏器功能损害等严重的并发症。
二、胸主动脉夹层的治疗结果
11例患者为Stanford B型主动脉夹层,其中10例因破口距离左锁骨下动脉< 1 cm,锚定区不足,术中成功放置覆膜支架并通过“开窗”技术保留了左颈总动脉和左锁骨下动脉。术后3个月复查CTA,支架位置良好,未见内漏,近端破口封堵满意,分支动脉血供良好,见图1A ~ D。另1例因远端破口靠近肠系膜上动脉,在处理完近端破口后3个月再次入院,术中同样通过“开窗”技术成功保留了腹腔干和肠系膜上动脉,因该例患者肾衰竭、双肾萎缩,故未再行双肾动脉“开窗”。术后3个月复查CTA,显示支架位置良好,未见内漏,远端破口封堵满意,分支动脉血供良好,见图1E ~ H。
三、胸腹主动脉瘤的治疗结果
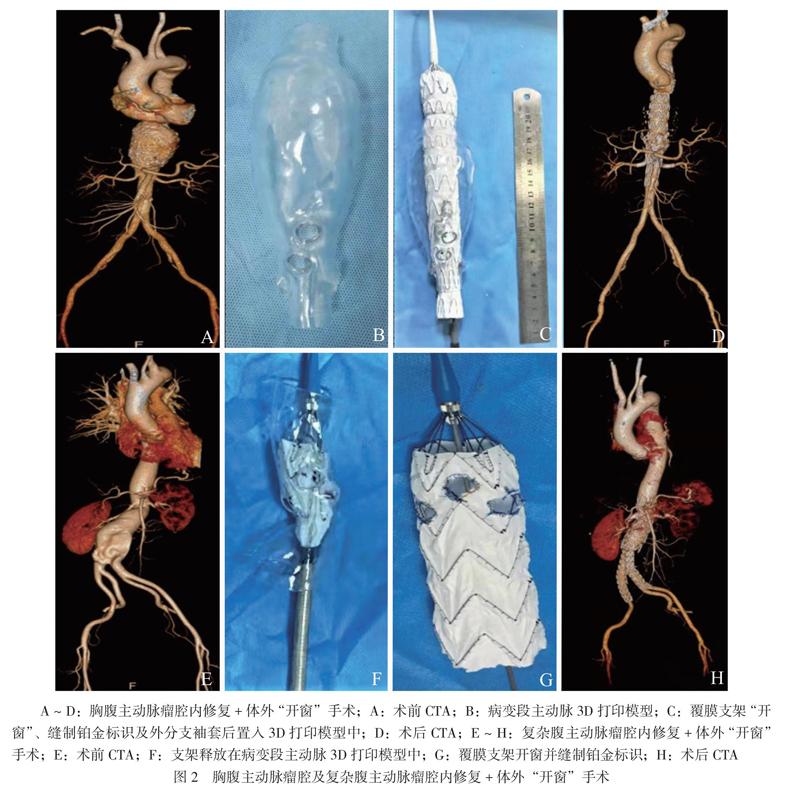
1例患者为Crawford V型胸腹主动脉瘤,因瘤体累及腹腔干、肠系膜上动脉,距离双肾动脉较近(< 1 cm),锚定区不足,借助术前3D打印模型,成功在主体覆膜支架(Ankura,深圳先健)上通过“开窗”技术保留了腹腔干、肠系膜上动脉、双肾动脉。术后3个月复查CTA,显示支架位置良好,未见内漏,分支动脉血供良好,见图2A ~ D。
四、复杂腹主动脉瘤的治疗结果
12例患者为累及双肾动脉的复杂腹主动脉瘤,术中成功进行双肾动脉“开窗”。1例患者因瘤颈扭曲,距离肠系膜上动脉较近(< 1 cm),锚定区不足,成功进行双肾动脉及肠系膜上动脉“开窗”。在“开窗”主体支架下方按照常规腹主动脉腔内修复术式顺利释放主体支架和髂支(Endurant,美敦力公司),由于瘤颈扭曲处直径细,故设计将第2枚支架在此处与第1枚支架重叠形成“裙边”样结构,从而避免了内漏。术后3个月复查CTA,支架位置良好,未见内漏,分支动脉血供良好,见图2E ~ H。
五、随访结果
本研究24例患者术后3个月均完成主动脉CTA,均提示支架位置良好,无内漏,分支动脉血供良好。经过3 ~ 12个月的随访,本组患者的总体死亡率为0,再干预率为0。主动脉夹层患者术后真腔最大直径[(31.618±2.119)mm]较术前[(27.891±2.653)mm]增大(P < 0.05),而术后假腔最大直径[(32.318±3.757)mm]较术前[(36.682±4.458)mm]减小(P < 0.05),主动脉瘤患者术后瘤体最大直径[(46.431±3.697)mm] 较术前[(49.462±3.719)mm]减小(P < 0.05),见表3。
讨论
3D打印技术被誉为制造业的一次“工业革命”,在航天工业、建筑设计、医学工程等众多领域均展现出巨大的潜力和价值。累及弓上分支的胸主动脉夹层、破口位于内脏区的胸主动脉夹层、胸腹主动脉瘤和复杂腹主动脉瘤均是血管外科治疗难点[4]。这类复杂主动脉疾病的腔内治疗往往要选用分支或“开窗”支架保证重要脏器的血供,这需要术前精准的测量和术中准确的操作,这些在3D打印技术普及之前很难做到。近年来,随着3D打印技术广泛的应用,该类疾病的术式也由“复合手术”逐渐向“全腔内手术”转变[5-6]。
常规的胸主动脉腔内修复和腹主动脉腔内修复手术,在病变近端需要预留的锚定区至少超过15 mm。对于上述复杂主动脉疾病往往需要覆盖分支动脉以增加锚定区,而“开窗”技术则可有效保留分支动脉血供。2019年欧洲血管外科协会认为近肾腹主动脉瘤的治疗决策是复杂且需要个体化的,虽然数据有限,但指南认为“开窗”技术稍优于“烟囱”技术,但是后者可作为急诊的替代选择[7-8]。Ho等[9]比较了患者主动脉CTA和3D打印模型的结果,两者误差< 1 mm,这样的误差在临床上是可接受的。在本研究中,我们将术前3D打印模型的数据和术中DSA的数据作了对照,经分析两者无明显差异,佐证了上述观点。目前3D打印模型制备可以在6 h内完成,所用时间短[10]。我们只对病变段主动脉做了3D打印模型,既节省了时间,也避免了因正常段主动脉形态扭曲等原因造成的支架输送系统进入模型困难的问题。
3D打印技术可1∶1直视主动脉形态及各分支动脉解剖关系,有助于更直观的视觉理解,通过测量距离、角度等可获得更客观的数据[11-12]。本组24例患者均采用了目前广泛应用的“预开窗”技术,即在体外将主动脉覆膜支架释放在透明中空材料3D打印模型中,预先对支架进行体外“开窗”,然后再准确释放至病变部位,该方法克服了原位“开窗”技术体内破膜造成支架损害无法修补、需转流等问题[13]。本研究中所有患者分支动脉通畅率为100%,李逢时等(2020年)及Lombardi等(2020年)认为这可能与3D打印技术对于“开窗”位置的确定更准确有关。本研究的短期随访CTA结果显示主动脉夹层患者术后真腔有所扩大,假腔有所缩小;而主动脉瘤患者术后瘤体最大直径有所减小,提示主动脉重塑良好。但是该结果仍需要大样本量、中长期随访的研究证实。
综上所述,3D打印技术辅助复杂主动脉疾病的腔内治疗是安全且有效的,可使血管疾病的腔内治疗更为精准、高效。
参考文献
[1] 张宏鹏, 鲁通, 郭伟, 刘小平, 贾鑫,熊江, 马晓辉, 王立军. 三维打印主动脉瘤模型辅助术前复杂腔内治疗方案的制定. 中华外科杂志,2015,53(4):300-304.
[2] Dossabhoy SS, simons JP, Flahive JM, Aiello FA, Sheth P, Arous EJ, Messina LA, Schanzer A. Fenestrated endovascular aortic aneurysm repair using physician-modified endovascular grafts versus company-manufactured devices. J Vasc Surg, 2018, 67(6): 1673-1683.
[3] 刘博文, 陈忠, 王盛. 3D打印技术在血管外科领域应用现状及展望.中国实用外科杂志, 2016, 36(3):341-344.
[4] 黄骏咏, 冯家煊, 冯睿, 周建, 景在平. 3D打印技术在血管疾病诊治中的应用. 中国循证心血管医学杂志, 2016, 8(5):627-629.
[5] 杨晗, 胡明, 黄群, 覃忠, 郭思恩, 覃晓. 3D打印辅助覆膜支架修复术在复杂主动脉疾病腔内治疗中的应用. 中国血管外科杂志(电子版), 2018, 10(1):9-14.
[6] Marro A, Bandukwala T, Mak W. Three-dimensional printing and medical imaging: a review of the methods and applications. Curr Probl Diagn Radiol, 2016, 45(1):2-9.
[7] 郭伟, 贺元. 复杂腹主动脉瘤的腔内处理策略.临床外科杂志,2020,28(6):587-589.
[8] Wanhainen A, Verzini F, Van Herzeele I,Allaire E,Bown M, Cohnert T, Dick F, van Herwaarden J, Karkos C,Koelemay M, K?lbel T, Loftus I, Mani K, Melissano G, Powell J, Szeberin Z, Esvs Guidelines Committee, de Borst GJ, Chakfe N, Debus S, Hinchliffe R, Kakkos S, Koncar I, Kolh P, Lindholt JS, de Vega M, Vermassen F, Document Reviewers, Bj?rck M, Cheng S, Dalman R, Davidovic L, Donas K, Earnshaw J, Eckstein HH, Golledge J, Haulon S, Mastracci T, Naylor R, Ricco JB, Verhagen H. Editors Choice-European society for vascular surgery (ESVS) 2019 clinical practice guidelines on the management of abdominal aorto-iliac arteryaneurysms. Eur J Vasc Endo vasc Surg, 2019, 57(1):8-93.
[9] Ho D, Squelch A, Sun Z. Modelling of aortic aneurysm and aortic dissection through 3D printing. J Med Radiat Sci, 2017, 64(1):10-17.
[10] Huang J, Li G, Wang W, Wu KM, Le TM. 3D printing guiding stent graft fenestration: a novel technique for fenestration in endovascular aneurysm repair. Vascular, 2017, 25(4): 442-446.
[11] 袁丁, 左萧, 黄斌, 周轩, 胡耀, 杨轶, 熊飞, 赵纪春, 康裕建. 3D打印技术辅助复杂瘤颈腹主动脉瘤腔内治疗:附1例报道.中国普外基础与临床杂志, 2015, 22(1):96-98.
[12] 王湘, 蔡震宇, 于洪涛, 李刚. 3D打印技术辅助腹主动脉瘤腔内治疗一例.新医学,2020,51(12):82-86.
[13] 罗宇东, 戴向晨. 体外预开窗胸主动脉腔内修复术重建弓部分支血管技术要点及评价. 中国实用外科杂志, 2018, 38(12):1377-1381.
(收稿日期:2021-03-26)
(本文编辑:洪悦民)



