李昌?周成军
【摘要】目的 探讨食管鳞状上皮内瘤变的临床病理学特征,准确把握“细胞异型性”和“组织结构异型性”,为临床病理医师正确诊断食管鳞状上皮内瘤变提供理论依据。方法 选取食管鳞状上皮内瘤变典型病例162例,收集患者临床资料并进行比较,光镜下观察食管鳞状上皮内瘤变的典型表现,总结可能提示瘤变的临床病理学特征,并分析其形成的病理原因。结果 162例食管鳞状上皮内瘤变患者中男女比例为126∶36,年龄(61.48±9.16)岁。在年龄分组中,经Mann-Whitney检验可知,不同年龄食管鳞状上皮内瘤变级别比较差异有统计学意义(Z = -2.911,P = 0.0036)。与< 61岁组相比,食管鳞状上皮内瘤变在 ≥ 61岁人群更易发生。在镜下观察中发现可能提示食管鳞状上皮内瘤变的临床病理学特征,如核质比增大,核分裂像增多;表层角化颗粒及有核细胞增多;瘤变细胞胞质嗜酸性增强;基底层出现皮脂腺样细胞;瘤变细胞平行或斜行生长;细胞排列紊乱、极向消失;成熟梯度消失;异常角化;上皮内血管增生;上皮脚延伸或推挤式生长。结论 食管鳞状上皮内瘤变在 ≥ 61岁男性中更易发生;光镜下可能提示瘤变的临床病理学特征,可以帮助临床病理医师较为容易的把握食管上皮内瘤变的正确诊断。
【关键词】食管;上皮内瘤变;癌前病变;角化颗粒;上皮内血管增生
Clinicopathological features of esophageal squamous intraepithelial neoplasia Li Chang△, Zhou Chengjun.△Department of Pathology, Tengzhou Central Peoples Hospital Affiliated to Jining Medical College, Tengzhou 277500, China
Corresponding author, Li Chang, E-mail: TZlichang@163.com
【Abstract】Objective To investigate the clinicopathological characteristics of esophageal squamous intraepithelial neoplasia(ESIN), and to accurately differentiate between the“cell atypia” and“tissue atypia”, aiming to provide a theoretical basis for accurate diagnosis of ESCI for clinical pathologists. Methods Clinical data of 162 patients with typical ESIN were collected. Typical manifestations of ESIN were observed under light microscope. Clinicopathological features indicative of the neoplasia were summarized, and the pathological causes of the neoplasia were analyzed. Literature review was also conducted. Results The male-to-female ratio was 126∶36 and the average age was (61.48±9.16) years. In the age grouping, Mann-Whitney test showed that the differences in the median ESIN grade among different age groups were statistically significant(Z = -2.911, P = 0.0036). Compared with the < 61-year-old group, ESIN was more likely to occur in the ≥61-year-old group. Light microscopy revealed clinicopathological features indicative of neoplasia, such as increased nuclear-cytoplasmic ratio, increased mitotic figures, more keratinized granules and nucleated cells in the surface layer, eosinophilic cytoplasm of tumor cells, sebaceous gland-like cells in the basal layer, neoplastic cells growing in parallel or obliquely, disordered cell arrangement and absence of polarization, absence of maturation gradient, abnormal keratosis, intraepithelial angiogenesis and epithelial foot extension or push-type growth. Conclusions ESIN is more likely to occur in men aged 61 years or older. Light microscopy reveals potential clinicopathological features indicative of neoplasia, which can assist clinical pathologists to make accurate diagnosis of ESIN.
【Key words】Esophagus; Intraepithelial neoplasia; Precancerous lesion; Keratinized particle; Intraepithelial angiogenesis
食管鳞状上皮内瘤变是食管鳞状上皮发生的癌前病变,表现为不同程度的细胞异型性和组织结构异型性[1]。细胞异型性主要是指细胞核增大、深染,核质比增大,核分裂像增多。组织结构异型性主要是指细胞排列紊乱、极向消失以及上皮向间质生长。食管鳞状上皮内瘤变由食管鳞状上皮基底细胞增生活跃发展而来,最终进展为食管浸润性鳞状细胞癌。食管鳞状上皮内瘤变描述食管鳞状上皮存在细胞和(或)结构上的改变,这些改变可以反映潜在的可以引发浸润性癌的分子学异常[2]。目前食管鳞状上皮内瘤变分为低级别上皮内瘤变和高级别上皮内瘤变。低级别上皮内瘤变指瘤变细胞局限于上皮层的下1/2;高级别上皮内瘤变指瘤变细胞累及上皮的1/2以上至全层,且异型性更加明显。上皮内瘤变关键在于瘤变具有可辨识的形态学特征,具有恶变倾向,但无间质浸润[2]。笔者就一些可能提示食管鳞状上皮内瘤变的病变特点做一总结,希望有助于对食管鳞状上皮内瘤变的诊断。
资料与方法
一、一般资料
本研究中组织切片来源于山东大学第二医院病理科2020年1月至2022年8月食管鳞状上皮内病变典型病例162例,男126例、女36例,年龄(61.48±9.16)岁。其中,鳞状上皮低级别上皮内瘤变23例;鳞状上皮高级别上皮内瘤变139例,其中M1 69例、M2 61例、M3 9例。以性别分组,分为男性组和女性组;以年龄分组,分为< 61岁组和 ≥61岁组。
二、方 法
复阅病例常规切片及免疫组织化学(组化)切片,病理图像经宁波江丰KF-TB-400全自动扫描系统扫描,选择镜下典型病变部位,100、400倍图像输出。
三、食管鳞状上皮内瘤变的诊断
食管鳞状上皮内瘤变的诊断依据2019年第五版WHO食管肿瘤分类及李增山《临床病理诊断与鉴别诊断-消化道疾病》,进行诊断分类[2-3]。鳞状上皮内瘤变局部组织学表现为核增大、染色深、多形性改变和极向紊乱,核分裂象增多。病变局限于鳞状上皮下1/2时为低级别异型增生/上皮内瘤变,超过1/2为高级别上皮内瘤变。瘤变局限于上皮层内,未突破基底膜者,为M1(高级别上皮内瘤变);瘤变突破基底膜,浸润黏膜固有层,为M2(固有膜内浸润性鳞状细胞癌);瘤变浸润黏膜肌层,为M3(固有膜内浸润性鳞状细胞癌,伴黏膜肌侵及)。M2、M3属于食管早癌范畴。
四、统计学处理
采用SPSS 23.0 统计软件进行数据分析,等级资料采用例数(%)表示,组间比较采用秩和检验,P < 0.05为差异有统计学意义。
结果
一、食管鳞状上皮内瘤变患者以性别分组比较
经Mann-Whitney检验可知,男性与女性鳞状上皮内瘤变级别比较差异无统计学意义(Z = 1.759,P = 0.079)。见表1。
二、食管鳞状上皮内瘤变患者以年龄分组比较
经Mann-Whitney检验可知,不同年龄食管鳞状上皮内瘤变级别比较差异有统计学意义(Z = -2.911,P = 0.004),< 61岁患者的食管鳞状上皮内瘤变级别低于 ≥61岁患者。见表2。
三、食管鳞状上皮内瘤变的病理学特征
食管鳞状上皮内瘤变的病理学特征为食管鳞状上皮内瘤变细胞、组织结构异型性增大。
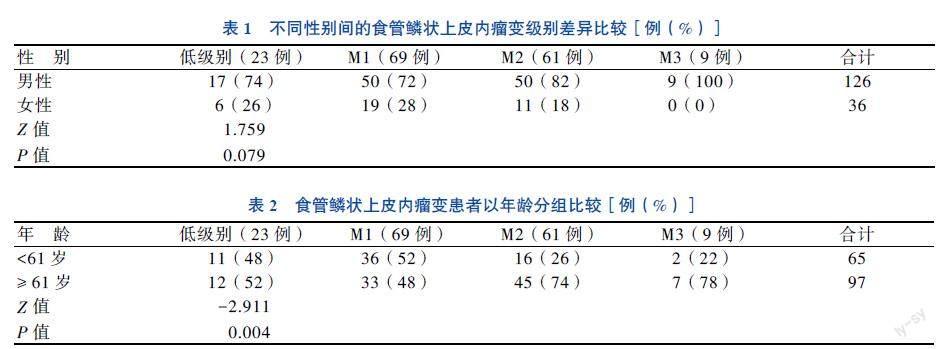
食管鳞状上皮内瘤变细胞异型性增大(图1A~D),具体表现为:①表层角化颗粒及有核细胞增多(图1E、F);②瘤变细胞胞质嗜酸性增强(图1G、H);③基底层出现皮脂腺样细胞(图1I);④瘤变细胞平行或斜行生长(图1J、K)。
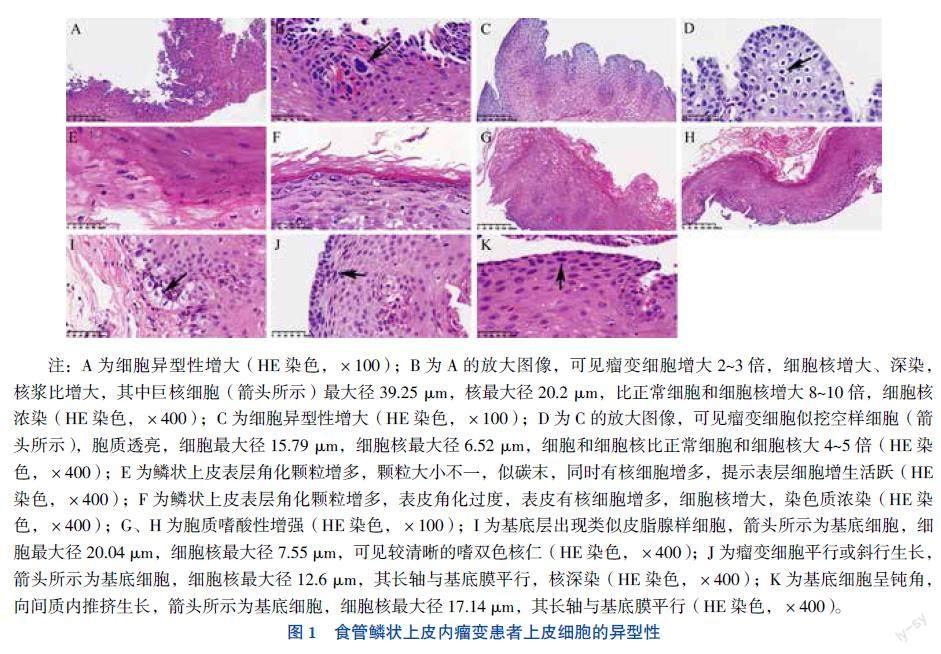
食管鳞状上皮内瘤变组织结构异型性增大(图2A、B),具体表现为:①基底层至表面的成熟梯度消失(图2C);②异常角化(图2D、E);③上皮内血管增生(图2F);④上皮脚延伸或推挤式生长(图2G、H)。
讨论
食管鳞状上皮内瘤变的早诊早治和精准诊治是食管鳞状细胞癌患者治愈率和生存率的关键。临床病理医师准确把握食管鳞状上皮内瘤变的细胞异型性和组织结构异型性,是早诊早治、精准诊治的基础。
食管鳞状上皮内瘤变诊断的一个重要依据是瘤变细胞异型性增大,包括瘤变细胞增大,细胞核增大、深染,核质比增大,核分裂象增多。瘤变细胞在基因水平发生突变,细胞的增殖能力和迁移能力增强,凋亡能力减弱。瘤变细胞获得增殖优势,细胞核和细胞器发生巨大的改变,以适应瘤变细胞快速生长。具体表现为:①表层角化颗粒及有核细胞增多。基底层瘤变细胞异常增生,黑素颗粒伴随瘤变细胞上移至鳞状上皮表层。同时,瘤变细胞细胞核和细胞器不能完全被溶酶体作用,出现在鳞状上皮表层,表层有核细胞增多。②瘤变细胞细胞质嗜酸性增强。表层细胞嗜酸性可较正常上皮细胞增强明显,与周围细胞形成鲜明对比。③基底层出现皮脂腺样细胞,可见基底细胞似“皮脂腺样”增生。细胞体积增大,椭圆形或多边形,细胞核增大,核染色深,胞质空亮,似充满脂质,呈微弱的嗜碱性。与挖空样细胞相比,胞质空而不透,有“蒙纱感”或“毛玻璃感”。④瘤变细胞平行或斜行生长。瘤变细胞位于鳞状上皮下半部及基底层,瘤变细胞呈短梭形,其长轴与基底膜平行或呈夹角斜行排列。在正常鳞状上皮组织,透明层细胞呈平行生长,细胞核呈细杆状,与基底膜平行。笔者认为角化颗粒为黑素颗粒,由基底层黑素细胞合成,瘤变细胞平行或斜行生长,可能与瘤变细胞去分化或上皮间质转化有关,提示瘤变细胞侵袭能力增强。但侯卫华等[4]研究认为,食管梭形细胞型异型增生缺乏上皮-间质转化的证据。
食管鳞状上皮内瘤变诊断的另一个重要依据是瘤变组织结构异型性增大,包括细胞排列紊乱、极向消失,及瘤变细胞向间质浸润生长[5]。具体表现为:①基底层至表面的成熟梯度消失,瘤变细胞失去正常的分化层次,细胞均质红染,无成熟现象。②异常角化,食管鳞状上皮内瘤变时,瘤变细胞向上推挤正常上皮细胞,加速上皮细胞脱落,在上皮表面形成毛刺,严重者可见过度角化和多量毛刺,犹如脱屑。基底细胞异型增生,还可见基底层形成角化珠样结构。③上皮内血管增生[6]。瘤变细胞诱导上皮内血管增生。上皮内血管数量增多,管腔较大,血管周上皮细胞核大深染,异型性较大,无明显的以血管为轴心的同心圆现象。血管周细胞间隙增大,血管腔不规则,红细胞可插入血管周细胞间,但血管周无红细胞外渗现象。④上皮脚延伸或推挤式生长。基底细胞增生活跃,可形成上皮乳头或上皮脚向间质内推挤、楔形插入生长,细胞异型性明显,核深染,核质比增大。笔者认为,这是瘤变细胞异常角化的一种表现,提示瘤变细胞增殖分化紊乱,其可能与鳞状细胞癌形成角化珠机制相同。
笔者体会以上这些可能有助于辅助诊断食管鳞状上皮内瘤变的病变特点,但并非是高度特异性的,这些病变特点在炎症中均可能存在,它们只是提示食管上皮内瘤变的可能,需要在工作中综合判断,不可一以概之。食管鳞状上皮内瘤变的诊断还是要紧贴定义,抓住“细胞异型性”和“组织结构异型性”这两点,重点在“异型”。异型性越大,瘤变可能性越大。
日本与欧美病理学家在食管鳞状上皮内瘤变诊断标准上观点差别很大[7]。最新报道,日本食管协会提出食管上皮内瘤变不再区分低级别和高级别上皮内瘤变,原因是低级别上皮内瘤变可能包括基底鳞状上皮异型增生,日本专家称为基底型鳞状细胞癌[1]。侯卫华等[8]研究认为,日本观点“基底型鳞状细胞癌”包括基底细胞型病例和基底层型高级别异型增生,这两种病变差别明显。大多数专家学者认为基底层型食管鳞状细胞癌的概念适用于瘤变细胞高度异型增生的鳞状细胞病变,这也在2019年WHO食管肿瘤分类中体现[3,9-14]。
本研究结果还显示,食管鳞状上皮内瘤变在≥61岁人群更容易发生,鳞状上皮内瘤变级别越高,两者之间差异越明显。
综上所述,食管鳞状上皮内瘤变在≥61岁男性人群中更易发生,食管鳞状上皮内瘤变的诊断目前还存在许多困难,主要是病理医师对细胞异型性和组织结构异型性的把握存在较大的差距,造成食管上皮内瘤变的诊断结果一致性较低。通过充分认识食管上皮内瘤变的形态学特征,辅助免疫组化检查等,有助于避免漏诊、误诊,使患者获得及时准确的诊断治疗。笔者将继续研究食管上皮内瘤变的可量化诊断标准。
参 考 文 献
[1] 李增山. 临床病理诊断与鉴别诊断-消化道疾病. 北京: 人民卫生出版社, 2020.
[2] 宁浩勇, 虞积耀. 读新版WHO(2010)消化系统肿瘤分类. 诊断病理学杂志, 2011, 18(2): 81-84.
[3] Takubo K, Fujii S. Oesophageal squamous dysplasia// WHO classification of tumours editorial board. WHO classification of tumours. Digestive system tumours. 5th ed. Lyon: IARC Press,2019: 36-37.
[4] 侯卫华, 申民强, 侯卫东, 等. 食管梭形细胞型异型增生临床病理学特征分析. 中华病理学杂志, 2021, 50(10):1353-1359.
[5] 侯卫华, 段心科, 侯卫东, 等. 食管基底细胞型异型增生临床病理学特征分析. 中华病理学杂志, 2021, 50(6): 638-644.
[6] 张金华, 田园, 杨晓萍. 肿瘤血管新生及中医药抗肿瘤血管新生的研究进展. 新医学, 2022, 53(1): 18-21.
[7] Itabashi M, Nasierowska-Guttmejer A, Shimoda T, et al. The importance of the concept and histological criteria of “intraepithelial squamous cell carcinoma” of the esophagus: in comparison between Western and Japanese criteria. Esophagus, 2017, 14(4): 333-342.
[8] 侯卫华, 段心科, 侯卫东, 等. 食管基底层型高级别异型增生临床病理学特征分析. 中华病理学杂志, 2021, 50(3): 236-241.
[9] Goda K, Tajiri H, Ikegami M, et al. Clinical impact of narrow-band imaging magnifying endoscopy for ‘basal layer type squamous cell carcinoma in the esophagus. Dig Endosc, 2011, 23(Suppl 1): 75-78.
[10] Shimizu Y, Yoshida T, Kato M, et al. Low-grade dysplasia component in early invasive squamous cell carcinoma of the esophagus. J Gastroenterol Hepatol, 2010, 25(2): 314-318.
[11] Sarbia M. High-grade dysplasia, restricted to the basal cell layer involving the entire esophagus. World J Gastroenterol, 2015, 21(5): 1663.
[12] Zhuang X, Chen Z, Wang J, et al. Clinicopathological features and outcomes of esophageal lesions containing a basal layer type squamous cell carcinoma component. Cancer Manag Res, 2019, 11: 8507-8516.
[13] Zhao Y, Fu Y W, Sun Q. A unique lesion of the esophageal mucosal epithelium: low-grade intraepithelial neoplasia or basal-layer-type squamous cell carcinoma? Chin Med J (Engl), 2017, 130(13): 1619-1620.
[14] Shimizu Y, Yoshida T, Kato M, et al. Low-grade dysplasia component in early invasive squamous cell carcinoma of the esophagus. J Gastroenterol Hepatol, 2010, 25(2): 314-318.
(收稿日期:2023-02-25)
(本文编辑:杨江瑜)



