马晓黎?孟戈?段华

【摘要】目的 探讨阴道镜下活组织检查(活检)确诊为宫颈上皮内瘤变2级(CIN2)的患者在宫颈环形电切术(LEEP)后病理升级至CIN2以上(CIN2+)的相关风险因素,为CIN2患者的分层管理提供依据。方法 回顾性分析阴道镜下活检病理诊断宫颈CIN2而进一步行LEEP术的210例患者临床资料,观察患者在LEEP手术前、后的病理诊断,采用单因素及多因素Logistic回归分析患者年龄、初次液基薄层细胞学检查(TCT)结果、高危型人乳头瘤病毒(HPV)分型、阴道镜下病变累及象限数目、可见病变面积占宫颈表面积的比例、可见病变的最长线性长度、转化区类型、病变是否累及腺体和阴道镜图像特征等相关因素与LEEP术后病理升级的关系。结果 210例阴道镜下活检病理诊断的宫颈CIN2中,37例(17.6%)LEEP术后病理诊断为CIN2+,其中1例为宫颈鳞癌IB1期。单因素分析显示LEEP术后病理升级与患者年龄、阴道镜下病变累及象限数目、可见病变面积占宫颈表面积的比例、可见病变的最长线性长度、转化区类型及阴道镜图像特征有关(P均< 0.05)。多因素分析显示,阴道镜下病变累及>1个象限、可见病变面积占宫颈表面积的比例≥1/3、转化区3型及阴道镜图像有2种及以上2级征象是LEEP术后病理升级的高危因素(P均< 0.05)。对于26~50岁的患者,可见病变面积占宫颈表面积的比例≥1/3、转化区3型及阴道镜图像2种及以上2级征象是LEEP术后病理升级的高危因素(P均< 0.05)。结论 阴道镜下宫颈活检确诊的CIN2中有漏诊CIN2+的情况存在,随着可见病变面积占宫颈表面积的比例增高(≥1/3)、阴道镜下鳞柱交接部不可见及阴道镜图像中2级征象占比增多(≥2个),漏诊CIN2+的风险增加。对于有生育意愿的CIN2患者如存在以上高危因素,建议谨慎选择随访观察。
【关键词】 阴道镜检查;宫颈上皮内瘤样病变;宫颈环形电切术;病理升级;影响因素;液基薄层细胞学检查
Analysis of high risk factors of pathological escalation after LEEP in CIN2 diagnosed by colposcopic biopsy Ma Xiaoli,Meng Ge, Duan Hua. Department of Gynecology Minimal Invasive Center, Beijing Obstetrics and Gynecology Hospital, Capital Medical University, Beijing Maternal and Child Health Care Hospital, Beijing 100006, China
Corresponding author, Duan Hua, E-mail: duanhua@ccmu.edu.com
【Abstract】 Objective To investigate the risk factors associated with pathological escalation to cervical intraepithelial neoplasia grade 2 (CIN2) or above (CIN2+) in patients with CIN2 confirmed by colposcopic biopsy, aiming to provide evidence for the stratified management of CIN2 patients. Methods Clinical data of 210 patients who underwent LEEP surgery after pathological diagnosis of cervical CIN2 by colposcopic biopsy were retrospectively analyzed. Pathological diagnosis of patients before and after LEEP surgery was observed. The relationship between pathological escalation after LEEP, and age,results of primary liquid-based thin-layer cytology (TCT), typing of high-risk human papillomavirus (HPV), the number of affected quadrants of lesions under colposcopy, the proportion of visible lesion area to cervical surface area, the longest linear length of the lesion, the type of transformation zone (TZ), whether the lesion was involved with glands and the characteristics of colposcopic images was assessed by univariate and multivariate Logistic regression analyses. Results Among 210 cases of cervical CIN2 diagnosed by colposcopic biopsy, 37 cases (17.6%) were pathologically diagnosed with CIN2+ after LEEP, and 1 case was diagnosed with cervical squamous cell carcinoma stage IB1. Univariate analysis showed that pathological escalation after LEEP was associated with the age of patients, the number of affected quadrants of lesions under colposcopy, the proportion of visible lesion area to cervical surface area, the longest linear length of visible lesions, the type of transformation zone,and the characteristics of colposcoic images (all P < 0.05) . Multivariate analysis showed that the number (>1) of affected quadrants of lesions under colposcopy,the proportion (≥1/3) of visible lesion area to cervical surface
area, TZ3 type and the characteristics (≥2) of colposcopic images were the high-risk factors for pathological escalation after LEEP (all
P < 0.05) . For patients aged 26-50 years, the proportion (≥1/3) of lesion area to cervical surface area, TZ3 type and the characteristics
(≥2) of colposcopic images were the high-risk factors for pathological escalation after LEEP (all P < 0.05) . Conclusions Colposcopic biopsy may miss the diagnosis of CIN2+ in patients diagnosed with CIN2. The risk of missing the diagnosis of CIN2+ is increased with the increase of the proportion of visible lesion area to cervical surface area (>1/3), the invisibility of the squamous-column junction under colposcopy,and the proportion of grade 2 signs in colposcopic images (≥2). For patients with CIN2 who are willing to have children,if they have the above high-risk factors,it is recommended to carefully deliver follow-up observation.
【Key words】Colposcopy; Cervical intraepithelial neoplasia; Loop resection of the cervix; Pathological escalation;
Influencing factor; Thin-prep cytology test
近年来,随着我国宫颈癌筛查的普及和阴道镜检查的广泛应用,宫颈高级别鳞状上皮内病变(HSIL)的检出率呈逐年上升趋势。WHO于2014年发布的女性生殖器官肿瘤分类标准中将宫颈上皮内瘤变2级(CIN2)与CIN3合并为HSIL,但CIN2与CIN3有着不同的生物学特征和预后。CIN3被认为是宫颈癌的直接前兆,任何年龄的患者均应接受治疗。与CIN3不同,CIN2有相当可观的消退率,在充分评估受益及风险后,对部分CIN2患者进行随访观察是安全、可行的。美国阴道镜和宫颈病理学会(ASCCP)于2020年4月发布的2019版最新指南明确建议组织学报告HSIL应包括CIN2或CIN3限定语,25岁以下CIN2患者首选观察,25岁以上担忧治疗影响未来妊娠超过担忧癌症的CIN2患者可接受观察[1]。2022年3月《子宫颈高级别上皮内病变管理的中国专家共识》中也建议对于年轻有生育能力且有生育要求的CIN2患者,如宫颈新鳞柱交接部(SCJ)及病灶完全可见,并且患者具备随访条件时,可选择随访观察[2]。由于宫颈锥切术在不同程度上破坏了宫颈的解剖学结构,存在发生胎膜早破、流产、早产及低出生体质量儿等术后产科不良结局的风险[3-4]。自我国三孩政策开放以来,宫颈CIN2患者对生育能力的保留需求日益迫切,当下亟须解决的核心问题是宫颈CIN2患者的精细化和个体化管理。本研究针对阴道镜活组织检查(活检)病理确诊CIN2并在短期内行宫颈环形电切术(LEEP)的患者,进行术前及术后病理诊断对比研究,分析发生术后病理升级的相关影响因素,以期为CIN2的个体化治疗提供依据。
对象与方法
一、研究对象
采用回顾性分析,选择本院妇科微创中心门诊2021年7月至2022年5月期间经阴道镜下宫颈多点活检病理检查证实为CIN2,且于短时间内行LEEP术的210例患者为研究对象。排除有免疫系统疾病或服用免疫抑制剂者、有宫颈手术史或盆腔放射治疗史者、阴道镜检查不充分以及临床资料不全者。所有患者均在阴道镜检查前进行宫颈液基薄层细胞学检查(TCT)及人乳头瘤病毒(HPV)检测,临床资料完整。根据上述标准,共纳入210例患者,患者年龄(36.29±7.47)岁。LEEP术距离活检时间38(8,121)d。患者均对研究知情同意并签署知情同意书,研究方案经本院伦理委员会批准(批件号:2019-KY-105-01)。
二、研究方法
1. 宫颈脱落细胞学检查
选用美国Hologic公司的宫颈管专用取样无菌毛刷,置入宫颈管内,轻旋6~10圈,收集宫颈管与宫颈外口脱落细胞,放入保存液瓶内,洗刷10次以上,盖瓶盖后送检并行TCT制片。阅片诊断由至少2位本院经验丰富的细胞学医师独立进行,并按照2001年美国国家癌症研究所(NCI)推荐的Bethesda报告系统(TBS)标准对细胞学检查结果进行分类[5]。
2. HPV检测
采用美国Aptima公司的HPV分型检测设备,检测14种高危型HPV亚型,包括HPV-16、18、31、33、35、39、45、51、52、56、58、59、66和68。
3. 阴道镜活检
应用德国莱斯康光电一体电子阴道镜系统,按照阴道镜操作规范进行阴道镜活检。根据国际宫颈病理与阴道镜联盟(IFCPC)及ASCCP的阴道镜检查术语对阴道镜图像进行描述和诊断[6-7]。转化区分为1型、2型和3型。阴道镜图像的分级包括1级征象、2级征象、非特异性征象、可疑浸润癌征象及杂类。
4. LEEP
采用美国华莱士高频电波刀,一般电切功率设定为50 W,电凝功率设定为20~40 W。根据病变范围、转化区类型选择合适的环形电极型号。切除深度根据转化区的类型而定,控制在1.0~
2.5 cm,切除宽度为病变区域外0.3~0.5 cm。将切除的宫颈组织标本12点位置进行系线标记,用10%甲醛溶液固定并送病理检查。
5. 病理检查
对宫颈组织标本进行连续切片并进行组织学检查,由我院病理科2名以上医师阅片后一致诊断。病理分类依据2014年WHO女性生殖器官肿瘤学分类标准进行:低级别鳞状上皮内病变(LSIL)包括CIN1和p16阴性的CIN2,HSIL包括p16阳性的CIN2和CIN3[8]。
三、统计学处理
采用SPSS 22.0对临床数据进行统计学分析。正态分布的定量资料以表示,非正态分布的定量资料以M(P25,P75)表示。定性资料用百分比表示,用χ 2检验或Fisher确切概率法进行单因素分析,并对单因素分析有统计学意义的项目进行多因素Logistic回归分析(向前逐步回归法),筛选与阴道镜活检漏诊CIN2+相关的影响因素。P < 0.05为差异有统计学意义。
结果
一、阴道镜活检CIN2患者发生LEEP术后病理升级的临床特征及结果分析
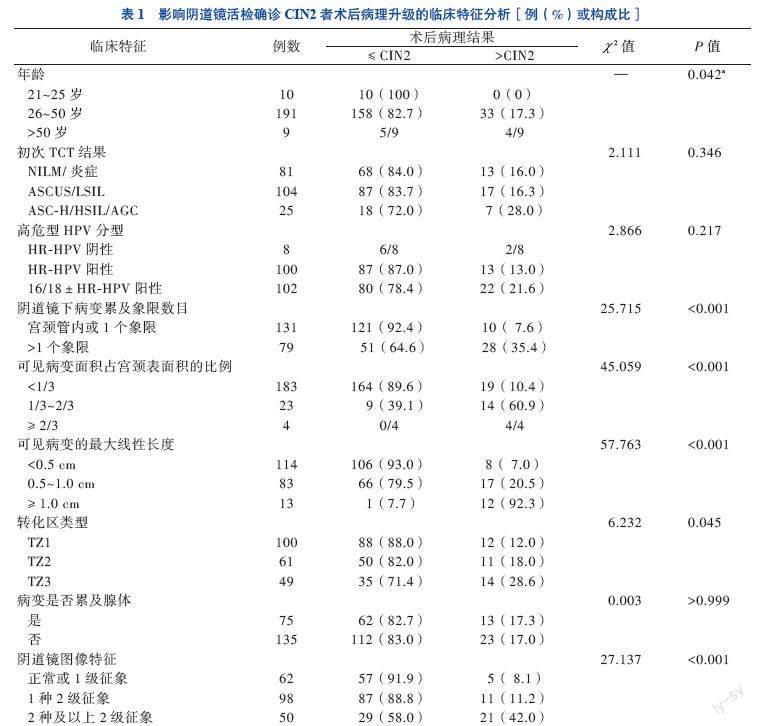
210例患者中,TCT检测结果正常81例,不典型鳞状细胞性质未定(ASC-US)54例,LSIL 50例,不排除高度不典型增生、不明意义的非典型鳞状上皮细胞(ASC-H)9例,HSIL 15例,非典型腺细胞(AGC)1例,HR-HPV检测阴性8例,HR-HPV检测阳性202例。8例HR-HPV阴性患者中2例TCT检测结果为ASC-H,6例为LSIL。阴道镜活检确诊CIN2的210例患者LEEP术后病理结果显示,173例(82.4%)≤CIN2,其中29例正常、60例为LSIL(CIN1或CIN1~2)、84例为HSIL(CIN2);37例(17.6%)为CIN2+及宫颈癌,其中29例为CIN2~3、7例为CIN3,1例为宫颈鳞癌IB1期。在25例高级别细胞学异常者中,7例(28.0%)LEEP术后病理升级为CIN2+。这7例中,5例为HPV16/18阳性、2例为HR-HPV阳性,4例为转化区部分位于宫颈外口以内,不能全部可见,即转化区3型(TZ3型),4例可见病变面积占宫颈表面积的比例大于1/3,3例阴道镜图像中可见2种及以上2级征象。
二、阴道镜活检CIN2患者发生LEEP术后病理升级的单因素分析
210例阴道镜活检诊断CIN2中,37例(17.6%)LEEP术后病理为CIN2+出现术后病理升级。单因素分析显示,患者年龄、阴道镜下病变累及象限数目、可见病变面积占宫颈表面积的比例、可见病变的最长线性长度、转化区类型和阴道镜图像特征与LEEP术后病理升级有关(P均< 0.05),初次TCT结果、高危型HPV分型、病变是否累及腺体与LEEP术后病理升级无关(P > 0.05)。见表1。
三、阴道镜活检确诊CIN2与LEEP术后病理升级的多因素分析
1. 全年龄段组
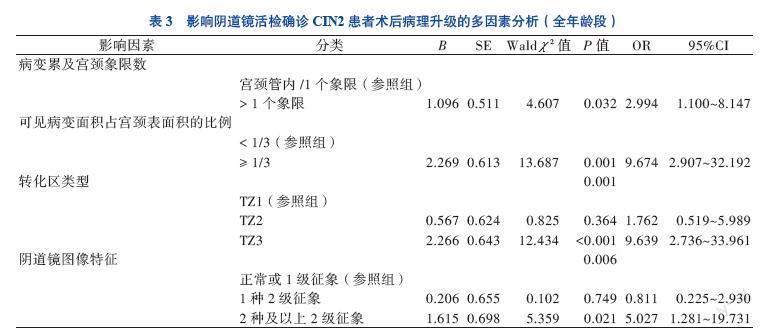
多因素分析采用二元Logistic回归分析的似然比前进法筛选变量,引入变量的检验水准为0.05,将患者年龄、高危型HPV分型、阴道镜下病变累及象限数目、可见病变面积占宫颈表面积的比例、可见病变的最长线性长度、转化区类型及阴道镜图像特征作为自变量,各变量的具体赋值见表2。结果显示,阴道镜下病变累及>1个象限(OR=2.994,95%CI 1.100~8.147,P < 0.05)、可见病变面积占宫颈表面积的比例≥1/3(OR=9.674,95%CI 2.907~32.192,P < 0.05)、T3型(OR=9.639,95%CI 2.736~33.961,P < 0.05)及阴道镜图像有2种及以上2级征象(OR=5.027,95%CI 1.281~19.731,P < 0.05)是LEEP术后病理升级的高危因素。见表3。
2. 育龄期组(26~50岁)
将患者年龄、阴道镜下病变累及象限数目、可见病变面积占宫颈表面积的比例、可见病变的最长线性长度、转化区类型及阴道镜图像特征作为自变量,结果显示26~50岁的患者中,可见病变面积占宫颈表面积的比例≥ 1/3(OR=16.632,95%CI 5.014~55.166,P < 0.05)、TZ3型(OR=6.059,95%CI 1.706~21.522,P < 0.05)及阴道镜图像有2种及以上2级征象(OR=4.074,95%CI 1.061~15.648,P < 0.05)是LEEP术后病理升级的高危因素。见表4。
讨论
2022年3月发布的《子宫颈高级别上皮内病变管理的中国专家共识》中指出,50%的CIN2可在2年内自然消退,32%持续存在,仅18%会发生进展;对于年龄<30岁的年轻患者,CIN2的自然消退率可高达60%,仅11%会发生进展[2]。当患者具备随访条件,宫颈SCJ及病灶完全可见时,年轻有生育能力且有生育要求的CIN2患者可选择随访观察[9]。美国凯撒医疗机构(KPNC)的一项研究纳入了2 417例21~39岁CIN2采取保守治疗的患者,每隔半年进行1次联合筛查和阴道镜检查,平均随访4年,结果显示50%的患者消退至CIN1或更低水平[10]。丹麦一项队列研究在6 721例18~44岁CIN2的患者中选取半数采取保守治疗,结果显示保守治疗患者中有50%消退[11]。加拿大一项回顾性研究对636例年龄<25岁的CIN2患者采取保守治疗,结果显示CIN2消退率高达73.1%[12]。因此,探究如何对阴道镜活检诊断CIN2的患者进行综合评估并从中筛选出适宜随访观察的患者,争取在不漏诊CIN2+的前提下,为生育功能保护赢得更多时间和机会,这对临床决策的制定具有重要意义。因为年龄<25岁的CIN2患者首选观察,而50岁以上的患者大多已绝经,无生育要求,首选子宫颈锥切术,无需评估保守治疗的风险,故本研究根据患者年龄分组分析。
KPNC的数据显示,细胞学HSIL同时合并HPV16阳性的即时CIN3+风险为60%,CIN2+风险为77%,即时癌症风险为8.1%[13-14]。美国疾病控制与预防中心(CDC)的宫颈癌早期检测项目数据显示,既往5年内未规律进行宫颈癌筛查的女性,若HPV阳性(无论何种基因型)且细胞学HSIL,其即时CIN3+风险为64%,CIN2+风险为82%。诸多研究显示,在接受快速治疗的细胞学HSIL患者中,有49%~75%诊断为CIN3+[15-19]。正是基于大量研究数据,ASCCP 2019版最新指南建议25岁以上的非妊娠患者,若HPV16阳性且细胞学HSIL,或者患者从未进行规律筛查,HPV阳性(无论何种基因型)且细胞学HSIL,建议直接进行快速治疗,无需先行阴道镜活检证实CIN2+。本研究中25例高级别细胞学异常者中,7例(46.7%)患者的LEEP术后病理升级为CIN2+,高于低级别细胞学异常或正常患者(16.2%)。这7例患者中,5例为HPV16/18阳性,2例为HR-HPV 阳性,4例为TZ3,4例可见病变面积占宫颈表面积的比例大于1/3,3例阴道镜图像中可见2种及以上2级征象。因此,对于细胞学HSIL、ASC-H、AGC及HPV16/18阳性这些筛查高级别异常者,在进行阴道镜活检时应提高警惕,规范操作,对宫颈病变进行细致且全面的评估,提高阴道镜活检诊断的准确性。
众所周知,阴道镜下病变累及范围越广泛,宫颈鳞状上皮内病变程度就越高,且阴道镜下活检取点的主观性和随机性增加,漏诊CIN2+的风险也随之增加。Mantoani等[20]对宫颈病变面积与CIN程度的关系进行研究,通过受试者操作特征(ROC)曲线分析诊断宫颈CIN2+的最佳截断值,并提出可将宫颈病变面积用以区分宫颈LSIL和HSIL的观点。Munmany等[21-22]的2项研究均发现宫颈病变面积≤12 mm2可以有效预测LEEP术后的阴性病理结果,术前或术时进行宫颈病变面积的测量能减少不必要的手术干预。本研究显示,当可见病变面积占宫颈表面积的比例>1/3时LEEP术后病理升级的风险较大,这对于年龄26~50岁者的意义更大。因此,当可见病变面积占宫颈表面积的比例大于1/3时,需谨慎选择随访观察。
研究显示,TZ1、TZ2和TZ3对于CIN2+检出的准确率分别为92.2%、90.5%和76.5%[23]。TZ3者CIN2+漏诊风险增高。转化区类型与患者年龄具有明显的线性关系,提示年龄越大,3型转化区者比例就越高,有研究报道,TZ3是50岁以上患者唯一的转化区类型[24]。本研究在全年龄段分析中,转化区类型是LEEP术后病理升级的影响因素。对26~50岁者的分析也得到同样的结果,转化区类型也是LEEP术后病理升级的影响因素。本研究结果与文献报道相符,均提示TZ3患者漏诊CIN2+的风险增高。本研究中有一例患者虽然可见病变面积不大,占宫颈表面积的1/3以下,但其病变隐匿,延伸至宫颈管内,为TZ3,LEEP术后病理升级为宫颈癌。因此,ASCCP及中国专家共识均建议对于年轻有生育能力且有生育要求的CIN2患者,仅当宫颈SCJ及病灶完全可见时才予以随访观察。
IFCPC阴道镜术语指出2级征象对HSIL的诊断表现出极高的指向性,厚醋酸白上皮仍较薄醋酸白上皮具有更高的真实性价值[25]。有研究表明,鳞状细胞上皮越薄时阴道镜下HSIL特征越不明显,当宫颈鳞状上皮厚度>441 μm时阴道镜下检出HSIL的灵敏度为94.4%,当宫颈鳞状上皮厚度为0~139 μm时阴道镜下检出HSIL的灵敏度为31.3%[26]。本研究在全年龄段分析中,阴道镜图像特征是LEEP术后病理升级的影响因素,对26~50岁者的分析中,虽然OR值有所下降,但结果仍有统计学意义。
综上所述,宫颈CIN2的管理需要根据患者年龄、生育能力及生育需求、初次宫颈筛查结果及阴道镜表现等进行多因素综合评估。当存在高危因素如可见病变面积占宫颈阴道部面积比例增高(>1/3)、SCJ不可见及阴道镜图像中2级征象占比增多(≥2个)时,漏诊CIN2+及LEEP术后病理升级的风险明显增加,建议谨慎选择随访观察。
参 考 文 献
[1] Perkins R B, Guido R S, Castle P E, et al. 2019 ASCCP risk-based management consensus guidelines for abnormal cervical cancer screening tests and cancer precursors. J Low Genit Tract Dis, 2020, 24(2): 102-131.
[2] 赵超, 毕蕙, 赵昀, 等. 子宫颈高级别上皮内病变管理的中国专家共识. 中国妇产科临床杂志, 2022, 23(2): 220-224.
[3] Maina G, Ribaldone R, Danese S, et al. Obstetric outcomes in patients who have undergone excisional treatment for high-grade cervical squamous intra-epithelial neoplasia. Eur J Obstet Gynecol Reprodusctive Biol, 2019, 236: 210-213.
[4] Kyrgiou M, Athanasiou A, Kalliala I E J, et al. Obstetric outcomes after conservative treatment for cervical intraepithelial lesions and early invasive disease. Cochrane Database Syst Rev, 2017, 11(11): CD012847.
[5] Pangarkar M A. The Bethesda System for reporting cervical cytology. Cytojournal, 2022, 19: 28.
[6] Qin D, Bai A, Xue P, et al. Colposcopic accuracy in diagnosing squamous intraepithelial lesions: a systematic review and meta-analysis of the International Federation of Cervical Pathology and Colposcopy 2011 terminology. BMC Cancer, 2023, 23(1): 1-16.
[7] Wentzensen N, Massad L S, Mayeaux E J Jr, et al. Evidence-based consensus recommendations for colposcopy practice for cervical cancer prevention in the United States. J Low Genit Tract Dis, 2017, 21(4): 216-222.
[8] Mayr D, Schmoeckel E, H?hn A K, et al. Current WHO classification of the female genitals: many new things, but also some old. Pathologe, 2021, 42(3): 259-269.
[9] Tainio K, Athanasiou A, Tikkinen K A O, et al. Clinical course of untreated cervical intraepithelial neoplasia grade 2 under active surveillance: systematic review and meta-analysis. BMJ, 2018, 360: k499.
[10] Silver M I, Gage J C, Schiffman M, et al. Clinical outcomes after conservative management of cervical intraepithelial neoplasia grade 2 (CIN2) in women ages 21-39 years. Cancer Prev Res (Phila), 2018, 11(3): 165-170.
[11] Skorstengaard M, Lynge E, Suhr J, et al. Conservative management of women with cervical intraepithelial neoplasia grade 2 in Denmark: a cohort study. BJOG Int J Obstet Gynaecol, 2020, 127(6): 729-736.
[12] Loopik D L, Bekkers R L M, Massuger L F A G, et al. Justifying conservative management of CIN2 in women younger than 25 years: a population-based study. Gynecol Oncol, 2019, 152(1): 82-86.
[13] Egemen D, Cheung L C, Chen X, et al. Risk estimates supporting the 2019 ASCCP risk-based management consensus guidelines. J Low Genit Tract Dis, 2020, 24(2): 132-143.
[14] Demarco M, Egemen D, Raine-Bennett T R, et al. A study of partial human papillomavirus genotyping in support of the 2019 ASCCP risk-based management consensus guidelines. J Low Genit Tract Dis, 2020, 24(2): 144-147.
[15] Silver M I, Andrews J, Cooper C K, et al. Risk of cervical intraepithelial neoplasia 2 or worse by cytology, human papillomavirus 16/18, and colposcopy impression. Obstet Gynecol, 2018, 132(3): 725-735.
[16] Sachan R, Shukla A, Patel M, et al. Single step “See and Treat” strategy might be replacing the “conventional three step strategy” in management of preinvasive cervical lesions at tertiary center: a North Indian study. J Can Res Ther, 2022, 18(6): 1541.
[17] Loopik D L, Siebers A G, Melchers W J G, et al. Clinical practice variation and overtreatment risk in women with abnormal cervical cytology in the Netherlands: two-step versus see-and-treat approach. Am J Obstet Gynecol, 2020, 222(4): 354.e1-354.e10.
[18] Rongthongaram W, Plumworasawat S, Charakorn C, et al. Overtreatment in the see-and-treat approach for high-grade squamous cervical cytology. Eur J Obstet Gynecol Reproductive Biol X, 2023, 19: 100205.
[19] Ciavattini A, Morini S, Delli Carpini G, et al. Factors related to overtreatment in the see-and-treat approach: a retrospective multicentric observational study. J Low Genit Tract Dis, 2019, 23(2): 129-132.
[20] Mantoani P T S, Jammal M P, Caixeta J M, et al. Association of lesion area measured by colposcopy and cervical neoplasia. J Obstet Gynaecol, 2022, 42(2): 306-309.
[21] Munmany M, Marimon L, Cardona M, et al. Small lesion size measured by colposcopy may predict absence of cervical intraepithelial neoplasia in a large loop excision of the transformation zone specimen. BJOG Int J Obstet Gynaecol, 2017, 124(3): 495-502.
[22] Munmany M, Torné A, Nonell R, et al. Colposcopy evaluation at the time of loop electrosurgical excision procedure may avoid unnecessary treatment. J Low Genit Tract Dis, 2018, 22(4): 367-374.
[23] Stuebs F A, Schulmeyer C E, Mehlhorn G, et al. Accuracy of colposcopy-directed biopsy in detecting early cervical neoplasia: a retrospective study. Arch Gynecol Obstet, 2019, 299(2): 525-532.
[24] Gustafson L W, Hammer A, Bennetsen M H, et al. Cervical intraepithelial neoplasia in women with transformation zone type 3: cervical biopsy versus large loop excision. BJOG Int J Obstet Gynaecol, 2022, 129(13): 2132-2140.
[25] 毕蕙, 李明珠, 赵超, 等. 子宫颈低级别鳞状上皮内病变管理的中国专家共识. 中国妇产科临床杂志, 2022, 23(4): 443-445.
[26] 王爱春, 王利群, 李静, 等. 人工智能技术辅助测量宫颈黏膜鳞状上皮厚度及其与宫颈癌前病变的相关性分析. 中华病理学杂志, 2021, 50(4):339-343.
(收稿日期:2023-08-10)
(本文编辑:林燕薇)



