改良人原代脐静脉内皮细胞的分离及鉴定*
网络出版地址:http://www.cnki.net/kcms/detail/52.5012.R.20150113.1849.012.html
崔丽丽, 余芳芳, 左丽**
(贵阳医学院 免疫学教研室, 贵州 贵阳550004)
[摘要]目的: 优化人脐静脉内皮细胞(HUVECs)的分离及培养方法。方法: 在传统HUVECs分离的基础上进行改进,通过Ⅰ型胶原酶消化分离HUVECs,利用倒置显微镜观察其生长状况、免疫组织化学方法及流式细胞术检测所培养细胞的纯度。结果: 改良实验步骤和精简操作后,HUVECs分离不受影响,分离的HUVECs在体外2~4 d可长成单层,倒置显微镜下可见细胞呈“鹅卵石”状排列,Ⅷ因子免疫组化实验阳性,流式细胞术检测细胞纯度达99.37%。结论: 用胶原酶消化法分离HUVECs具有培养周期短,所获得的HUVECs纯度较高的优点,有利于体外血管内皮细胞模型的建立。
[关键词]内皮,血管; 脐静脉; 免疫组织化学; 细胞培养; 细胞分离; 流式细胞术
血管是人体的重要器官,血管内皮细胞(vascular endothelial cell,VECs)是覆盖其内膜表面的单层扁平或多角形的细胞。VECs既是感应细胞又是效应细胞,不仅能感知血液中的炎性信号、激素水平、切应力及压力等信息,而且能通过分泌多种血管活性物质对这些信息作出反应。血管内皮细胞在生理止血、血管渗透及血管对于其他生理性和病理性刺激做出的反应中起重要的作用[1-6]。血管内皮细胞的培养是体外研究大血管内皮细胞功能的重要手段。Jaffe等[7]首次从人脐静脉中分离出内皮细胞(ECs)并在体外培养成功后,人脐静脉内皮细胞(human umbilical vein endothelial cell, HUVECs) 作为体外研究 ECs 的模型受到研究者的关注。新生儿脐带由于取材方便,来源充足,而成为体外内皮细胞实验的主要材料。本实验采用改良的胶原酶消化法分离培养HUVECs、免疫组化法对其进行鉴定及流式细胞术检测纯度,通过改良方法可大量获得纯度较高的血管内皮细胞。
1材料与方法
1.1材料
1.1.1标本来源与采集
标本均来自于正常足月娩出的新生儿脐带。配制含0.49%葡萄糖的PBS缓冲液150 mL装于已泡酸处理的250 mL玻璃瓶中,4 ℃保存待用。取脐带时将脐带无菌条件下浸入瓶中,运输时加冰袋保持低温,取材后3 h内完成对HUVECs处理。
1.1.2主要试剂与仪器
M199/EBSS培养液(Hyclone)、胎牛血清(Gibico 公司, 美国)、Ⅰ型胶原酶(Sigma,美国)、Hanks液(corning公司,美国)、0.25%胰蛋白酶(Hyclone)、 内皮细胞生长添加物(ECGS, Sciencell 公司, 美国) , 双抗(Hyclone)、肝素纳、明胶, 兔抗人Ⅷ因子相关抗原抗体(北京中杉金桥生物技术有限公司,中国) , FITC-抗人 CD31 抗体 (Abcam公司, 美国) 。倒置显微镜(NIKON 公司, 日本) , 超净工作台(苏州净化设备有限公司, 中国) , 体积分数5%的CO2培养箱 (Thermo,美国) , 离心机(Thermo,美国) , 流式细胞仪(Beckman公司, 美国) 。
1.2方法
1.2.1HUVECs分离、培养
取新生儿脐带约20 cm,剔除血肿以及坏死出血部位,用7号输液器针头插入脐静脉一端,止血钳固定,用4 ℃预冷的PBS 100 mL冲洗脐静脉完全去除红细胞。夹闭脐带另一端,注入37 ℃预温处理(用Hanks液配制)的0.1%I型胶原酶10 mL于脐静脉内,用手轻揉按摩脐带,使其分布均匀,消化充分,将装有脐带的无菌铝盒放入5% CO2温箱37 ℃孵育15 min。用50 mL无菌离心管收集脐静脉内的消化液, PBS反复冲洗脐静脉,冲洗液也收集于50 mL无菌离心管中,800 r/min离心5 min,弃上清,沉淀即为HUVECs。往沉淀加入M199培养液(含10%胎牛血清、50 mg/L ECGS、100 U/mL 青霉素、100 Ug/mL 链霉素及0.1 g/L肝素),重悬细胞沉淀,接种于用明胶包被的T25细胞培养瓶明胶(提前1 d用明胶包被,用前用PBS缓冲液洗涤1~2次),放入5% CO2培养箱37 ℃培养,24 h后全量换液,此后1~2 d换液1次,直至细胞80%~90%融合。
1.2.2HUVECs传代培养
原代内皮细胞融合至80%~90%后,弃去培养液,用PBS洗涤2~3次,加入0.25%胰蛋白酶1 mL 37 ℃消化5 min,镜下观察细胞皱缩变圆,彼此分离或大片状分离时加入3~4倍胰酶体积的M199培养液(含10%胎牛血清)终止消化,重悬细胞后继续培养。
1.2.3HUVECs的鉴定方法
1.2.3.1HUVECs形态鉴定用倒置显微镜每天镜下观察细胞的形态。
1.2.3.2Ⅷ因子相关抗原检测将HUVECs悬液接入96孔板,100 μL/孔(105个/孔),细胞长满时,采用免疫组织化学法鉴定Ⅷ因子相关抗原,一抗为兔抗人内皮细胞Ⅷ因子相关抗原多克隆抗体(稀释比例为1∶50),阴性对照为BHK细胞,空白对照用PBS。
1.2.3.3流式细胞术检测取2瓶基本长满的HUVECs,用0.25%胰蛋白酶消化,离心弃上清。加入10%胎牛血清重悬细胞,室温或4 ℃孵育15 min,用PBS洗涤1次,离心后用1 200 μL PBS将细胞重悬,均分为3份。1份加入5 μL FITC标记抗CD31抗体作为检测组;1份作为阴性,不加任何抗体;1份作为同型对照,加入5 μL相关同型抗体(eBioscience,鼠 IgG1,κ,FITC)。3份样品均4 ℃孵育30 min, PBS洗涤2次,重悬细胞,上机检测CD31表达。
2结果
2.1HUVECs形态
接种分离原代HUVECs 4 h 后,细胞开始贴壁生长, 1~2 d后融合成片, 即原代培养的周期为2~3 d。 第1天见细胞呈梭形,成团贴壁,逐渐向外扩散生长,呈单层, 胞核呈圆形或椭圆形,呈“鹅卵石”状排列(图1)。
2.2Ⅷ因子相关抗原检测
免疫组织化学染色示,细胞呈圆形、梭形或多边形, 胞浆内含有棕黄色颗粒,此为Ⅷ因子阳性特征,证实为内皮细胞(图2)。
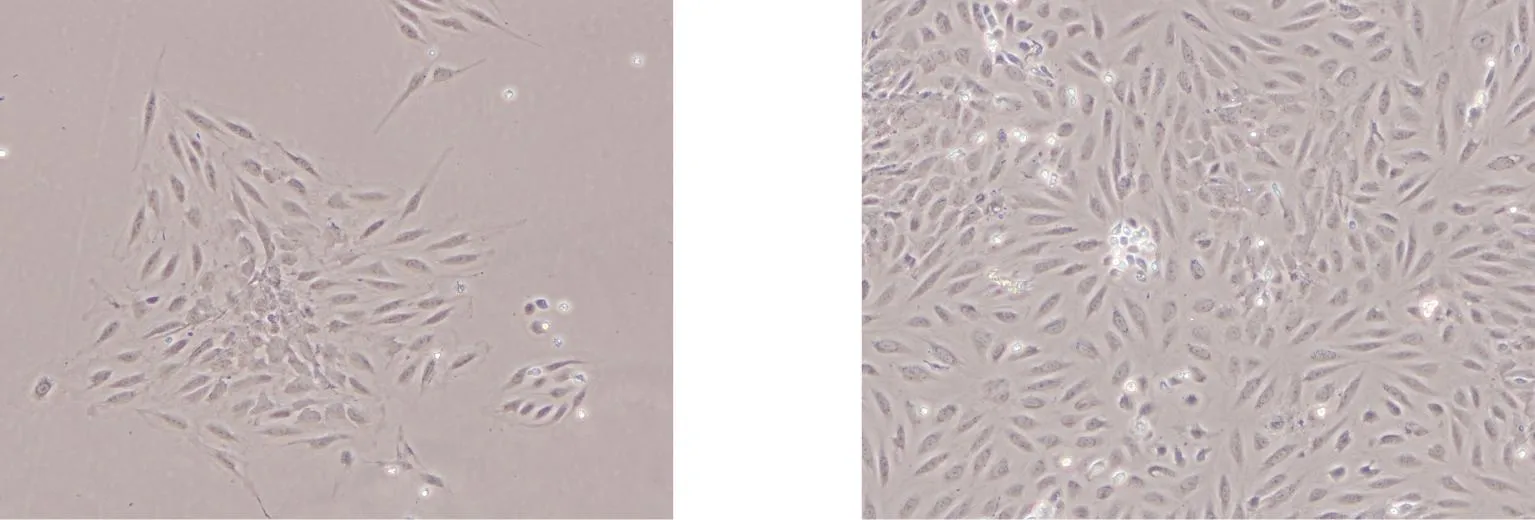
原代培养24 h 原代培养第2天图1 原代HUVECs培养(100×)Fig.1 Primary culture of HUVECs
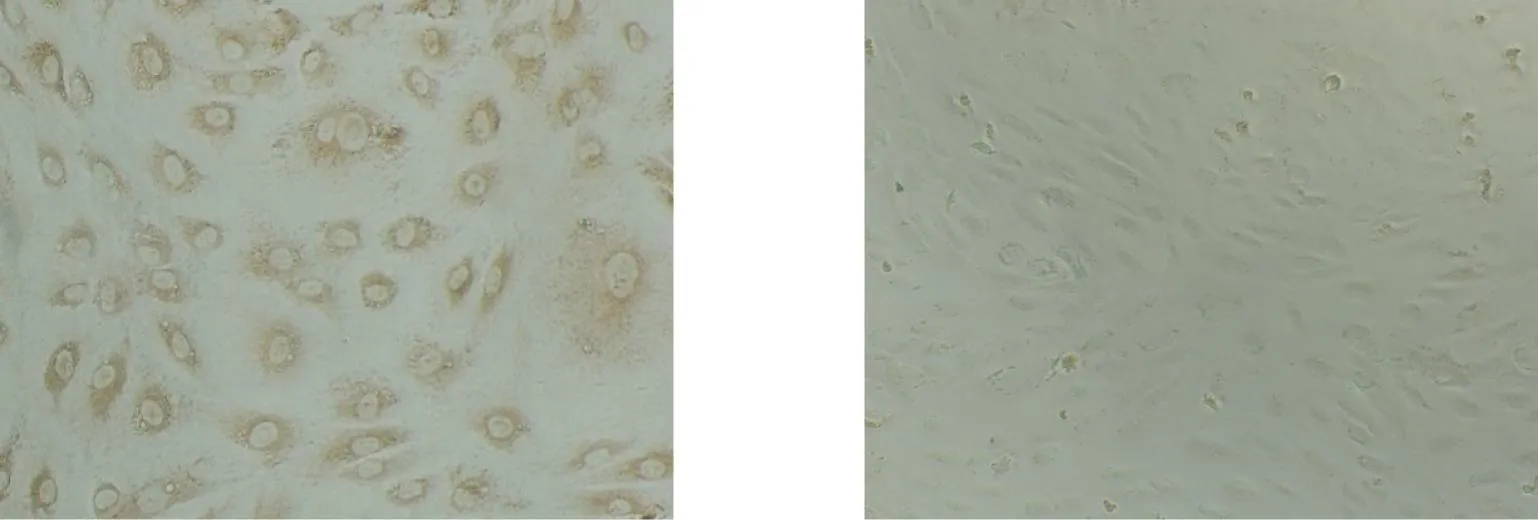
Ⅷ因子阳性(HUVEC) 阴性对照 (BHK)图2 免疫组化鉴定HUVECs(100×)Fig.2 Identification of HUVECs with immunohistochemisty
2.3流式细胞术检测 血管内皮细胞强表达于CD31是另一特征性表现。目前,国内外普遍采用CD31作为指示血管内皮细胞细胞的指标。流式细胞结果显示,HUVECs表面高表达CD31分子,红色为同型对照,绿色为检测的样本,99.37%的细胞表面抗原CD31表达阳性,表明所分离培养的HUVECs纯度高达99.37%(图3)。
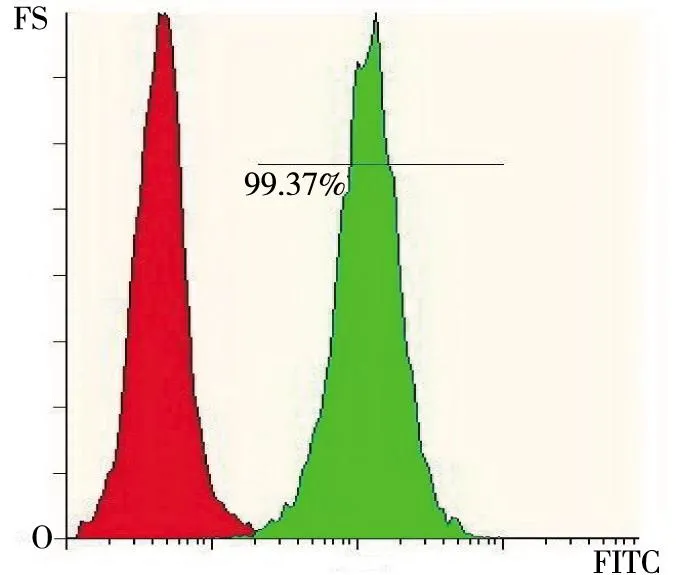
图3 HUVECs表面CD31表达Fig.3 Expression of CD31 on the surface of HUVECs
3讨论
1973年 Jaffe等[7]首次报道了内皮细胞体外培养的方法,随后大批学者对内皮细胞的培养方法进行了一系列的改进和创新[8-9]。但由于影响内皮细胞生长的因素较多,原代HUVECs的获得率较低,且传代次数有限。本研究通过总结前人的方法,改进了HUVECs提取方法,获得了较高纯度的原代HUVECs,要点如下:(1)脐带采用含葡萄糖的PBS缓冲液保存在 4 ℃进行运输,取材后3 h内完成对HUVECs处理,保护了脐静脉内皮细胞的活性,提高了脐静脉内皮细胞的获得率;(2)采用Ⅰ型胶原酶进行消化,胶原酶较温和,对内皮细胞的损伤较少,可获得数量较多的内皮细胞,对HUVECs贴壁生长无太大的影响,克服了传统方法采用胰蛋白酶消化对于内皮细胞的损伤较大的缺点;(3)采用含10%胎牛血清的M199培养液,并加入ECGS及肝素,可促进内皮细胞的生长,增殖及贴壁[10-11],使内皮细胞在1~2 d有90%融合长成单层细胞;(4)细胞传代用含EDTA的0.25%胰蛋白酶消化5 min,立即加入胰蛋白酶体积3~4倍10%胎牛血清的M199培养液终止消化,减少了细胞的损伤;(5)用明胶包被细胞培养瓶可以促进内皮细胞的贴壁性;(6)本研究在传代过程中发现原代HUVECs传至第5代后形态有所改变,贴壁性较差的现象,采用细胞传代至第5代时进行研究,即可保持细胞的活性,还可保证实验结果真实可靠。
本研究获得的原代HUVECs,镜下细胞呈长梭形,以“鹅卵石”状排列,免疫组织化学染色示细胞呈圆形、梭形或多边形, 胞浆内含有棕黄色颗粒,流式细胞术检测细胞表面抗原CD31表达阳性高达99.37%,成功分离并获得大量纯度较高的HUVECs。为HUVECs模型模型的建立提供更加简便宜、快速的方法。
参考文献4
[1] Xiao L, Liu Y, Wang N. New paradigms in inflammatory signaling in vascular endothelial cells[J]. Am J Physiol Heart Circ Physiol, 2014(306):H317-H325.
[2] Sena CM, Pereira AM, Seica R. Endothelial dysfunction-a major mediator of diabetic vascular disease[J].Biochim Biophys Acta (BBA)-Mol Basis Dis, 2013(1832):2216-2231.
[3] Sumpio BE, Riley JT, Dardik A.Cells in focus: endothelial cell[J]. International Journal of Biochemistry & Cell Biology, 2002(34):1508-1512.
[4] Deanfield JE, Halcox JP, Rabelink TJ. Endothelial function and dysfunction: testing and clinical relevance[J]. Circulation, 2007(115): 1285-1295.
[5] Cines DB, Pollak ES, Buck CA, et al. Endothelial cells in physiology and in the pathophysiology of vascular disorders[J]. Blood, 1998(91):3527-3561.
[6] Trung DT,Wills B.Systemic vascular leakage associated with dengue infections the clinical Perspective[J].Curr Top Microbiol Immunol, 2010(338):57-66.
[7] Jaffe EA. Culture of human endothelial cells derived from umbilical veins[J]. Clin Invest, 1973(52):2754.
[8] 张宝庚,陈铁镇,张晶范.人脐带静脉及大鼠主动脉内皮细胞的培养[J].中华心血管病杂志, 1985(1):52-54.
[9] Crampton SP, Davis J, Hughes CC. Isolation of human umbilical vein endothelial cells (HUVEC)[J].J Vis Exp, 2007(3):183.
[10]余继海,许戈良,傅斌生.人脐静脉内皮细胞的培养及鉴定 [J].安徽医学, 2003(24):4-6.
[11]钱勇,张励.内皮细胞生长因子和肝素对人脐静脉内皮细胞增殖的影响[J].眼科研究, 2003(21):26-28.
(2014-09-08收稿,2014-10-15修回)
Improved Isolation and Identification of Primary Vascular
Endothelial Cells from Human Umbilical Veins
CUI Lili, YU Fangfang, ZUO Li
(TeachingDivisionofImmunology,GuiyangMedicalCollege,Guiyang550004,Guizhou,China)
[Abstract]Objective: To optimize the isolation and nurturing method of the human umbilical vein endothelial cell (HUVECs), to conclude identification methods of HUVEC. Method: Improving the traditional isolation of HUVECs, isolating HUVECs by type I collagenase. Then the growth of cells was observed under an inverted microscope, the cultured cells were identified by immunocytochemistry, and the purity of cells was identified by flow cytometry. Result: Improved experimental procedures and simplified the operation, the isolation of HUVECs was not affected, the primary HUVECs began to grow into a single layer about 2~4 days in vitro, arrayed like "cobblestone"shape under the inverted microscope.Ⅷ factor in the HUVECs showed positive reaction by immunocytochemistry, the purity was 99.37% by flow cytometry. Conclusions: Collagenase procedure is convenient and high purified HUVECs can be acquired. It can successfully establish the model for endothelial cells.
[Key words]endothelium, vascular; umbilical veins; immunocytochemistry; cell culture; cell separation;flow cytometry
[中图分类号]R329.2
[文献标识码]A
[文章编号]1000-2707(2015)01-0020-04
通信作者**E-mail:zuoligymc@163.com网络出版时间:2015-01-13
[基金项目]*国家自然科学基金 (31260224)



