邹 云, 余资江, 林金棠
(贵州医科大学, 贵州 贵阳 550004)
大鼠脊髓半横断损伤后S-100B表达的变化*
邹 云, 余资江**, 林金棠
(贵州医科大学, 贵州 贵阳 550004)
目的: 研究大鼠脊髓半横断损伤(SCI)后损伤区域星形胶质源性蛋白(S-100B)的表达情况。方法: 将70只雄性成年SD大鼠随机分为正常组(10只)、假手术组(10只)及模型组(行T10脊髓右侧半切术,术后分为1 d,7 d,14 d,21 d,28 d组,每组各10只);术后于相应时间点采用BBB及Reuter法行后肢神经功能评分,评分后处死大鼠,对SCI后损伤区域行S-100B免疫组织化学染色,Western blot检测S-100B蛋白表达,透射电镜观察损伤区域的组织形态学变化。结果: (1)BBB与Reuter评分显示模型组大鼠麻醉清醒后即出现瘫痪及感觉功能障碍,术后7 d神经功能开始好转,随着时间的推移,神经功能逐渐恢复,14 d时后肢神经功能恢复最明显;(2)免疫组织化学显示正常组及假手术组少量表达S-100B,模型组S-100B表达较正常组及假手术组均增高,S-100B表达在14 d时达到高峰,大量反应性星形胶质细胞增生、肥大,28 d时S-100B表达趋于稳定;(3)Western blot检测S-100B蛋白表达水平与免疫组织化学结果相一致;(4)电镜下SCI后损伤区域神经元肿胀,变性,细胞器减少,线粒体水肿,空泡变性。结论: SCI后S-100B表达增高,星形胶质细胞增生,可能与损伤神经的自发修复过程有关。
脊髓损伤; 修复; 神经再生; 星形胶质源性蛋白; 大鼠,Sprague-Dawley
星形胶质源性蛋白(S-100B)是一种酸性的能与钙、锌结合的可溶性蛋白,属于钙结合蛋白家族[1]。S-100B除在细胞内存在外,也可被星形胶质细胞分泌,发挥重要的生理功能,亦作为中枢神经系统的特异性蛋白受到广泛重视[2]。脊髓损伤(spinal cord injury,SCI)时,损伤和坏死的细胞被动释放大量S-100B,损伤刺激星形胶质细胞活化也可产生S-100B[3-4],其浓度的变化或可间接反映神经损伤的病理生理过程。本实验主要研究S-100B与SCI时损伤恢复时间的变化规律,为治疗神经损伤提供实验依据。
1 材料与方法
1.1 主要材料
兔抗S-100B多克隆抗体、即用型SABC显色试剂盒、生物素化二抗(羊抗兔IgG)及BCA蛋白定量试剂盒购于武汉博士德生物公司,细胞裂解液(RIPA)、5×蛋白上样缓冲液购于碧云天生物技术研究所,四甲基乙二胺(TEMED,北京索莱宝生物科技有限公司),蛋白电泳仪(PowerPae Basic Power supply型) 、垂直电泳槽(Mini-PRoTEAN3型)、转移电泳槽(Mini Tans-Blot Cell型) 购于美国Bio-RAD公司,RM2016轮转切片机购于上海徕卡仪器有限公司,自备常规手术器械等。
1.2 方法
1.2.1 实验动物分组及手术方法 选择健康成年雄性SD大鼠70只,体重250~300 g,随机分为正常组(10只,常规饲养)、假手术组(10只,摘除棘突和椎板,不损伤脊髓)及模型组(行T10脊髓右侧半切术,术后分为1 d,7 d,14 d,21 d,28 d组,每组各10只)。T10脊髓右侧半切术:麻醉后常规消毒铺巾,俯卧位固定大鼠,定位T10棘突。切开T9~T11皮肤,分离两侧棘突旁肌肉,暴露T9~T11棘突和椎板,固定T10椎板,小号持针器仔细摘除T10棘突、右侧椎板至右侧关节突,充分暴露手术所需视野,而后定位中线,将尖刀片刀背对着正中沟,刀锋向右向脊髓内垂直刺入,随即在与脊髓垂直方向向右侧横行切断右半侧脊髓;仔细止血,青霉素冲洗切口,逐层缝合。假手术组只摘除棘突和椎板,正常组常规分笼饲养。
1.2.2 大鼠后肢神经功能评分 采用BBB[5]法行后肢运动功能评分,Reuter[6]法行感觉功能评分,观察SCI后后肢功能恢复情况。BBB评分是根据动物髋、膝、踝、趾、前后肢协调运动等情况评定运动功能,分22级,最高21分,最低0分。Reuter评分法是从牵张反射、疼痛回缩反射、背部感觉、肌张力及肌力等5个方面来评定SCI后的感觉变化,最低0分,表示正常,最高11分,表示瘫痪。评分采用双盲、双人独立观察记录,最后取平均值。
1.2.3 免疫组织化学检测S-100B表达 各组取3只大鼠脊髓石蜡包埋后,按照试剂盒说明书检测S-100B表达,随机选取6个200倍视野,记录SCI后不同时间点S-100B平均阳性细胞数。免疫组化步骤简述如下:3% H2O2灭活内源性过氧化物酶(室温,10 min),5%正常山羊血清封闭(37 ℃,20 min),滴加一抗(S-100B 1∶100),4 ℃过夜(PBS代替一抗做阴性对照),次日PBS浸洗3×2 min,滴加二抗(37 ℃,20 min),SABC反应(37 ℃,20 min),DAB显色、脱水、透明、封片。
1.2.4 Western blot检测S-100B表达 在相应时间点各组随机取5只大鼠,用乙醚麻醉后在冰上迅速解剖出脊髓,切取以损伤区域为中心约3 cm长度的脊髓节段,标记后投入液氮中保存。快速将液氮中的组织取出,放到研钵中研碎,加入RIPA裂解细胞,离心后分离提取蛋白行Western blot检测,使用Quantity One对所做实验图片进行灰度值的定量分析。
1.2.5 超微结构观察 在相应时间点各组随机取2只大鼠,麻醉、灌注后,快速取出损伤脊髓中心1 mm×1 mm×1 mm大小标本,放入2%戊二醛中固定24 h(4 ℃),透射电镜观察并摄片。
1.3 统计学方法

2 结果
2.1 大鼠后肢神经功能评分
模型组大鼠麻醉清醒后即出现瘫痪症状,感觉功能明显异常,术后7 d伤侧后肢神经功能开始好转,随着时间的推移,大鼠后肢功能逐渐恢复,术后14 d时恢复最明显,BBB评分达8分,Reuter评分恢复至5分以下,见表1。
2.2 S-100B阳性细胞及蛋白表达
免疫组织化学结果显示,正常脊髓切片中S-100B阳性细胞数量较少,染成棕褐色;模型组术后1 d组,S-100B阳性细胞数量开始增加,主要在星形胶质细胞中表达;7 d组脊髓损伤标本中 S-100B阳性细胞胞体增大,突起增多,染色加深, 14 d组脊髓损伤标本中这种表现更加明显,21~28 d组,S-100B阳性细胞与14 d比较未见明显变化,见图1。平均阳性细胞数量见表2。脊髓损伤后S-100B蛋白的相对表达量较正常组及假手术组皆升高,术后14 d组升高最明显,术后21~28 d组S-100B表达趋于稳定,见图2及表2。


组别BBBReuter正常组21.0±0.00 0±0.00假手术组19.0±0.81 0.5±0.54术后1d组 0.0±0.00(1)(2) 10.9±0.54(1)(2) 7d组 3.4±0.51(1)(2) 6.7±0.55(1)(2) 14d组7.8±0.54(1) 4.8±0.21(1)(2) 21d组10.2±0.84(1) 3.7±0.47(1) 28d组12.6±0.55(1) 3.3±0.40(1)
(1)与正常组比较,P<0.05;(2)与术后28 d组比较,P<0.05
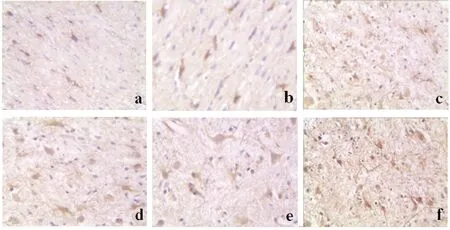
注:a为正常组,b为术后1 d组,c为术后7 d组,d为术后14 d组,e为术后21 d组,f为术后28 d组
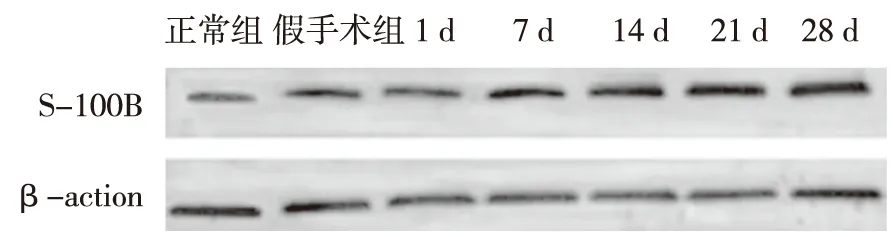
图2 各组大鼠S-100 蛋白表达
2.3 透射电镜观察
电镜下,正常脊髓切片中神经元胞膜完整,细胞器丰富,线粒体结构正常,核内染色质分布均匀,核仁清晰;模型组术后1 d组,神经元肿胀,细胞器减少,线粒体水肿,胞核固缩,核膜内褶,染色质分布不均;7 d组神经元、线粒体肿胀,核膜内褶明显,核仁移向核膜;14 d组神经元内细胞器丢失,线粒体肿胀明显,嵴间隙增宽;21~28 d组脊髓神经元线粒体肿胀,空泡变性。见图3。


组别检测指标S-100B阳性细胞计数 S-100B蛋白相对表达量正常组5.6±0.550.45±0.013假手术组5.4±0.540.45±0.015术后1d9.0±0.71(2)0.59±0.013(2) 7d14.2±0.84(1)(2)0.77±0.018(1)(2) 14d23.2±0.84(1)1.25±0.036(1) 21d22.2±0.83(1)1.15±0.037(1) 28d22.0±0.70(1)1.06±0.028(1)
(1)与正常组比较,P<0.05;(2)与术后14 d比较,P<0.05
3 讨论
脊髓是中枢神经系统的重要组成部分,其活动受大脑的控制,具有重要的传导功能,除了头面部以外,来自躯干和四肢的浅、深部感觉以及大部分内脏感觉,都是通过脊髓白质的感觉纤维束传达到脑,进行高级综合分析;大脑对躯干和四肢的骨骼肌运动以及内脏(部分)的管理,通过脊髓白质的运动纤维束来完成。脊髓本身亦可完成许多反射活动,同时也是调节血管舒缩、排尿、排便和性功能活动的低级反射中枢。一旦脊髓受损,必定会给受伤者带来沉痛的打击。可见,深入了解脊髓损伤后发生的变化具有重要的意义。

注:a为正常组,b为术后1 d组,c为术后7 d组,d为术后14 d组,e为术后21 d组,f为术后28 d组;箭头所指为线粒体
1965年Moore等[7]首先在牛脑组织中发现星形胶质源性蛋白(S-100),因其能溶解在100%的硫酸铵饱和溶液中而得名。S-100蛋白家族大约有16个成员,其中S-100A和S-100B是其主要成员。S-100B具有高度脑特异和神经保护作用,可以提高神经元的存活率、促进胶质细胞产生神经突起、促进轴突的延伸,它在星形胶质细胞中表达最多[8-9]。S-100B有多种生理功能:(1)调节多种蛋白激酶的底物磷酸化,调节腺苷酸环化酶的活性;(2)调节细胞内外钙离子浓度,保护神经元免受氧化损伤;(3)调节细胞的增殖、分化,参与微管、微丝的解聚;(4)被分泌到细胞外,低浓度具有神经营养和保护作用,促进轴突生长,但高浓度可引起神经元变性和诱导胶质细胞凋亡[10-11]。另外它还可以作为白细胞的化学趋化因子,调节巨噬细胞的吞噬活性。因此S-100B对于神经系统的生长发育具有重要影响,并在CNS受损时,通过急性胶质细胞反应增加S-100B合成和分泌参与神经损伤修复机制。
本实验结果示,SCI后,伤侧后肢运动、感觉功能逐渐恢复,14 d时恢复最明显;S-100B也在SCI后开始增加,14 d时达到峰值,随后进入平台期。脊髓损伤机制包括即刻机械损伤和随之发生的血管、生化反应所致的继发性损害。有研究将脊髓损伤分为3期,(1)急性期:即伤后至最初几天内,为脊髓及周围组织包括血管内皮受到初始机械损伤,坏死及细胞死亡瞬间发生;受伤几分钟后,神经细胞会发生电解质紊乱,导致神经功能衰竭和脊髓休克,并持续约24 h。SCI早期,大量损伤及坏死的细胞被动释放S-100B,在一定范围内, 表达上调的S-100B可以刺激神经元生长、增强神经元在损伤后的存活;(2)继发反应期:伤后数周内,机械损伤致细胞溶解,突触或非突触间的运输,使得细胞外谷氨酸盐及其他刺激性氨基酸浓度急剧升高,脂质过氧化和氧自由基产生,多种原因导致反应性神经胶质细胞过多以及星形胶质细胞增殖;星形胶质细胞增生、活化大量分泌S-100B,高浓度的S-100B对邻近的易感神经元产生神经毒性作用,从而影响神经损伤的修复[12-13];(3)慢性期:发生在受伤后数天至数年,主要机制有细胞程序性死亡范围扩大,一些受体及离子通道浓度和活性改变,瘢痕出现,脱髓鞘导致传导功能受损,囊性变,脊髓空洞区域扩大。Carlson等[14]总结了继发性脊髓损伤不同机制,包括缺血、生化改变、程序性细胞死亡、毒性刺激物、神经递质的积聚、脂质过氧化和自由基的产生及炎症反应等,认为神经功能最终缺陷是由于继发性损伤复合机制所致。
本实验通过建立大鼠SCI模型,初步探讨了早期及继发反应期S-100B的表达与损伤恢复时间变化规律。随着实验研究不断进展,对脊髓损伤病理生理全面认识及早期治疗将会大大减少了脊髓损伤致死率、住院率及并发症几率,提高患者早期康复及重返社会工作的机会。
[1] Geyer C,Ulrich A.Diagnostic value of S100B and neuron-specific enolase in mild pediatric traumatic brain injury [J].J Neurosurg Pediatr, 2009(4):339-344.
[2] Brde YA,Edgar D,Thoenen H.Purification of a new neurolrophie factor from mammalian brain[J].EMBOJ, 1982(5):549-553.
[3] Hu J,Ferreira A,Van Eldik LJ,et al.S-100 beta induces neuronal cell death through nitric oxide release from astrocytes[J].J Neurolchem, 1997(6):2294-2301.
[4] Mcadory BS,Van Eldik LJ,Norden JJ,et al.S-100B,a neurotrophic protein that modulates neuromal protein phosphorylation,is up regulated during lesion-induces collaterall sprouting and reactive synaptogenesis[J]. Brain Res, 1998(2):211-217.
[5] Basso DM,Beattie MS,Bresnahan JC.A sensitive and reliable locomotor rating scale for open field testing in rats[J]. Neurotrauma, 1995(1):1-21.
[6] Reuter DG,Tacker WA J,Badylak SF,et al.Correlation of motor-evoked potential response to ischemic spinal cord damage[J].Thorac Cardiovasc Surg, 1992(2):262-272.
[7] Moore BW.A sluble protein characteristic of the nervous system[J].Biochem Biophys Res, 1965(6):739-744.
[8] Scarcello E,Morrone F,Piro P,et al.Protein S-100B as biochemical marker of brain ischemic damage after treatment of carotid stenosis[J].Ann Vasc Surg, 2011(7):975-978.
[9] Pingerelli PL,Ozols VV,Saleem H,et al.The calcium-modulated structures of calmodulin and S100b proteins are useful to monitor hydrogen/deuterium exchange efficiency using matrix—assisted laser desorption ionization time of-flight mass spectrometry[J].Eur J Mass Spectrom(Chichester,Eng), 2009(6):739-746.
[10]王尧,杜子威.神经生物化学与分子生物学[M].北京:人民卫生出版社, 1997:32-49.
[11]李勇,黄瀛,范明,等.大鼠坐骨神经钳伤后变性和再生过程中S-100蛋白的变化[J].解剖学志, 1996(4):303-306.
[12]Profyris C,Cheema SS, Zang D, et al. Degenerative and regenerative mechanism sgvenring spinal cord injury[J].NeuorbiolDis, 2004(3):415-436.
[13]Schwab ME,Brosamle C. Regeneration of lesionedcortico spinal tract-fibersin the adult rat Spinal cord under experimental conditions[J].Spinal Cord, 1997(7):469-473.
[14]Carlson GD,Gorden C.Current developments in spinal cord injury research[J].Spine J, 2002(2):116-128.
(2015-06-07收稿,2015-07-04修回)
中文编辑: 周 凌; 英文编辑: 刘 华
Changes in S-100B Expression of Astrocytes after Experimental Hemi-sectioned Spinal Cord Injury of Rats
ZOU Yun, YU Zijiang, LIN Jintang
(GuizhouMedicalUniversity,Guiyang550004,Guizhou,China)
Objective: To investigate the expression of S-100B protein of astrocytes after spinal cord injury (SCI).Methods: Seventy healthy adult male SD rats were selected and randomly divided into 3 groups: normal control group, sham group and model of SCI group (1 d, 7 d, 14 d, 21 d and 28 d after SCI). After the establishment of animal model of SCI, the functional recovery of the hind limb was evaluated by using BBB(Basso, Beattie and Bresnahan locomotor rating scale)and Reuter score at 1 d, 7 d, 14 d, 21 d and 28 d. After hind limb function was scored, the rats were sacrificed to undergo S-100B immunohistochemistry staining. Western blot was adopted to detect the expression of S-100B protein in damaged area and transmission electron microscope to observe the morphological change of spinal cord after SCI in rats Results: (1)In BBB and Reuter score evaluation, the rats of SCI model groups paralyzed and showed sensory disturbance after anesthetic awareness. The neurologic function of the SCI rats' hind limb began to recover gradually, with the recovery being most obvious at 14thd. (2)HE staining showed that S-100B protein expression in each experimental groups were higher than that of normal control and sham group, with S-100B protein expression reaching the highest level at 14thd. The astrocyte in the SCI area proliferated and hypertrophied. At 28thd S-100B protein expression tended to be stable. (3)The detection of S-100B protein expression by Western blot was consistent with result of immunohistochemistry staining. (4)Under transmission electron microscope, in injured area after SCI, the neurons swelling and degeneration, the decreased number of cell organelle, mitochondrial edema and vacuolar degeneration could be observed. Conclusion: After SCI, the increased S-100B protein expression and astrocyte proliferation may be related to self-repair and regeneration of injured nerve.
spinal cord injury; restoration; nerve regeneration; astrocyte derived protein; rats, Sprague-Dawley
国家自然科学基金项目(81060108)
时间:2015-08-07
http://www.cnki.net/kcms/detail/52.5012.R.20150807.2246.020.html
R322.81
A
1000-2707(2015)09-0900-05
**通信作者 E-mail:893767473@qq.com



