杭 航, 伍国锋*, 王丽琨, 周海燕
(贵州医科大学 急诊医学教研室, 贵州 贵阳 550004)
乳鼠脑小胶质细胞原代培养与鉴定*
杭航**, 伍国锋***, 王丽琨, 周海燕
(贵州医科大学 急诊医学教研室, 贵州 贵阳550004)
[摘要]目的: 探索乳鼠小胶质细胞的原代培养和鉴定方法。方法: 取新生SD乳鼠脑组织捣碎、消化及共培养,用振摇法分离纯化小胶质细胞并继续培养;在相差显微镜下观察共培养第3、9及14天时细胞形态,计数纯化培养后小胶质细胞数及存活率,采用免疫细胞化学染色方法在共聚焦显微镜下计数纯化培养后小胶质细胞特异性OX-42抗体表达阳性的细胞数及存活率,同时观察小胶质细胞活化形态;观察纯化培养12、24、48及72 h后小胶质细胞的静止型细胞数和静止率。结果: 振摇法共培养第14天时可见胞体折光不均的星形胶质细胞最多,分离时可获得1.2×10(6 )个/瓶(75 cm2,250 mL)小胶质细胞,免疫细胞化学染色显示小胶质细胞特异性OX-42表达阳性细胞达95%,存活率>95%;在显微镜下小胶质细胞形态以阿米巴样、长梭形及马鞍形为主;纯化培养72 h后小胶质细胞的静止型细胞数和静止率最高。结论: 振摇法分离小胶质细胞纯化培养72 h,可获得最高的静止型小胶质细胞数和静止率。
[关键词]大鼠,Sprague-Dawley; 小胶质细胞; 培养; 振摇法; 纯化; 鉴定
小胶质细胞是中枢神经系统主要的3种胶质细胞之一,其数量约占总胶质细胞总数的10%,是中枢神经系统的免疫细胞,具有与外周巨噬细胞最相似的结构和功能[1-2]。小胶质细胞可通过释放促炎或抗炎介质对机体感染或损伤作出快速反应,影响疾病的发生发展[3]。因此建立一种在体外培养并能进行鉴定的脑小胶质细胞培养的方法尤为重要[4],本研究用振摇法分离纯化小胶质细胞并鉴定,探索乳鼠小胶质细胞的原代培养和鉴定方法,报告如下。
1材料与方法
1.1实验动物、仪器与试剂
新生1~2 d的SD乳鼠(由贵州医科大学动物实验中心提供),体质量5~8 g。北美胎牛血清(FBS) ,DMEM/F12培养基,胰酶(含EDTA,0.25%),Hanks液,PBS液,青霉素-链霉素溶液,GlutaMax;多聚L-赖氨酸,脱氧核糖核酸酶Ⅰ(DnaseⅠ),小鼠单克隆抗体CD11b/c(OX-42)。4%多聚甲醛溶液,山羊抗兔二抗异硫氰酸荧光素(FITC),封闭山羊血清,抗荧光衰减封片剂及细胞核染料(DAPI)。
1.2方法
1.2.1混合胶质细胞共培养将1~2 d的新生SD乳鼠用CO2吸入法处死后,无菌条件下取出脑组织,放入Hanks液中浸泡,仅保留双侧大脑半球,仔细将脑膜和血管剥离,再放入DMEM/F12 培养基中剪碎,转移至15 mL离心管中,加入等量0.25%的胰酶消化液,37 ℃消化4 min,按1∶1比例加入含10%胎牛血清、1%双抗、1% DMEM /F12高糖完全培养基终止消化,加入适量的DnaseⅠ(30 000 U/L),37 ℃消化2 min, 200目过滤,收集滤液,1 500 r/min 离心5 min,弃上清液,用完全培养基进行细胞沉淀悬浮后进行细胞计数,以2×106个接种至用0.001%多聚L-赖氨酸包被的75 cm2培养瓶培养,24 h后全量换液;之后观察细胞生长,约3 d进行一次半量换液,培养至第7~9天时可见胶质细胞分层,下层细胞连成片主要是神经元、星形胶质细胞,细胞铺展均匀,上层细胞为圆形或椭圆形,透光性好,主要是小胶质细胞、少突胶质细胞,收集上层细胞。
1.2.2分离及纯化小胶质细胞待原代细胞培养第7~9天,细胞充分分层生长后,再继续培养至第14天时,吸除约10 mL培养液,将培养瓶口封口后放在37 ℃恒温摇床上200 r/min振荡2 h,收集培养液直接接种至涂布0.001%多聚L-赖氨酸的培养板中,培养箱放置约1 h,镜下可见大部分细胞贴壁,此时半量换液1次,加入含10 %胎牛血清的DMEM/F12培养液继续培养。分离后的混合细胞继续培养3 d ,第2次收取小胶质细胞。
1.2.3免疫细胞化学染色取分离培养24 h的细胞爬片经PBS液充分洗涤后,用4%的多聚甲醛固定15 min,用0.25% Triton处理20 min,10%正常山羊血清封闭,PBS洗3次(3 min/次);分别加入一抗小胶质细胞特异性标志物0X-42抗体[5],浓度为1∶50、1∶100及1∶250,37 ℃孵育2 h,PBS洗3次(3 min/次);加入二抗山羊抗小鼠FITC ,37 ℃避光孵育1 h,PBS洗3次(3 min/次);DAPI染核5 min,最后加入抗荧光淬灭封片剂封片。用激光共聚焦显微镜观察、摄片。用PBS及正常牛血清代替一抗作为对照染色。FITC是一种绿色荧光染料,若0X-42表达会呈绿色;DAPI则是一种蓝色染核染料,专染细胞核,如为蓝色说明所染细胞是活细胞或是有核细胞;活细胞阳性率则用Merge进行判断,为FITC和DAPI二者染色的融合图片。
1.3统计学分析

2结果
2.1混合共培养时神经胶质细胞形态
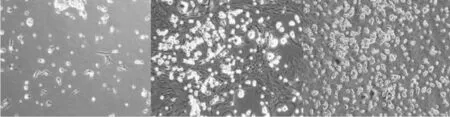
第3天 第9天 第14天图1 混合共培养的小胶质细胞(200×)Fig.1 The growth of cultured microglia cells in different time points under the phase contrast microscope
混合共培养第3天时,相差显微镜下观察可见细胞逐渐生长,比较稀疏;培养至第9天时间细胞开始分层,底部的细胞为星形胶质细胞及少突细胞,而上面圆形透光性好的为小胶质细胞;第14天时,上层小胶质细胞数量增多,细胞分层明显,底层细胞充分铺展,紧密接触,其上层主要为散在分布的阿米巴样细胞,胞体圆形,透光性较底层细胞好,相差显微镜下可见胞体折光不均,为星形胶质细胞(图1)。 2.2纯化小胶质细胞存活率
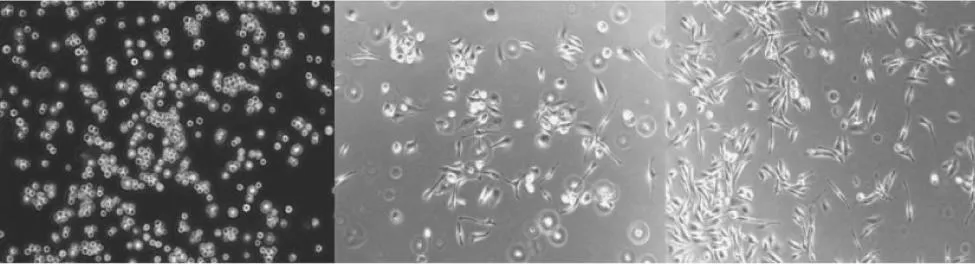
第1天 第2天 第3天图2 纯化培养的小胶质细胞(200×)Fig.2 Microglia cells in culture and purification
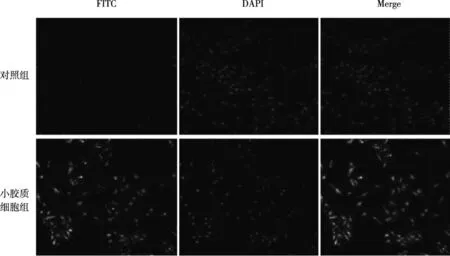
图3 免疫组织化学染色鉴定小胶质细胞(200×)Fig.3 The expression of OX42 detected by immunohistochemistry for identification of microglias
将培养瓶置于37 ℃恒温摇床上以200 r/min振摇 2 h后,可见位于上层的小胶质细胞开始悬浮,计数小胶质细胞产量为1.5 ×106个,存活率>95%。经纯化分离后的小胶质细胞多在1 h左右贴壁,多为圆形,边缘不规则;培养至第2天时部分细胞胞体回缩,少量细胞伸出突起,多为单极,也有呈双极,部分细胞伸展为梭形、马鞍形及不规则形,但部分细胞仍为圆形;培养至第3天时,见约半数细胞由活化态转为静止状态,即胞体狭长, 可见不对称分支,形态伸展为梭形、马鞍形或不规则形(图2)。0X-42染色显示细胞形态呈长梭形、不规则形等形状,细胞质染色均匀,呈草绿色;DAPI染色显示细胞核被染成蓝色,Merge后重叠率达95%以上,证明分离纯化的细胞为小胶质细胞;一抗对照组DAPI染色虽可见细胞核也被染成蓝色,但FITC无细胞着色,Merge重叠后未见细胞着色(图3)。
2.3小胶质细胞增殖
纯化培养各时间点的细胞总数比较,差异无统计学意义(P>0.05),而各时间点静止细胞数和静止率比较,差异有统计学意义(P<0.01), 24、48及72 h静止细胞数和静止率高于12 h(P<0.01),72 h最高,见表1。
表1 纯化培养不同时间点小胶质细胞
(1)与12 h组比较,P<0.01;(2)与24 h组比较,P<0.01;(3)与48 h组比较,P<0.01
3讨论
小胶质细胞属于单核吞噬细胞系统,生理情况下,静息的小胶质细胞可以通过迁移及吞饮的功能从而清除自身坏死组织及废物,而活化的小胶质细胞则可以通过分泌多种细胞因子从而促进细胞生长及自我修复[6];病理状态下,特别是中枢神经系统受损时,小胶质细胞在各种病原物质的刺激下持续激活,不仅分泌多种炎性因子,还会产生大量一氧化氮、超氧阴离子、谷氨酸和其他神经毒素,从而造成大脑的进一步损伤[7]。越来越多的证据表明,脑出血后血肿中的血红细胞裂解后,可释放大量的凝血酶等细胞毒性物质,这些细胞毒性物质可直接产生氧自由基或通过激活小胶质细胞和(或)巨噬细胞产生氧自由基,而氧自由基可诱发氧化应激反应,造成继发性脑损伤[8-9]。因而,建立一种稳定而优化的培养及分离小胶质细胞的方法,有助于小胶质细胞和(或)巨噬细胞的吞噬功能及降低氧化应激反应的相关研究,对脑缺血、创伤等疾病的防治提供了重要的实验基础。
常规的小胶质细胞纯化培养主要来源于McCarthy 建立的星形胶质细胞及少突胶质细胞纯化培养的方法,之后国内外也有人改良为手动振摇法及消化法[10-12]。在前人的操作步骤中,笔者所在课题组在前期混合胶质细胞培养时选择高密度胶质细胞种植于细胞培养瓶中,细胞约在第7~9天可出现分层现象,并且将振摇条件设定为200 r/min,2 h振摇细胞,振摇后不进行离心分离细胞,直接将悬液种植于培养瓶或培养板中,待1 h贴壁完全后进行换液,这样的操作可以收获质量好,数量多的小胶质细胞。本次研究则发现,在提取细胞的操作中,应尽量避免离心的过程,这样能最大限度的减少细胞损伤,使得细胞很快从激活状态转换至静息状态,得到优质的小胶质细胞;本研究中选择小胶质细胞的特异性抗体0X-42[5]鉴定纯化后培养的小胶质细胞阳性细胞率达95 %以上。小胶质细胞分为静止型和激活型,本实验的另一目的为在体外建立一个稳定的静止型细胞模型,未后续研究提供正常生理条件下的细胞模型。结果发现分离后的小胶质细胞在24、48及72 h的静止细胞率显着高于分离后12 h组,且以分离后72 h的静止细胞数最多。为体外研究静息状态的小胶质细胞提供可靠的细胞实验模型。
4参考文献
[1] Ransohoff RM, Perry VH. Microglial physiology: unique stimuli, specialized responses [J]. Annual Review of Immunology, 2008(27):119-145.
[2] Banati RB. Neuropathological imaging: in vivo detection of glial activation as a measure of disease and adaptive change in the brain[J]. British Medical Bulletin, 2003(486):121-131.
[3] Kraft AD, Jean HG. Features of Microglia and Neuroinflammation Relevant to Environmental Exposure and Neurotoxicity[J]. International Journal of Environmental Research & Public Health, 2011(7):2980-3018.
[4] Sierra A, Encinas JM, Deudero JJ , et al. Microglia Shape Adult Hippocampal Neurogenesis through Apoptosis-Coupled Phagocytosis[J]. Cell Stem Cell, 2010(4):483-495.
[5] Hui WZ, Jing Z, Yue X. Synaptic and cognitive improvements by inhibition of 2-AG metabolism are through upregulation of microRNA-188-3p in a mouse model of Alzheimer's disease[J]. Chinese Medical Journal, 2014(45):14919-14933.
[6] Guo X, Gao G, Wang X, et al. Effect of bilateral deep brain stimulation of the subthalamic nucleus on olfactory function in patients with Parkinson's disease[J]. Chinese Journal of Neurosurgical Disease Research, 2008(86):237-244.
[7] Lv M, Liu Y, Zhang J, et al. Roles of inflammation response in microglia cell through Toll-like receptors 2/interleukin-23/interleukin-17 pathway in cerebral ischemia/reperfusion injury[J]. Neuroscience, 2011(1):162-172.
[8] Mracsko E. Neuroinflammation after intracerebral hemorrhage[J]. Frontiers in Cellular Neuroscience, 2014(8):388-388.
[9] Ning H, Ding SJ, Tao WU. Correlation of free radical level and apoptosis after intracerebral hemorrhage in rats[J]. Neuroscience Bulletin, 2008(6):351-358.
[10]Tanaka J , Maeda N . Microglial Ramification Requires Nondiffusible Factors Derived from Astrocytes[J]. Experimental Neurology, 1996(2):367-375.
[11]Ni M, Aschner M. Neonatal rat primary microglia: isolation, culturing, and selected applications[J]. Current Protocols in Toxicology, 2010(12):1-16.
[12]李锐, 郭民侠, 李晓青,等. 不同分离纯化法原代培养小胶质细胞的生物学差异[J]. 细胞与分子免疫学杂志, 2009(4):366-368.
(2015-12-08收稿,2016-02-21修回)
中文编辑: 吴昌学; 英文编辑: 刘华
Primary Culture and Identification of Microglias from Neonatal Rat Brain
HANG Hang, WU Guofeng, WANG Likun, ZHOU Haiyan
(DepartmentofEmergencyMedicine,GuizhouMedicalUniversity,Guiyang550004,Guizhou,China)
[Abstract]Objective: To explore the method of primary culture and identification of microglia cells from the neonatal rats. Methods: The brain tissues from the neonatal SD rats were stamped, digested and co-cultured. The microglia cells were isolated and purified by shaking method and continued to be cultured. The cellular morphology was observed under phase contrast microscope at day three, day nine and day fourteen after co-culture, and the number of microglia cells was counted and survive rate was detected after purification and culture. Immunocytochemical staining method was adopted to count cell number of positive expression of specific OX-42 antibody of microglia cells and survive rate after purification and culture under confocal microscopy. The morphology was observed by the inverted phase contrast microscope, and the resting cell number and resting rate 12, 24, 48 and 72 hours after purification and culture were counted. Results: It was observed that there were abundant astrocytes of uneven refraction 14 days after shaking method and co-culture. Immunocytochemical stain showed that the method steadily produced 1.2×106 cells per flask (75 cm2,250 mL) with high survival rate (>95%) and the high positive rate (>95%)of expression of OX-42. Under the microscope, the morphology of microglia cells was mainly ameboid morphous, long spindle shape and saddle. The number of resting cells and the rate of resting cells were the highest 72 hours after purification and culture. Conclusion: The microglia cells were isolated and purified by shaking method and continued to be cultured for 72 hours and the highest resting cells number and resting rate can be obtained.
[Key words]rats,Sprague-Dawley; microglia cells; culture; shaking method; purification; identify
[中图分类号]R459.7
[文献标识码]A
[文章编号]1000-2707(2016)03-0272-04
*[基金项目]国家自然科学基金资助项目(No. 81460185/H09106); 贵州省科技基金(2013-2043)
**贵州医科大学2013级硕士研究生
***通信作者 E-mail:wuguofeng3013@sina.com
网络出版时间:2016-03-17网络出版地址:http://www.cnki.net/kcms/detail/52.5012.R.20160317.1102.054.html



