刘丽荣, 文春蓉, 梁 璐, 刘咏梅, 朱丽英
(1.贵州医科大学 医学检验学院 临床血液学教研室, 贵州 贵阳 550004; 2.贵阳市妇幼保健院 检验科, 贵州 贵阳 550003)
血清循环DNA定量检测在卵巢癌诊断中的应用价值*
刘丽荣1, 文春蓉2, 梁璐2, 刘咏梅1, 朱丽英1
(1.贵州医科大学 医学检验学院 临床血液学教研室, 贵州 贵阳550004; 2.贵阳市妇幼保健院 检验科, 贵州 贵阳550003)
[摘要]目的: 探讨血清循环DNA(cDNA)定量检测在卵巢癌患者诊断中的应用价值。方法: 以252例经病理证实的上皮性卵巢癌患者为卵巢癌组,100例卵巢良性肿瘤患者作为良性对照组,健康体检者100例作为健康对照,以微量基因组抽提试剂盒抽提3组患者血清DNA,用实时荧光定量Real-time PCR测定其含量。结果: 良性对照组和健康对照组相比,血清cDNA比值差异无统计学意义(P>0.05);与良性对照组和健康对照组相比,卵巢癌组血清cDNA Ct值减少,差异有统计学意义(P<0.05);上皮性卵巢癌Ⅰ、Ⅱ、Ⅲ期血清cDNA Ct值差异无统计学意义(P>0.05),但Ⅳ期与Ⅰ期比较,差异有统计学意义(P<0.05)。结论: 定量检测上皮性卵巢癌患者血清cDNA,有望成为临床辅助诊断卵巢癌的新手段。
[关键词]血清学; DNA; 卵巢肿瘤; 诊断技术与方法
卵巢癌是严重威胁女性健康的恶性肿瘤之一,发病率占妇科恶性肿瘤的第3位,死亡率占各类妇科恶性肿瘤之首,对妇女生命造成了严重威胁。卵巢癌的确诊常处于晚期,且大多数初诊患者已伴盆、腹腔转移。目前,卵巢癌的筛查诊断、疗效观察及预后判断等,仍主要依靠腹腔镜检查、组织病理学检查、血清肿瘤标记物(如CA125、癌胚抗原等)的检测及影像学检查,前两者对卵巢癌的敏感性高,但是具有创伤性,影像学检查虽无创伤性,但却容易造成漏诊。循环DNA(circulating DNA,cDNA)是一种存在于动植物和人体液中的无细胞状态的胞外DNA,由细胞受外源性刺激后主动分泌,细胞损伤或死亡后释放产生[1]。研究表明,外周血cDNA一部分以游离形式存在于血清中,另一部分通过与蛋白质结合成复合体的形式附着在血细胞表面[2]。正常人血液中也存在微量cDNA,某些病理状态下,cDNA会有不同程度的增高,尤其肿瘤患者血液cDNA浓度明显高于正常人[3]。目前临床上关于抽取卵巢癌患者的血清检测cDNA含量的报道甚少。因此血清cDNA检测用于卵巢癌的早期诊断具有明显的优势和极大的潜力。故本研究通过定量检测卵巢癌患者血清cDNA水平,以探索检测血清cDNA水平可否成为用于辅助卵巢癌早期诊断的新方法。
1材料与方法
1.1标本来源
收集2013年7月~2015年2月经临床病理检查确诊为上皮性卵巢癌患者302例,其中Ⅰ期肿瘤57人,Ⅱ期73人,Ⅲ期94人,Ⅳ期26人;卵巢良性肿瘤患者和健康成年女性各100例血清标本,分别于-80 ℃保存。
1.2方法
1.2.1血清cDNA的提取取600 μL血清标本,用微量基因组DNA抽提试剂盒 (北京天根生物有限公司),按操作说明书抽提血清DNA,用ELX800酶标仪(Bio-tec,美国)测定各样品吸光度值(A 260 /A 280),计算DNA含量和纯度。
1.2.2血清DNA Ct值的测定PCR引物参照文献[4]设计,以看家基因GAPDH为目的基因,引物序列为5′-ATGGTGGTGAAGA-CGCCAGT-3′,5′-GCACCGT-CAAGGCTGAGAAC-3′扩增长度为142 bp,由上海生工生物工程公司公司合成。反应体系含定量PCR Master Mix 10 μL,上下游引物各0.5 μL,Taq DNA聚合酶(2.5 U/μL) 0.5 μL,DNA模板2 μL,加水补足至25 μL。反应采用两步法,条件为:95 ℃ 2 min,95 ℃ 30 s,55 ℃ 1 min,35个循环。用Bio-Rad CFX 96TM荧光定量PCR分析系统进行定量检测,并作熔解曲线分析,根据各自设定的临界值的循环数(Ct)值,对cDNA的原始拷贝数进行定量,每个血清 DNA样品重复测定3次取均值。
1.3统计学处理
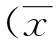
2结果
2.1GAPDH基因熔解曲线
熔解曲线显示GAPDH的扩增反应具有良好的特异性(图1),证明实时荧光定量Real-time PCR测定检测具有高度准确度和可靠性。
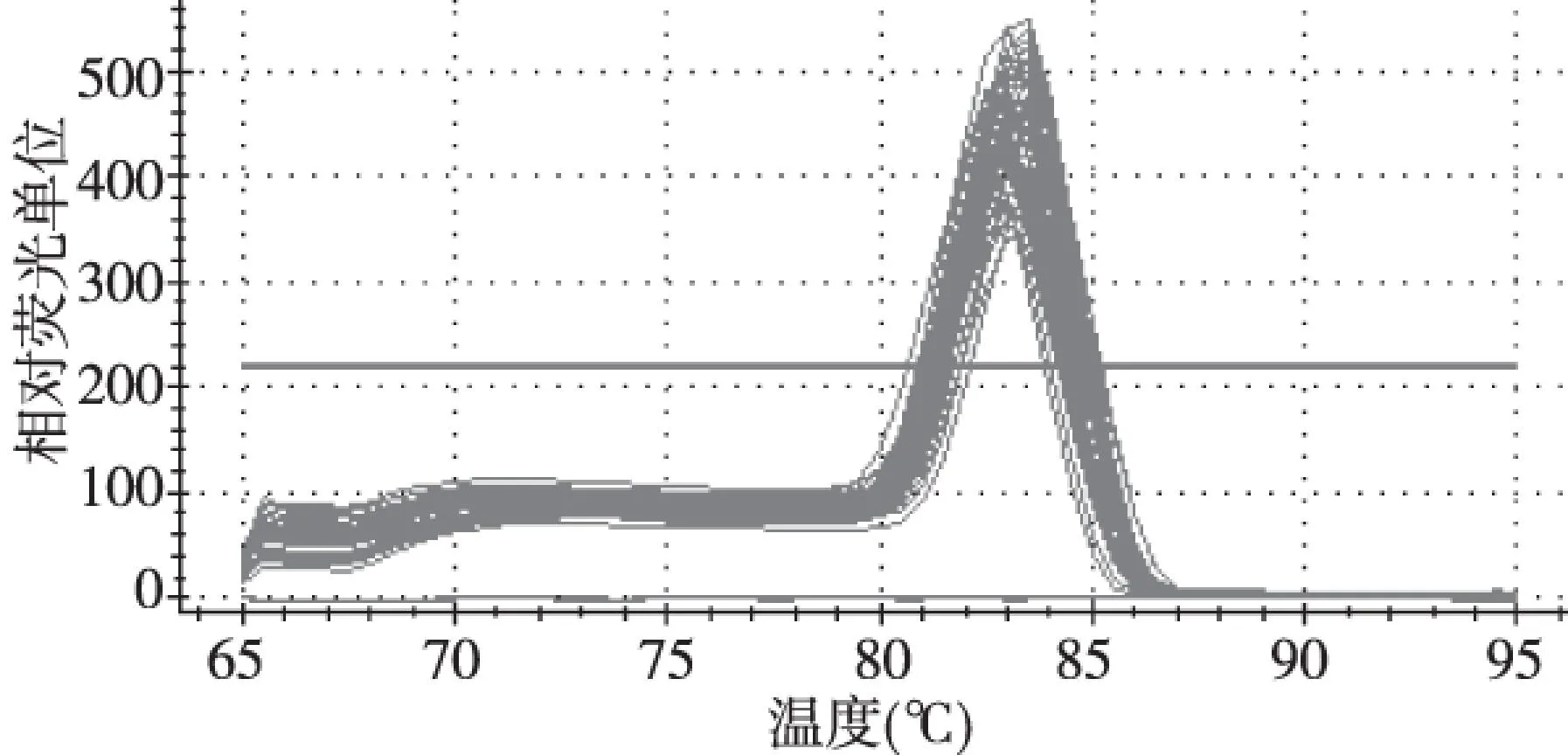
图1 GAPDH基因熔解曲线Fig.1 Melt Curve of gene GAPDH
2.2血清cDNA的Ct值
良性对照组cDNA与健康对照组比较,差异有统计学意义(P<0.05);卵巢癌患者各组与健康对照组、正常对照组比较,差异有统计学意义(P<0.05);cDNA含量水平随卵巢癌临床分期增加呈增高的趋势,上皮性卵巢癌Ⅰ、Ⅱ、Ⅲ期各组之间差异无统计学意义(P>0.05),上皮性卵巢癌Ⅳ期组与Ⅰ期组比较, cDNA含量差异有统计学意义(P<0.05)。见表1。
3讨论
卵巢癌患者的治疗疗效以及延长生存期的主要关键因素取决于早期诊断,因此当今急需建立新的早期检测手段。近年来随着肿瘤分子生物学的飞猛发展,人们已初步发现肿瘤患者血清DNA浓度显着高于正常人群,并提示体液(包括血清、血浆及腹水)DNA中高频率遗传学标志变异的检测对于监控疾病具有一定的临床意义[5-8]。卵巢癌是女性生殖器官常见的肿瘤之一,发病率仅次于宫颈癌和宫体癌而列居第3位,约占女性全身恶性肿瘤的4%。但因卵巢癌致死者,却占各类妇科肿瘤的首位,对妇女生命造成严重威胁,对卵巢癌的早期诊断十分重要。卵巢癌的临床分期根据1987年国际妇产科联盟(FIGO)国际分期法可分为如下4期:Ⅰ期,肿瘤局限于卵巢;Ⅱ期,病变累及一侧或双侧卵巢,伴盆腔转移;Ⅲ期,肿瘤侵及一侧或双侧卵巢,伴盆腔以外腹膜种植或腹膜后或腹股沟淋巴结转移;肝脏表面转移;Ⅳ期,肿瘤侵及一侧或双侧卵巢并有远处转移,胸水存在时需找到恶性细胞,肝转移累及肝实质。
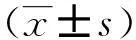
表1 各组血清cDNA的Ct值
(1)与健康对照组比较,P<0.05;(2)与良性对照组比较,P<0.05;(3)与上皮性卵巢癌Ⅰ期组比较,P<0.05
cDNA是一种存在于外周血,滑膜液和脑脊液中无细胞状态的DNA,主要是由单链或双链DNA混合组成,以DNA蛋白质复合物或游离DNA两种形式存在。cDNA的研究分为定性和定量两种,定性主要检测血清或血浆中肿瘤特异性基因改变,定量检测则以血cDNA总量为指标,两者均可以反应肿瘤的存在及其严重程度。对于血cDNA来源有几种推测:(1)肿瘤细胞的坏死和凋亡释放大量DNA;(2)循环血或微转移灶中肿瘤细胞溶解释放DNA;(3)肿瘤细胞自身向周围释放DNA;(4)肿瘤浸润周围正常组织细胞、组织变性释放DNA。
本研究中,利用灵敏度极高的实时荧光定量Real-time PCR技术,定量检测健康体检者、卵巢良性肿瘤患者及卵巢癌患者血清cDNA。结果显示,各期卵巢癌患者血清cDNA均明显高于健康体检者和卵巢良性肿瘤患者,提示血清cDNA含量检测对卵巢癌的诊断具有重要参考价值。对cDNA含量与卵巢癌临床分期关系的分析显示,随着临床分期的增加,血清cDNA含量逐渐增高,提示卵巢癌各期cDNA含量会显着增高,但与卵巢癌分期无明显相关性;Ⅳ期cDNA含量显着高于前3期,提示卵巢癌晚期cDNA含量会进一步显着增高。
综上所述,随着各种分子生物学技术快速发展和广泛应用,利用灵敏度极高的实时荧光定量PCR技术,定量检测卵巢癌患者血清cDNA具有简单易操作,创伤小等优点,对于手术后的患者无法取组织检测化验,可助其实时监测手段。作为一种微创而便捷的辅助手段,在卵巢癌的早期诊断、临床分期、疗效评估和预后判断等方面具有较高的应用价值。
4参考文献
[1] Anker P , Mulcahy H, Chen XQ , et al .Detection of circulating tumor DNA in the blood(plasma/serum)of cancer patients[ J] .Cancer Metastasis Rev, 1999(1):65-73.
[2] 赵心亮,田广明,田亚平.人体循环游离DNA应用的研究进展[J].临床检验杂志, 2013(2):109-114.
[3] 闫巍.肿瘤循环DNA的研究进展[J].实用肿瘤学杂志, 2013(4):359-362.
[4] 孙朝晖,石玉玲,危敏,等.血浆循环DNA检测在鼻咽癌诊断研究中的应用[J].华南国防医学杂志, 2009(3):49-51.
[5] 倪培民,孙然,王雷,等.恶性肿瘤循环DNA的研究进展[J].中国实验诊断学, 2011(1):172-174.
[6] 彭亮,娄晓丽,侯彦强.循环DNA的研究进展[J].国际检验医学杂志 ,2013(18):2424-2426.
[7] 张世强,王保庆,王海清,等.非小细胞肺癌患者血清游离DNA定量检测的临床意义[J].山西医科大学学报, 2014(10):944-946.
[8] 吴晓鸿,吴乃文,刘惜时.血清DNA定量在上皮性卵巢癌诊断中的应用研究[J].中国妇幼保健, 2009(10):1413-1415.
[9] 王俊宏,潘世扬,黄佩君,等.荧光定量聚合酶链反应肺癌患者血清循环DNA的临床应用[J].中华检验医学杂志, 2003(12):791.
(2016-01-12收稿,2016-04-25修回)
中文编辑: 刘平; 英文编辑: 刘华
Clinical Application Value of Quantitative Detection of Serum Circulating DNA in Diagnosis of Ovarian Cancer
LIU Lirong1, WEN Chunrong2, LIANG Lu2, LIU Yongmei1, ZHU Liying1
(1.DepartmentofClinicalHematology,theCollegeofClinicalLaboratoryScience,GuizhouMedicalUniversity,Guiyang550004,Guizhou,China;2.DepartmentofClinicalLaboratory,GuiyangWomenandChildrenHospital,Guiyang550003,Guizhou,China)
[Abstract]Objective: To explore application value of quantitative detection of serum circulating DNA(cDNA) in diagnosing ovarian cancer. Methods: 252 cases of pathologically confirmed patients with epithelial ovarian cancer were enrolled as ovarian cancer group, 100 cases of patients with benign ovarian cancer as benign control group, and 100 healthy people as healthy control group. Micro-genomic DNA extraction kit was adopted to extract the serum circulating DNA from the three groups and Real-time fluorescence quantitative PCR was adopted to detect the serum cDNA level. Results: There was no significantly statistical difference in level of serum cDNA between benign control group and healthy control group. There was significantly statistical difference in level of serum cDNA between ovarian cancer group and benign control group or between ovarian cancer group and healthy control group(P<0.05). In different clinical stage epithelial ovarian cancer, there was no difference in level of serum cDNA. Conclusion: Quantitative detection of serum cDNA of patients with ovarian cancer might be a novel auxiliary method for diagnosis of ovarian cancer.
[Key words]serology; DNA; ovarian cancer; diagnosis technique and method
*[基金项目]贵州省科学技术基金[黔科合J字(2011)2233号]
[中图分类号]R737.31; R737.33
[文献标识码]A
[文章编号]1000-2707(2016)05-0543-03
DOI:10.19367/j.cnki.1000-2707.2016.05.012
网络出版时间:2016-05-13网络出版地址:http://www.cnki.net/kcms/detail/52.5012.R.20160513.2108.034.html



