兰咏哲, 李启瑞, 黄劲, 赵亮, 董宇华, 阚雨, 王迪, 廖万清, 康颖倩*
(1.贵州医科大学 基础医学院 微生物学教研室, 贵州 贵阳 550025; 2.贵州省微生物与人类健康关系研究人才基地 & 贵州省普通高校病原生物学特色重点实验室, 贵州 贵阳 550025; 3.贵州医科大学 基础医学院 生物化学与分子生物学教研室, 贵州 贵阳 550025; 4.中国人民解放军海军军医大学 上海长征医院真菌学研究所, 上海 200003)
余甘子(Phyllanthusemblica)为大戟科(Euphorbiaceae)灌木植物[1],是中国维吾尔族、傣族、壮族及布依族等多个民族的习用药材[2-3]。余甘子药用部位主要是果实,目前研究也大多以余甘果为主体[3-5]。现代药理学研究证实,余甘子具有广泛的抗菌能力、抗炎作用及极强的抗氧化能力,并且无明显的毒副作用[6-9]。内生真菌是指某阶段生活于健康植物体内,但不引起植物组织明显病害症状的真菌[10-12]。根据Stierle等[13]提出的“内共生理论”,内生真菌不仅可产生与宿主植物次生代谢产物相同或者相似的物质,还可以产生其它类型的活性物质,对宿主植物生长发育、对外界环境的应激耐受性、有效活性成分的产生与积累等方面有重要影响。内生真菌在药物开发和生物防治等方面显示出较好的应用价值[14-17],可有效缓解药用植物资源匮乏、栽培药材品质下降等问题[18]。研究发现,余甘子果实药用价值较好[1],但对其内生真菌的研究还未见报道。因此,本研究通过对余甘子内生真菌进行研究,分析其物种多样性,同时探究代谢产物的抗菌活性、抗氧化作用及其与余甘子的化学成分的相关性,以期为研究药用植物内生真菌及开发新的药物资源提供参考依据。
1 材料与方法
1.1 材料
1.1.1余甘子和菌株 贵州省关岭县10月份野生健康成熟新鲜的余甘子果实,置于4 ℃冰箱保存;标准菌株由本校真菌实验室提供。
1.1.2主要试剂与仪器 Ezup柱式真菌基因组DNA抽提试剂盒、Genstar 聚合酶链式反应(polymerase chain reaction,PCR) MIX、T100 PCR仪及电泳仪(美国 BIO-RAD)、Thermo 17R小型台式高速离心机及HH-B11恒温培养箱(上海跃进)。
1.2 方法
1.2.1内生真菌的分离 取余甘子新鲜果实,采用次氯酸钠作表面消毒处理:次氯酸钠(含5%有效氯量)浸泡3 min,无菌去离子水洗涤2次,75%乙醇浸泡1 min,无菌去离子水洗涤3次;进行真菌组织分离[19],即将果实用无菌手术刀切成直径0.5 cm大小,无菌条件下将果实块接种于马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA),25 ℃恒温培养3~10 d,连续观察到组织块表面长出真菌后,挑针挑取少量菌丝放到新的PDA培养,同时选取表面消毒最后1次冲洗的无菌去离子水及同批次空白培养基作对照。
1.2.2菌株的鉴定及系统发育树的构建 根据菌落的形态、菌丝及孢子的形态进行初步鉴定,并提取全基因组,采用转录间隔区(internal transcribed spacer, ITS)基因通用引物ITS-4(3′-CGTATAGTTATTCGCCTCCT-5′)、ITS-5(3′-GGAAGTAAAAGTCGTAACAAGG-5′)进行PCR扩增,序列送公司测序(上海生工);获得的序列结果在美国国立生物技术信息中心(national center for biotechnology information,NCBI)数据库 (http://www.ncbi.nlm.nih.gov/blast)进行下载与比对,同时构建系统发育树,即使用Bioedit 软件处理测序结果、并进行序列比对,使用Mega 7选择最佳建树模型,构建邻接法(neighbor-joining method,N-J)系统发育树。
1.2.3余甘子果汁制备 按1.2.1对余甘子新鲜果实进行表面消毒处理,采用研磨器研磨取浆,12 000 r/min离心2 min,取上清,为余甘子果汁,4 ℃保存备用。
1.2.4内生菌发酵液的抑菌活性测定 将分离获得的菌株接种于PDA固体培养基中25 ℃活化3 d,挑取活化后菌丝380 mg转接到马铃薯葡萄糖液体培养基(potato dextrose broth,PDB)100 mL,25 ℃、180 r/min摇床恒温培养7 d[20],9 000 r/min离心15 min,保存上清备用,为发酵液[21];采用溶菌肉汤(lysogeny broth,LB)和PDB培养基对大肠杆菌、金黄色葡萄球菌及白色念珠菌标准株(ATCC25922、ATCC25923、ATCC10231)进行菌株活化[22];5 000 r/min 离心收集大肠杆菌、金黄色葡萄球菌和白色念珠菌的菌体,生理盐水悬浮菌体并分别对各指示菌菌悬液进行梯度稀释,稀释至1×106CFU/mL;取指示菌菌液100 μL分别接种于LB和PDA固体培养基,无菌玻璃涂布棒充分涂布;培养基平板中央贴上已灭菌的滤纸片(直径5 mm),并分别滴加发酵上清液及余甘果果汁20 μL,同时滴加生理盐水作阴性对照,25 mg/L氯霉素作为大肠杆菌和金黄色葡萄球菌的阳性对照,20 mg/L氟康唑作为白念珠菌的阳性对照;采用十字交叉法测量抑菌圈直径。
1.2.5真菌的抗氧化作用研究[23-24]将分离获得的菌株用PDA平板培养基活化3 d,无菌打孔器(直径0.6 cm)取1个菌饼接种于PDB培养基,25 ℃、180 r/min摇床活化7 d;5 000 r/min 离心2 min,获上清液;取发酵上清液5 mL,加乙酸乙酯5 mL萃取3 h,取适量乙酸乙酯萃取液进行后续实验;配制0.5、1.0、1.5、2.0、2.5、3.0、4.0、5.0及10.0 g/L浓度梯度的维生素C(Vitamin C,Vc)溶液、0.6 mol/L 硫酸、28 mmol/L磷酸钠及4 mmol/L钼酸铵溶液,并将其等量混合制为混合液;分别移取上述不同浓度梯度的Vc溶液0.1 mL于试管中,加等量混合液5 mL,95 ℃水浴加热90 min,取试管冷却至室温;以不加入Vc溶液的混合液作为阴性对照,695 nm 波长测定其吸光度,绘制抗坏血酸总抗氧化能力标准曲线;分别取不同内生真菌菌株的乙酸乙酯萃取液0.1 mL,同上述Vc测定方法测定其吸光度,每个菌株重复3次;同1.2.3的方法制备余甘子原浆,分别移取原浆0.1 mL及原浆的乙酸乙酯萃取液0.1 mL,同上法测定。按照Vc标准曲线,计算每毫升发酵液相当于Vc的量(μg),同时以未接种内生真菌的空白培养基作为阴性对照。
1.3 统计学分析

2 结果
2.1 内生真菌的分类鉴定
健康成熟新鲜余甘子果实中分离出内生真菌43株,其中青霉属(PenicilliumLink)19株、横梗霉属(LichtheimiaVuill.)9株、间座壳属(DiaportheNitschke)11株、叶点霉属(PhyllostictaPers.)1株、葡萄座腔菌属(NeofusicoccumCrous, Slippers & A.J.L. Phillips)3株,青霉属为优势属(图1);青霉属分离出菌种2个(Penicilliumchrysogenum和Penicilliumchermesinum),其中P.chrysogenum分离出15株,数量最多,为优势菌种(图2)。
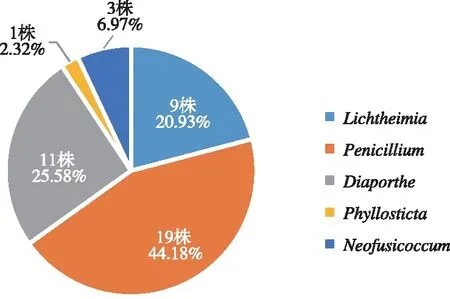
图1 43株余甘子内生真菌菌属的构成Fig.1 The genus composition of 43 endophytic fungi of Phyllanthus emblica

图2 43株余甘子内生真菌菌种的构成Fig.2 The species composition of 43 endophytic fungi of Phyllanthus emblica
2.2 分离菌株系统发育分析
对分离出的内生真菌基于ITS序列进行比对,每个菌属选择1个标准菌株,共有分离株43株,标准株5株,构建N-J系统发育树。见图3。
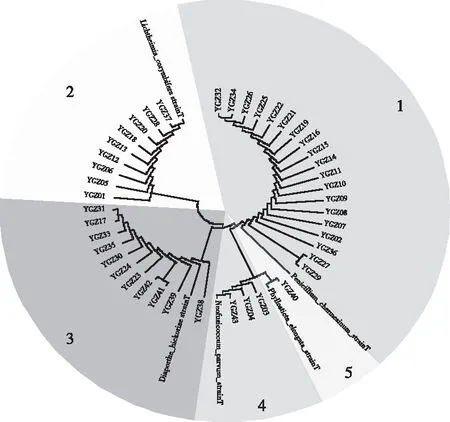
注:1为青霉属(Penicillium),2为横梗霉属(Lichtheimia),3为间座壳属(Diaporthe),4为葡萄座腔菌属(Neofusicoccum),5为叶点霉属(Phyllosticta)。图3 43株菌株基于ITS序列的构建系统发育树Fig.3 Phylogenetic tree of 43 strains based on ITS sequences
2.3 抑菌活性测试
43株内生真菌培养7 d的发酵液上清液对大肠杆菌、金黄色葡萄球菌及白念珠菌均无抑制效果,但余甘子果汁对金黄色葡萄球菌和大肠杆菌均有抑制作用,对白念珠菌无抑制效果。见表1。

表1 余甘子果汁对3种标准株抑菌活性Tab.1 Antibacterial activity of P. emblica against three type strains
2.4 抗氧化能力测试
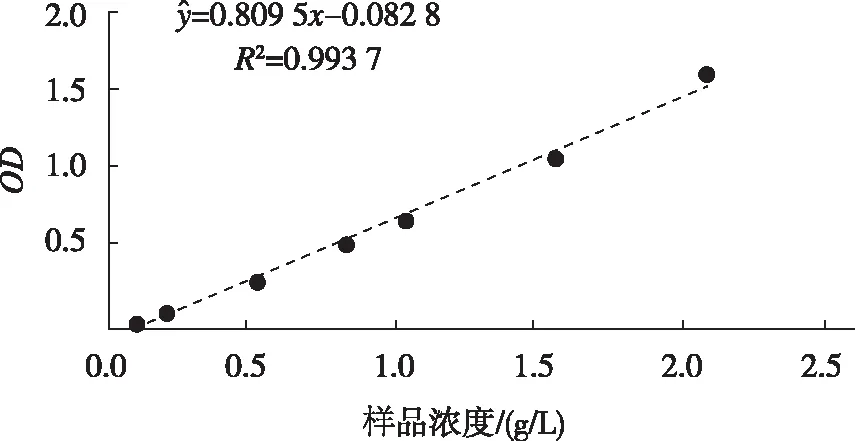
图4 Vc标准曲线Fig.4 Standard curve of Vc
表2 余甘子内生真菌发酵液的总抗氧化能力Tab.2 The total antioxidant capacity of endophytic fermentation broth from P. emblica
3 讨论
本次研究从贵州关岭地区余甘子果实中共分离出内生真菌43株,分属于5个属9个菌种,包含青霉属菌种2个(P.chrysogenum和P.chermesinum)、横梗霉属菌种1个(Lichtheimiaornata)、间座壳属菌种4个(Diaporthehongkongensis、Diaporthepseudophoenicicola、Diaporthemusigena及Diaporthehickoriae)、葡萄座腔菌属菌种1个(Neofusicoccumocculatum)以及叶点霉属菌种1个(Phyllostictafallopiae),提示内生真菌多样性丰富。在分离出的菌株中,青霉属分离率为44.18%,其中P.chrysogenum分离出的菌株最多(15株),为优势菌种。N-J法构建的系统发育树显示,43株内生真菌在种群分布上存在差异,分属于5个属的2个门。其中,青霉属真菌被证明具有分泌多种高活性的脂肪、蛋白质、多糖和木质素等多聚物的酶类的功能,与植物共生时也起着一定的抗菌的作用[25],但在本研究中未发现相似的功能,这可能与宿主的种类及宿主环境有关。此外,横梗霉属和间座壳属占本次分离菌株的20.93%和25.58%,与青霉属一起作为余甘子内生真菌的优势菌属,这些菌属的菌株作为内生真菌也常出现在其他植物中[26-27]。研究表明,这些真菌与植物病原菌有相同的生态位,在宿主体内相互竞争营养、空间等,使病原菌得不到正常的营养供给而消亡,从而增强宿主抵御病害的能力[28]。
分离得到的43株内生真菌中有2株(YGZ03和YGZ04)展现出较好的抗氧化效果,明显高于空白对照,其他41株内生真菌也有一定的抗氧化能力,但效果比之前的2株菌低,说明余甘子极高的抗氧化作用可能与它的内生真菌有关,这在其他植物中也有相关报道[13,24]。有研究发现,余甘子的抗氧化作用主要与其多酚、总黄酮及Vc的含量有关[26],植物内生真菌往往可以产生与宿主植物次生代谢产物相同或者相似的物质[13],而这些化合物质与内生真菌代谢产物是否具有相关性,还待进一步研究。
本研究中发现的2株(YGZ03、YGZ04)具有较好抗氧化作用的内生真菌菌株均属于葡萄座腔菌属的N.occulatum种。该菌属往往被认为是引起植物病害的原因[29]。也有研究发现葡萄座腔菌属的一株J11菌株具有产紫杉醇的能力[18],但该菌属并没有作为抗氧化菌株引起人们的注意,而抗氧化性可以有效增强植物的抗逆性,本次研究也发现了该菌属作为植物内生真菌的新的功能。
综上所述,本研究结果表明贵州关岭地区余甘子内生真菌资源丰富,分属于2个门5个菌属;余甘子果汁具有较强的抑菌能力,但内生真菌无明显抑菌效果。此外,发现43株内生真菌均具有一定的抗氧化活性,其中2株抗氧化活性较好。



